发光二极管红光对实验性高脂血症大鼠血脂的调节作用①
卢建丽,刘翠霞,尹昱,安经克,贾子善
高脂血症是临床上的常见病,多发病,与心脑血管疾病的发生密切相关,如何安全有效地降低血脂已成为临床研究的热点。有研究表明,低强度激光照射治疗可以降低血脂含量[1],改善血液流变学[2]。发光二极管(LED)红光波长390~670 nm,与低强度激光的波长范围相似,且具有功耗低、易集成、可靠性高、发光光谱单色性好、波段范围宽等特点[3]。本科小样本临床试验初步显示,LED红光在调节血脂方面有一定的作用。为此,我们在建立大鼠高脂血症模型的基础上,观察LED红光照射对高脂血症大鼠血脂的调节作用。
1 材料与方法
1.1 实验动物
清洁级近交系雄性Sprague-Dawley大鼠36只,8周龄,体重218~287 g,购自北京维通利华实验动物技术有限公司,合格证号:SCXK(京)2006-0009。每笼5只,清洁级饲养环境,温度18~22℃,湿度50%~60%。所有大鼠适应性喂养普通饲料1周后,随机分为正常对照组(n=12)和高脂模型组(n=24)。正常对照组喂普通饲料,高脂模型组喂高脂饲料。高脂饲料喂养6周后,用3%戊巴比妥钠30 mg/kg腹腔注射麻醉,内眦静脉丛取血,分离血清,测定空腹血清胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)低密度脂蛋白(low-density lipoprotein,LDL-C)、高密度脂蛋白(high-density lipoprotein,HDL-C)含量。两组间有非常高度显著性差异(P<0.001),造模成功。见表1。造模成功后再将高脂模型组大鼠随机分为高脂对照组和LED治疗组。
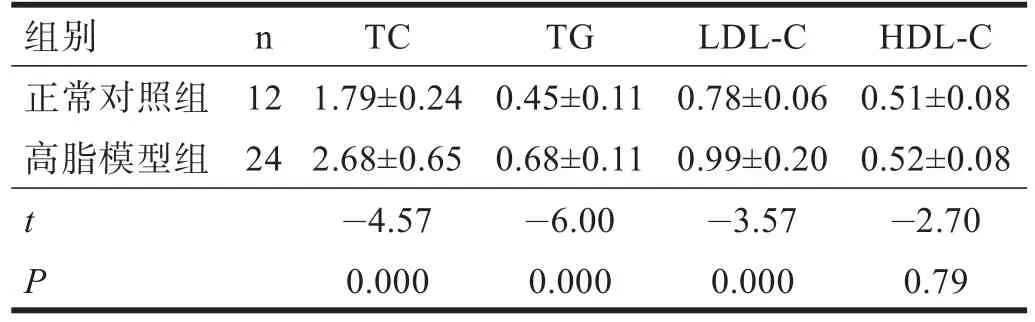
表1 高脂饮食6周时血脂水平(mmol/L)
1.2 高脂饲料配方
2%胆固醇、10%猪油、10%蛋黄粉、0.2%胆酸钠、77.8%普通饲料按比例计算出所需量,于河北医科大学实验动物学部统一加工而成。普通饲料购自河北医科大学实验动物学部。
1.3 主要试剂及仪器
TC试剂、TG试剂、低密度脂蛋白(low-density lipoprotein,LDL-C)试剂、高密度脂蛋白(high-density lipoprotein,HDL-C)试剂、总酯酶试剂盒:南京建成生物工程研究所,批号:201011,201011,2010019,2010028,20110322;兔抗大鼠羟甲基戊二酰辅酶A还原酶(3-hydroxy-3-methylglutaryl coenzyme A reducase,HMG-CR)多克隆抗体:Santa Cruz公司,批号:10210;红光治疗仪(PKHGY-Ⅱ型):河北普康医疗设备有限公司。
1.4 LED照射
将LED治疗组大鼠放到自制的鼠笼中(120×60×60 mm),鼠笼置红光治疗仪光头上,使光头对准大鼠的腹部,每次照射30 min,每天1次,连续照射28 d。照射期间各组喂养饲料不变。
1.5 血清TC、TG、LDL-C和HDL-C的测定
分别于照射前和照射第29天,大鼠禁食12 h后,3%戊巴比妥30 mg/kg腹腔注射,内眦静脉丛取血,3000 r/min离心10 min,分离血清,用半自动生化分析仪(德国豪迈)测定TC、TG、LDL-C和HDL-C的含量。
1.6 血浆脂蛋白脂酶(lipoprotein lipase,LPL)和肝脂酶(hepatic lipase,HL)的测定
于照射后第29天,大鼠尾静脉注射肝素130 U/kg[4],15 min后内眦静脉丛采血,制备血浆。参照改良的Krauss和Blache的方法[5-7],在37℃、pH=8.3的条件下,将肝素后血浆与底物(脂肪乳剂)一起保温30 min,血浆中的LPL和HL可将底物中的TG水解为甘油和游离脂肪酸(FFA)。用铜试剂法测定生成的FFA量,即可分别计算出LPL和HL的活性。
1.7 免疫组织化学染色
于照射后第29天,大鼠禁食12 h,3%戊巴比妥30 mg/kg腹腔注射麻醉,留取所需的血液标本后腹主动脉放血处死大鼠,立即取出肝脏,冰生理盐水漂洗3次,滤纸吸干,在肝脏最大叶距边缘1 cm处取1×1×1 cm肝组织,4%多聚甲醛固定,梯度乙醇脱水,二甲苯透明,石蜡包埋,切片厚5 μm。将各组切片置于二甲苯中脱蜡,梯度酒精水化,高压热抗原修复,3%H2O2封闭内源性过氧化物酶,正常山羊血清封闭非特异性抗原。滴加HMG-CR抗体(1∶75),4℃冰箱过夜。用兔抗鼠二抗37℃恒温孵育60 min,加DBA显色液,室温下反应,显微镜下染色充分,PBS漂洗,苏木素复染,梯度酒精逐级脱水,二甲苯透明,树胶封片。每张切片选取5个视野,用多功能真彩色细胞图像分析管理系统,在同一光强度、同一放大倍数下进行图像分析,分别记录每张切片的阳性细胞数分级及阳性细胞显色强度(5个视野的均值),并进行总评分[8]。
阳 性 细 胞 数 分 级 (A): 0~1%=0, 1%~10%=1,10%~50%=2,50%~80%=3,80%~100%=4。
阳性细胞数显色强度分级(B):0=阴性,1=弱阳性,2=阳性,3=强阳性。
总评分(IHS)=A×B
1.8 统计学分析
2 结果
2.1 血清TC、TG、LDL-C和HDL-C
照射前,LED治疗组与高脂对照组血清TC、TG、HDL-C和LDL-C均无显著性差异。照射后,与高脂对照组相比,LED治疗组血清TC、TG和LDL-C明显降低(P<0.01),HDL-C 明显升高(P<0.01)。见表2、表3。
2.2 血浆LPL、HL活性
照射28 d后,高脂对照组大鼠血浆LPL、HL的活性低于正常对照组(P<0.05);LED治疗组大鼠血浆LPL、HL活性明显高于高脂对照组(P<0.01);LED治疗组大鼠血浆LPL、HL的活性高于正常对照组,但无显著性差异(P>0.05)。见表4。
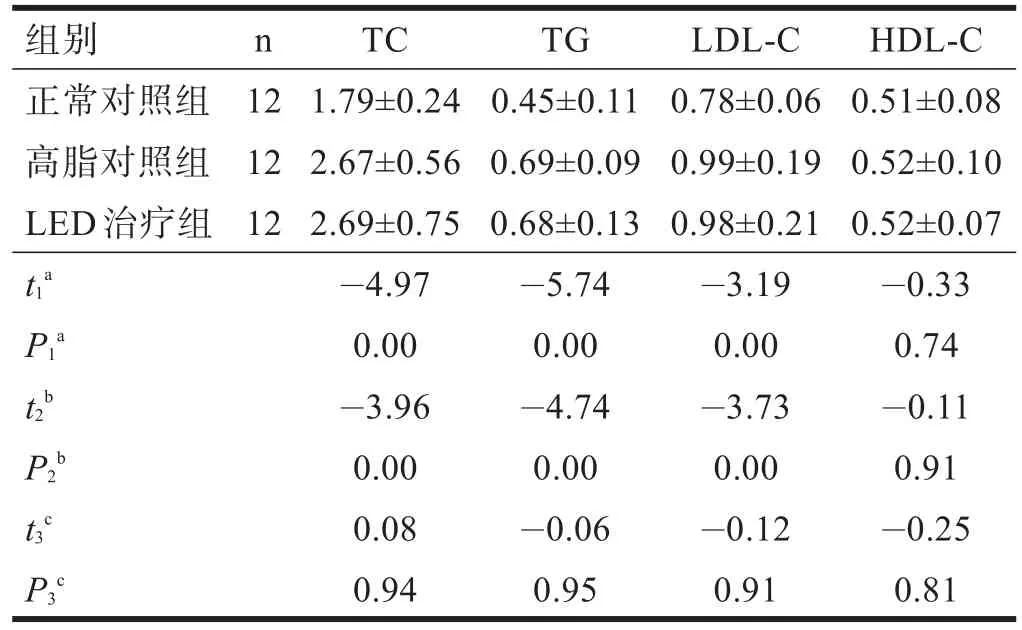
表2 LED红光照射前各组血脂水平(mmol/L)
2.3 HMG-CR
HMG-CR阳性部位在肝细胞胞浆内,呈棕黄色。见图1。正常对照组大鼠肝脏中央静脉及汇管区周围可见散在分布的阳性细胞,免疫组化评分(1.9±0.99)。高脂对照组大鼠肝脏中央静脉及汇管区周围可见较多阳性细胞,免疫组化评分(3.8±1.99),高于正常对照组(t=-2.70,P=0.02)。LED治疗组阳性细胞数少,免疫组化评分(2.1±1.29),低于高脂对照组(t=-2.27,P=0.04)。
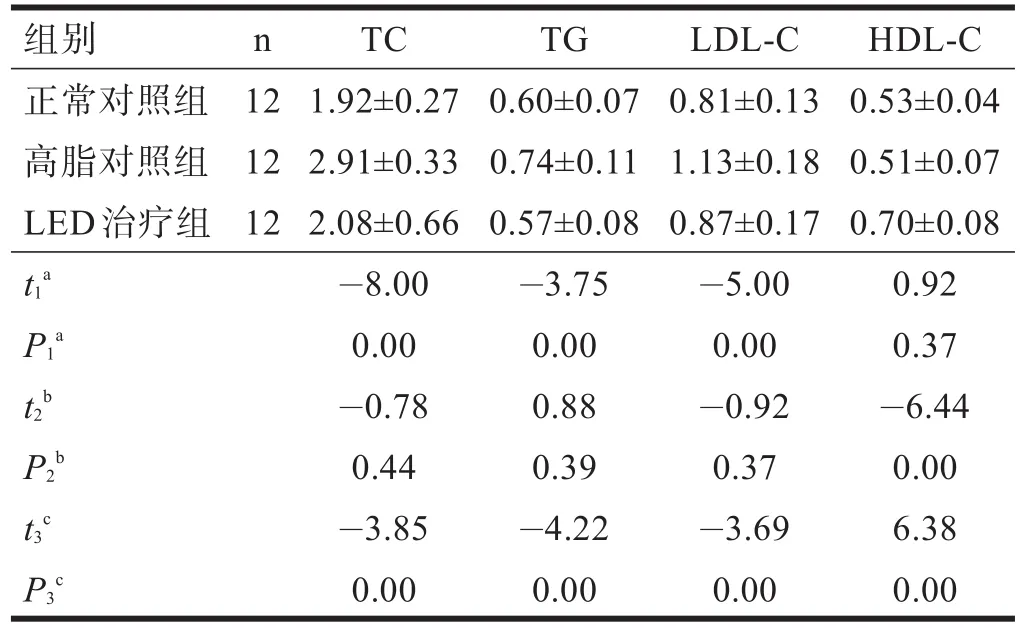
表3 LED红光照射后各组血脂水平(mmol/L)
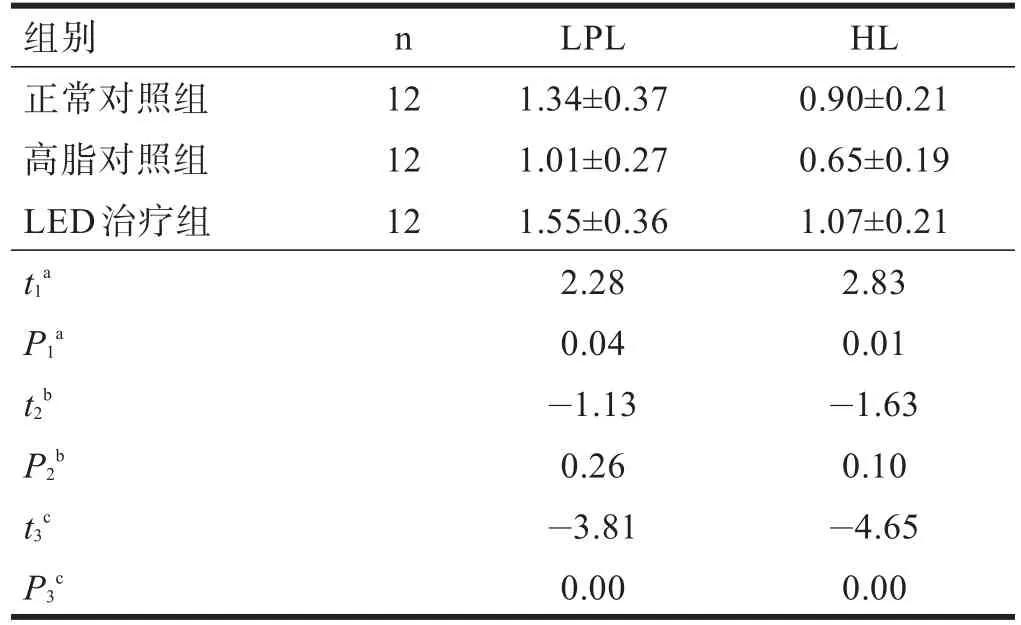
表4 LED红光照射后各组血浆LPL、HL活性(U/ml)

图1 各组HMG-CR表达(免疫组织化学染色,100×)
3 讨论
红光是指用物理学方法滤去对皮肤有损害作用的紫外线和具有明显热效应的红外线,仅保留600~700 nm波段的红光,其主要作用是光化学作用,而并非热效应。
目前临床上应用的红光大多为低强度激光。LED红光作为一种新型的光源,其波长范围与低强度激光相同,且具有成本低、节能、光束面积大等优点,正广泛应用于医疗照明、美容及肿瘤治疗等领域,而应用LED红光调节血脂的相关研究,国内外还比较少见。
有研究表明,血浆脂质浓度的高低与脂蛋白代谢密切相关,调节影响脂蛋白代谢的酶活性即可调节血浆脂质浓度[9]。LPL和HL是脂质代谢过程中两个关键酶,其缺陷或活性降低,均可导致甘油三酯血症水平升高。
LPL可以催化乳糜微粒(CM)和极低密度脂蛋白(VLDL-C)核心的TG分解为脂肪酸和单酰甘油酯,以供组织氧化和贮存。同时还参与VLDL和HDL间的载脂蛋白和磷脂的转换。LPL活性的增强可影响血浆中TG和胆固醇(TC、LDL-C、HDL-C、VLDL-C等)的水平,从而调节血浆中脂蛋白的代谢,降低高脂血症的发生[10-11]。
HL是血液中内源性TG代谢的关键酶之一。研究表明,HL可水解CM、VLDL-C和LDL-C,释放出FFA[12],还可以选择性作用于HDL2,水解其中的甘油三酯和磷脂,有助于肝摄取HDL2中胆固醇及胆固醇酯,在胆固醇的逆向转运中起重要作用[13]。
LED红光照射可以增加高脂血症大鼠血清LPL和HL的活性,可促进甘油三酯的水解和胆固醇的逆向转运,进而发挥调节血脂的作用。
HMG-CR是胆固醇合成过程中的限速酶,它存在于胞浆及滑面内质网膜上。抑制HMG-CR活性,能减少胆固醇合成时,促使细胞消耗储存的胆固醇,进而促使肝细胞增加LDL-C受体的数量与活性,加强对血液中LDL-C的摄取利用,从而将低血中总胆固醇及LDL-C,同时影响其他脂类的代谢。
我们推测,LED红光照射可能会抑制肝脏HMG-CR,使血清胆固醇浓度降低。LED红光如何作用于HMG-CR,机制尚不清楚,有待于进一步研究。
[1]池景泉,胡桂芳,林湘,等.低强度激光鼻腔内照射对血脂异常作用的研究[J].激光生物学报,2005,14(4):265-268.
[2]杨玉东,陆战红,梁勇,等.低功率半导体激光血管外照射对血脂、血液流变学指标的影响[J].激光杂志,2002,23(1):80-81.
[3]Sazonv AM,Romanov GA,Portnoy LM.Low intensity non-coherent red light in the complex treatment of peptic ulcer[J].Ulcer Soviet Medicine,1985,12:42-46.
[4]张琪,马博,朱玲玲,等.银杏叶提取物对实验性高脂血症大鼠的调节机制[J].华西药学杂志,2007,22(6):605-608.
[5]Krauss RM,Lecy RI,Fredrickson DS.Selective measurement of two lipase activities in postheparin plasma from normal subjects and patients with hyperlipoproteinemia[J].J Clin Invest,1974,54(5):1107-1124.
[6]Blache D,Bouthillier D,Davignon J.Simple,reproducible procedure for selective measurement of lipoprotein lipase and hepatic lipase[J].Clin Chem,1983,29(1):154-158.
[7]张蓉,刘宇,刘秉文.血浆脂蛋白及肝脂酶的比色测定法[J].华西医科大学学报,1996,27(1):106-110.
[8]Soslow RA,Dannenberg AJ,Rush D,et al.Cox-2 is expressed in human pulmonary,colonic,and mammary tumors[J].Cancer,2000,89(12):2637-2645.
[9]Nakaya N,Homma Y,Tamachi H,et al.The effect of CS-514 on serum lipids and apolipoproteins in hypercholesterolemic subjects[J].JAMA,1987,257(22):3088-3093.
[10]Pulinikunnil T,Rodrigues B.Cardiac lipoprotein lipase:metabolic basis for diabetic heart disease[J].Cardiovasc Res,2006,69(2):329-340.
[11]Tsutsumi K.Lipoprotein lipase and atherosclerosis[J].Curr Vasc Pharmacol,2003,1(1):11-17.
[12]Kirchgessner TG,Chuat JC,Heinzmann C,et al.Organization of the human lipoprotein lipase gene and evolution of the lipase gene family[J].Proc Natl Acard Sci USA,1989,86(24):9647-9651.
[13]Junik R,Piechowski A,Sowiński J,et al.The thyroid function markers and their prognostic significance patients with ischemic stroke[J].[in Polish].Neurol Neurochir Pol,1995,29(3):317-323.

