TS、TOPO-Ⅰ、ERCC1基因在结直肠癌组织中的表达及其临床意义
姜梅玲 刘玉龙 李 元 卞华慧 陈炜博 王优优 张 英 孔雪源
(苏州大学附属第二医院,江苏 苏州 215004)
化疗为中晚期结直肠癌的主要治疗方法,化疗的主要药物为氟尿嘧啶类、喜树碱衍生物类、铂类及分子靶向类药物。相关研究表明〔1~4〕,TS、TOPO-I、ERCC1 蛋白表达情况可以预测化疗药物的疗效及毒副反应,化疗前通过检测TS、TOPO-I、ERCC1蛋白或基因多态性的表达,制定合理的化疗方案,有利于提高治疗的疗效,延长患者生存期,提高生活质量。本研究检测了结直肠癌患者肿瘤组织中TS、TOPO-I、ERCC1的蛋白表达情况,并探讨其与结直肠癌临床病理学特征之间的关系。
1 材料与方法
1.1 标本来源 标本取自术后肿瘤组织的石蜡块或活检后甲醛溶液固定组织。均经病理诊断证实。术前或活检前未行任何放、化疗。
1.2 临床资料 2011年1月至2012年7月在我院住院的111例结直肠癌患者中男性61例,女性50例;年龄28~81岁,中位年龄54.5岁;结肠癌52例,直肠癌59例;T分期:T1+T2 14例,T3+T4 97例;淋巴结转移情况:N0 10例,N1 73例,N2 28例;肿瘤分化程度:高分化10例,中分化76例,低分化24例,未分化1例。
1.3 实验试剂 S-P免疫组化试剂盒购自福州迈新公司。TS抗体(稀释比例:1∶100)购自福建迈新公司。TOPO-I、ERCC1抗体(稀释比例:1∶100)购自北京中衫公司。
1.4 实验方法 免疫组化染色法采用SP法检测TS、TOPO-I、ERCC1的蛋白表达。常规脱蜡、乙醇梯度水化,枸橼酸盐抗原热修复,滴加内源性过氧化物酶阻断剂,37℃ 10 min,滴加一抗(TS、TOPO-I、ERCC1,1∶50),4℃过夜,滴加聚合物增强剂(试剂A),室温下孵育20 min,后再滴加酶标抗鼠/兔聚合物(试剂B),室温下孵育30 min,DAB显色3~10 min,苏木素复染、脱水、透明。中性树胶封片后镜下观察,以PBS代替一抗作为阴性对照,用已知的阳性片做阳性对照。
1.5 免疫组化结果判断标准 由2名未参与实验研究、不了解患者临床资料的病理医生分别独立观察所有切片。遇结果不一致时,由2人协商决定。以细胞质和(或)细胞核膜出现棕红色颗粒为阳性,随机取5个高倍视野,TS、ERCC1按细胞核和细胞质显色深浅计分,无阳性反应细胞为0分,浅红色为1分,棕红色为2分,棕褐色为3分。0~1分判断为低表达(+),2分判断为中表达(⧺),3分判断为高表达(⧻)。TOPO-I按细胞核着色程度评判,<10%为低表达,10% ~50%为中表达,>50%为高表达。
1.6 近期疗效和生存评价 在完成3个周期FOLFOX或FOLFIRI方案化疗后,进行胸部、腹部和盆腔CT或MRI检查。按实体瘤疗效评价标准(RECIST)评价近期疗效,分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD);其中,CR和PR病例数之和为治疗有效病例,有效率(RR)为治疗有效病例数占全部病例数的百分比。计算无进展生存期(PFS)和总生存期(OS),PFS是指从一线化疗开始至PD或死亡的时间,OS是指从一线化疗开始至死亡或末次随访的时间。随访方式为门诊或电话随访,末次随访时间为2012年7月1日。
1.7 统计学方法 肿瘤组织中TS、TOPO-I、ERCC1的蛋白表达与临床病理资料的相关性均采用χ2检验分析。所有统计分析由SPSS17.0软件完成。
2 结果
2.1 TS、TOPO-I、ERCC1在111例结直肠癌组织标本中的表达 TS、ERCC1表达主要集中在细胞质和细胞核中,TOPO-I表达主要集中在细胞核中。见图1。
2.2 TS、TOPO-I、ERCC1表达与结直肠癌临床病理特征之间的相关性 TS、TOPO-I、ERCC1的蛋白表达与患者的性别、年龄、肿瘤部位、T分期、淋巴结转移情况及分化程度等临床病理特征均无明显差异性(P>0.05)。见表1。
2.3 疗效及生存评价 根据NCCN指南中提出的结直肠癌化疗的适应证和建议的化疗方案及联合ERCC1的检测结果,对50例患者采用了FOLFOX方案化疗。考虑患者检测的时间不一致,只对其中40例患者进行10~14个月的疗效及预后随访,即中位随访时间为1年。结果提示:CR 5例(12.5%),PR 16例(40.0%),PD 14例(35.0%),SD 5例(12.5%),有效率为52.5%。PFS最少为3个月,最长者未知;在这一年的随访中无死亡病例,OS需要继续随访观察。TOPO-I在111例结直肠癌肿瘤组织中,近50例患者TOPO-I为高表达,根据检测结果对39例患者行FOLIFRI方案化疗,后对其中30例患者进行疗效及预后随访。结果提示:CR2例(6.7%),PR10例(33.3%),PD6例(20.0%),SD2例(6.7%),有效率为 40%。PFS最少为5个月,最长者未知;在这一年的随访中无死亡病例,OS需要继续随访观察;在化疗过程中及化疗后患者的不良反应较轻。
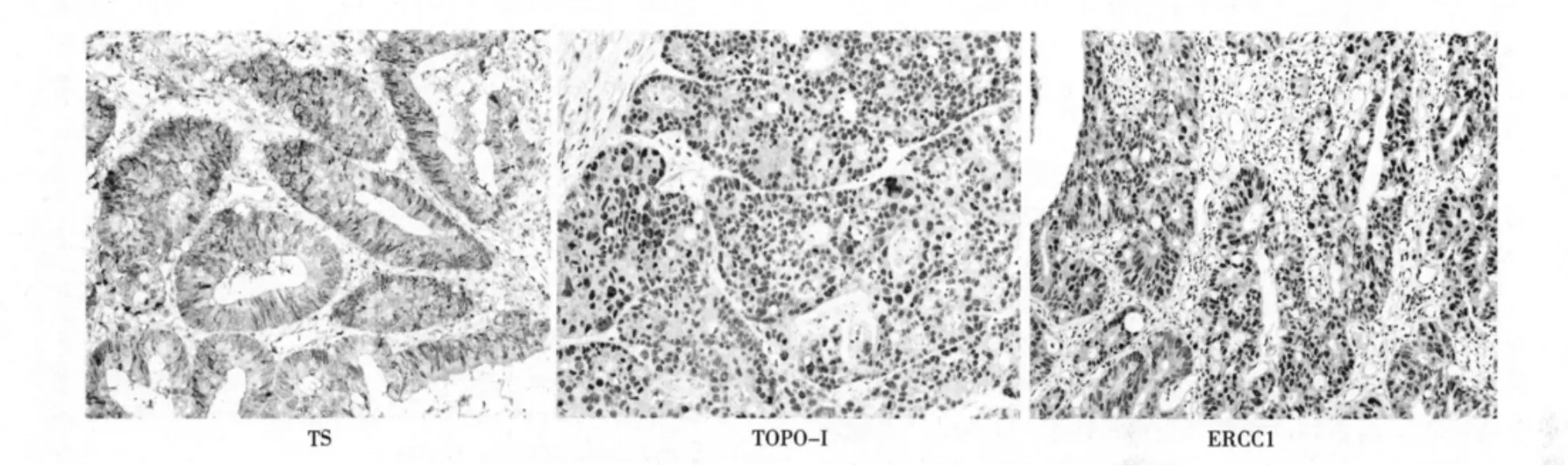
图1 TS、TOPO-Ⅰ、ERCC1在结直肠癌组织中的表达(DAB,×400)
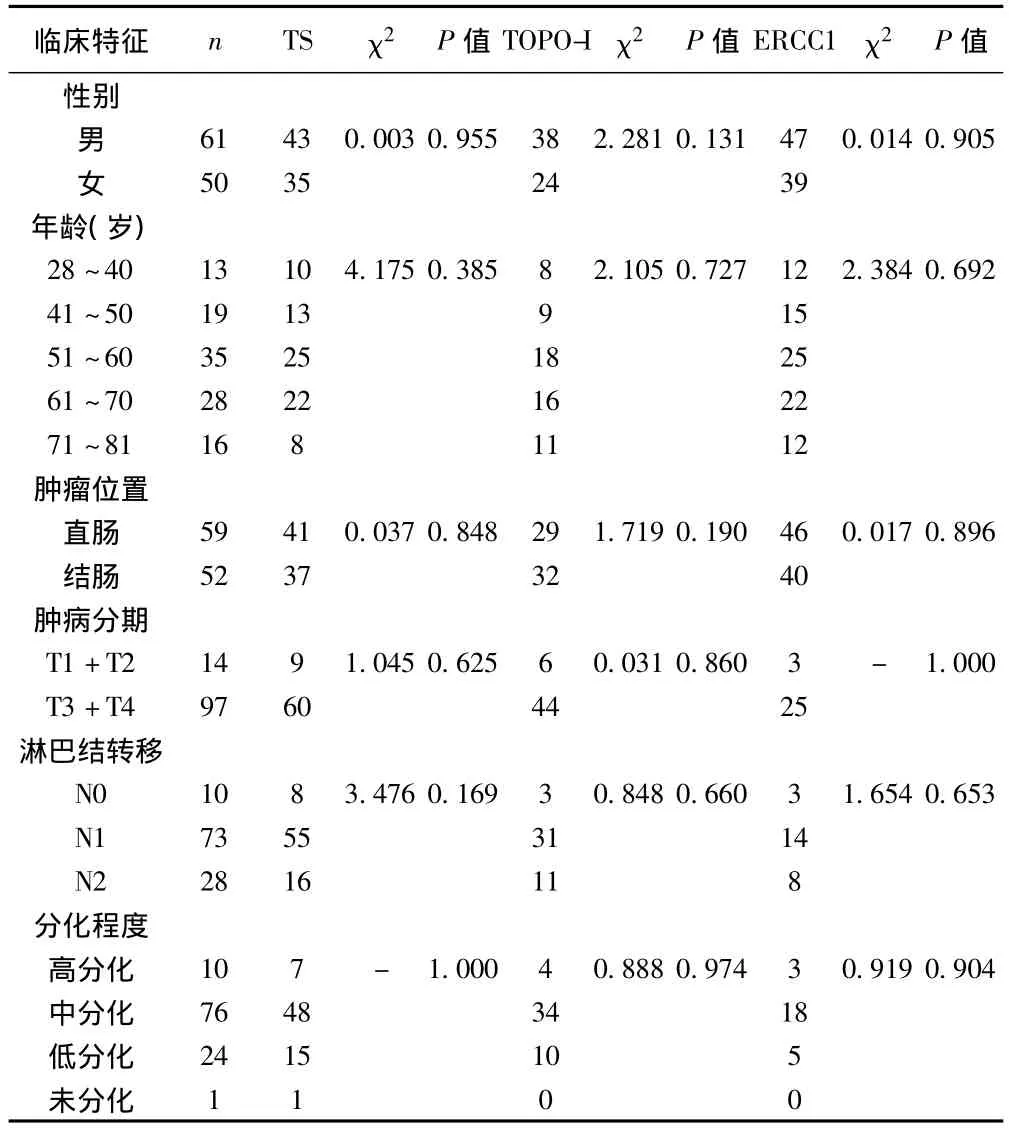
表1 TS、TOPO-I、ERCC1阳性与结直肠癌临床病理特征的关系
3 讨论
近年来肿瘤的治疗取得了相当大的进展,但在不同种族人群或个体间仍存在显著的治疗敏感性和不良反应之间的差异。这主要与肿瘤本身的生物学特性有关。目前常用抗肿瘤化疗药物的有效性不仅低于70%,而且由于缺乏化疗药物个体化治疗的遗传学分析,使20%~40%的患者甚至有可能接受了错误的药物治疗,同样病理类型、病理分期甚至分子表型相同的患者,在接受相同方案治疗后可能产生“天壤之别”的结果〔5〕。
肿瘤的个体化治疗正是为了改变这种传统的治疗模式,提高肿瘤的治疗效果而产生的。所谓肿瘤的个体化治疗〔6〕,即医生根据患者具体情况通过相关检测与分析,判断患者对哪种治疗敏感,选择合理的治疗方案,以缩短治疗时间,减轻毒副反应,延长生命,提高生活质量,达到满意的治疗效果。近年来,遗传学、基因组学、分子生物学和抗肿瘤药物作用机制等方面的研究均取得了突破性的进展,结直肠癌的个体化治疗也开始从理想走向现实。通过检测相关基因以预测抗肿瘤药物的疗效,从而为不同患者选择最合适的治疗方案,已成为提高结直肠癌治疗疗效以及减少不良反应和经济负担的必经之路。在我们的研究中,对TS、TOPO-I、ERCC1的表达情况进行检测,根据检测结果,结合美国国立综合癌症网络(NCCN)指南中国版中建议的化疗方案及医师临床经验,选择合理的化疗方案,争取达到满意的疗效。
5-氟尿嘧啶(5-Fu)作为抗代谢类抗肿瘤药物,是胃肠道肿瘤的基础用药之一。5-Fu本身并无生物学活性,在体内,须经合成代谢转化为核苷酸类似物,发挥细胞毒性作用〔7〕:主要是在胸苷磷酸化酶(TP)催化下,转化为一磷酸脱氧核糖氟尿嘧啶核苷(FdUMP),后者与TS、亚甲基四氢叶酸形成三联复合物,抑制TS活性,阻碍脱氧胸苷酸(dTMP)从头合成,继而干扰DNA复制。TS酶〔8〕是处于增殖期的细胞内必需蛋白质,它的功能是催化尿嘧啶脱氧核苷甲基化为胸腺嘧啶脱氧核苷,是DNA生物合成反应中的关键酶〔9〕,所以抑制TS就能达到抑制DNA生物合成的目的,从而抑制肿瘤细胞的生长和增殖。TS酶作为5-Fu类药物的靶向酶,多项研究已证实〔2〕,其在肿瘤中的蛋白表达及其基因多态性与5-Fu的疗效相关,肿瘤组织中TS低表达,5-Fu类药物疗效较好,患者总生存期延长;TS高表达,预示5-Fu类药物耐药〔10〕。有关研究表明〔11〕,TS 蛋白低表达与TS等位基因的低表达均提示对氟尿嘧啶类药物敏感,两者无明显的差异性。在本研究中,因患者经济的缘故,我们只检测了TS蛋白的表达,未行TS基因多态性的进一步检测。
2011 NCCN指南(中国版)结直肠癌化疗方案中提出:FOLFOX或FOLIFRI±西妥昔单抗或帕尼单抗(仅KRAS野生型),FOLFOX或FOLIFRI±贝伐珠单抗,可用于一线或二线化疗。本研究的结果提示,TS在肿瘤组织中70.3%的患者为低表达,即近77例患者对氟尿嘧啶类药物敏感。综合我们的疗效观察结果,初步可认为较传统的经验化疗疗效好,进一步的证实有待我们继续统计分析。
对于氟尿嘧啶的衍生物如替吉奥〔12〕,其主要成分替加氟经过肝脏代谢成5-Fu,进一步发挥抗肿瘤作用,在晚期不能耐受静脉用药的结直肠癌或老年性结直肠癌患者中,也取得较好的疗效。TS低表达的患者,应用替吉奥或许会取得较好的治疗效果,有待我们进一步的研究。喜树碱衍生物类化疗药物如伊立替康,是TOPO-I的抑制剂〔13〕,其活性代谢产物SN-38与TOPO-I复合物结合,阻止DNA断裂单链的再链接。TOPO-I〔14〕是细胞复制、转录、反应、修复过程中的重要酶,通过在DNA的核糖-磷酸主链上产生一过性的断裂而改变DNA的拓扑结构,解开DNA缠绕,并在另一DNA链从缺口处穿过时,再通过逆向的转酯反应恢复DNA的完整性。在肿瘤细胞中,TOPO-I含量及活性远高于正常体细胞〔15〕,抑制拓扑异构酶的活性就可能抑制肿瘤细胞的快速增殖,进而杀死肿瘤细胞。相关文献指出〔3,16〕,TOPO-I有可能作为预测伊立替康疗效的分子标记物,TOPO-I低表达的患者对伊立替康耐药,高表达者敏感。综合我们的疗效观察结果,初步可认为较传统的经验化疗疗效好,更准确的分析结果有待我们进一步随访观察。
铂类药物对肿瘤细胞的杀伤作用主要通过与细胞内亲核的DNA结合,形成铂-DNA加合物。导致DNA的链间交联或链内交联,引起DNA损伤,从而导致细胞死亡。而机体的损伤修复系统可以修复这类损伤,从而影响铂类药物的化疗敏感性〔17〕。核苷酸切除修复(NER)是人体DNA损伤修复系统的重要组成部分,铂类药物引起的DNA损伤修复主要由这个系统完成〔18〕。ERCC1在NER途径发挥重要作用,影响肿瘤细胞对铂类药物的敏感性〔19〕。多项研究表明〔4〕,在肿瘤组织 ERCC1呈低表达的患者对铂类药物敏感,高表达者耐药。
NCCN指南中推荐的FOLFOX、FOLIFRI及CapeOx方案中,均包含三代铂类药物,若奥沙利铂耐药,该三种化疗方案可能不会取得预期的临床疗效。在111例结直肠癌组织标本中,近77例患者(70%)ERCC1为低表达,提示对铂类药物敏感。如前所述,临床医生已经对50例患者采用了FOLFOX方案化疗,并对40例患者进行治疗后的疗效随访,疗效较好。
本研究中,根据卫生部结直肠癌诊疗规范(2010年版)中提出的结直肠癌化疗的适应证,111例结直肠癌患者中有89例可行辅助化疗,其中结肠癌患者有42例,直肠癌患者有47例。我院肿瘤科医生根据本研究的检测结果,结合NCCN指南中推荐的化疗方案,已经对70例患者采用不同的化疗方案,并进行化疗后的随访及观察,初步认为疗效较好,毒副反应较轻。
本研究结果表明,TS、TOPO-I、ERCC1三者在肿瘤患者中的表达情况与临床病理特征无明显相关性,是由肿瘤细胞自身的生物学特性决定的。对于TS、ERCC1低表达,TOPO-I高表达的患者采用相关敏感的化疗药物治疗后,并进行了一年左右的疗效随访,发现一部分患者化疗后的效果较传统经验的好,且毒副反应减轻。本研究将继续进行临床疗效的跟踪,其中有一部分患者的化疗疗效仍不理想。一方面,肿瘤的生长是受多基因调控的,检测某个基因或某几个基因并不能反映肿瘤的真实全貌;另一方面,临床给药剂量、途径及方法都可影响化疗药物的疗效。TS、TOPO-I、ERCC1三者联合检测对结直肠癌化疗方案的制订及药物的选择意义重大,为开展个体化治疗提供依据。要真正实现肿瘤个体化治疗,我们还有很长的路要走。
1 Jemal A,Siegel R,Ward E,et al.Cancer Statistics〔J〕.CA Cancer J Clin,2008;58(2):71-96.
2 Fvnegri N,Campanini R,Camis A,et al.Biological predictive factors in rectal cancer treated with preoperative radiotherapy or radiochemotherapy〔J〕.Br J Cancer,2008;98(1):143-47.
3 Rasheed ZA,Rubin EH.Mechanisms of resistance to topoisomerase I-targeting drugs〔J〕.Oncogene,2003;22(47):7296-304.
4 Rosell R,Cobo M,Isla D,et al.ERCC1 mRNA2 based randomized phaseⅢtrial of docetaxel(doc)doublets with cisplatin(cis)or gemcitabine(gem)in stage Ⅳ non-small-cell lung cancer patients〔J〕.J Clin Oncol,2005;23(16):621.
5 Janelsins MC,Kohli S,Mohile SG,et al.An update on cancer-and-chemotherpy-related cognitive dysfunction:current status〔J〕.Semin Oncol,2011;38(3):431-8.
6 郑传宜,覃 西,白恩琪.检验医学与肿瘤个体化治疗〔J〕.实用检验医师杂志,2011;(2):110-2.
7 Jin C,Yao L,Long J,et al.Effect of multiple-phase regional intraarterial infusion chemotherapy on patients with resectable pancreatic head adenocarcinoma〔J〕.Chin Med J,2009;122(3):284-90.
8 Ciaparrone M,Quirino M,Schinzari G,et al.Predictive role of thymidylate synthase,dihydropyrimidine dehydrogenase and thymidine phosphorylase expression in colorectal cancer patients receiving adjuvant 5-fluorouracil〔J〕.Oncology,2006;70(5):366-77.
9 钱小军,胡 冰.TS酶与5-Fu的关系及在消化道肿瘤个体化治疗中的应用〔J〕.安徽医药,2010;14(3):252-4.
10 Shahrokni A,Rajebi MR,Saif MW.Toxicity and efficacy of 5-fluorouracil and capecitabine in a patient with TYMS gene polymorphism:A challenge or a dilemma〔J〕.Clin Colorectal Cancer,2009;8(4):231-4.
11 Mauritz R,Giovannett E,Beumer IJ,et al.Polymorphisms in the enhancer region of the thymidylate synthase gene are associated with thymidylate synthase levels in normal tissues but not in malignant tissues of patients with colorectal cancer〔J〕.Clin Colorectal Cancer,2009;8(3):146-54.
12 田 姗,李 曾,王东风.替吉奥单药治疗晚期结直肠癌疗效观察〔J〕.中国老年保健医学,2011;9(5):37-38.
13 Annamaria B,Manuela P,Angela R,et al.DNA damage persistence as determinant of tumor sensitivity to the combination of topo I Inhibitors and telomere-targeting agents〔J〕.Clin Cancer Res,2011;17(8):2227-36.
14 莫晓媚,李 静,耿美玉.DNA拓扑异构酶与抗肿瘤〔J〕.中国药理学通报,2007;23(1):20-3.
15 Ataka M,Ikeguchi M,Yamamoto M,et al.Topoisomerase I protein expression and prognosis of patients with colorectal cancer〔J〕.Yonago Acta Medica,2007;50(4):81-7.
16 Paradiso A,Xu J,Mangia A,et al.Topoisomerase-I,thymidylate synthase primary tumour expression and clinical efficacy of 5-FU/CPT-11 chemotherapy in advanced colorectal cancer patients〔J〕.Int J Cancer,2004;111(2):252-8.
17 Rosell R,Lord RV,Taron M,et al.DNA repair and cisplatin resistance in non-small-cell lung cancer〔J〕.Lung Cancer,2002;38(3):217-27.
18 Su D,Ma S,Liu P,et al.Genetic polymorphisms and treatment response in advanced non-small cell lung cancer〔J〕.Lung Cancer,2007;56(2):281-8.
19 Olaussen KA,Mountzions G,Sofia JC.ERCC1 as a risk stratifier in platinum based chemotherapy for non-small cell lung cancer〔J〕.Curr Opin Pulm Med,2007;13(4):284-9.

