结直肠癌患者骨髓中survivin基因的检测及临床意义
李扬,陈明祥,胡月新
(江苏省仪征市人民医院肿瘤内科,仪征 211400)
结直肠癌(CRC)是临床常见的消化道恶性肿瘤,其发生率仅次于胃癌和食道癌。即使CRC患者病理检查结果显示淋巴结阴性,但在术后5年内,多数仍因肿瘤复发、远处转移等因素使治疗以失败告终,这可能与血液、骨髓和淋巴结中存在一般方法较难检测出的微转移灶有关[1]。作为凋亡抑制蛋白家族(IAP)的重要成员之一,生存素(survivin)特异性表达于多数人的肿瘤组织中,而在正常组织中不表达,因此可作为一种新型的肿瘤标志物[2]。本研究主要探讨了survivin mRNA在CRC骨髓中的表达及其临床意义,现报告如下。
1 资料与方法
1.1 临床资料
选择2008年1月~2010年7月本院收治的经病理组织学检查确诊的原发性CRC患者68例,所有患者手术前均未进行过放、化疗,其中男38例,女30例;年龄44~83岁,中位年龄62岁;按照2010年国际抗癌联盟(UICC)标准,Ⅰ期12例,Ⅱ期27例,Ⅲ期27例,Ⅳ期(肝转移)2例;细胞分化依据Broders分级系统。经患者知情同意和医院伦理委员会批准,术前抽取髂前上棘处约1mL的骨髓液,通过上海源聚生物科技有限公司提供的淋巴细胞分离液进行有核细胞分离,生理盐水洗涤后放入-80℃冰箱保存,待测。同时,分别收集同期10例CRC术后的组织标本与10例结直肠良性疾病患者的骨髓穿刺液作为对照。
1.2 方法
选用美国Invitrogen公司生产的Trizol一步法提取细胞及组织的总RNA,并用无RNA酶的DNase清除混杂的DNA,最后采用紫外分光光度计进行定量。具体操作如下:首先取1~2μg总RNA,在70℃条件下预变性5min后,采用日本Takara公司生产的逆转录试剂盒进行第1链cDNA的合成;其次取4μL cDNA模板进行第1轮聚合酶链反应(PCR)扩增,并选取0.5μL第1轮PCR产物进行第2轮的扩增。PCR反应体系主要包含2.5μL dNTP mixture(终浓度为250mmol/L)、2.5μL 10×PCR buffer(含 Mg2+,终浓度为1.5mmol/L)、Takara公司提供的 0.15μL Taq酶、上下游引物各2μL(20pmol)以及灭菌去离子水补足至25μL,引物序列及反应条件见表1。此外,抽取5μL的第2轮PCR扩增产物进行2%琼脂糖凝胶电泳,并通过凝胶成像系统进行拍照。
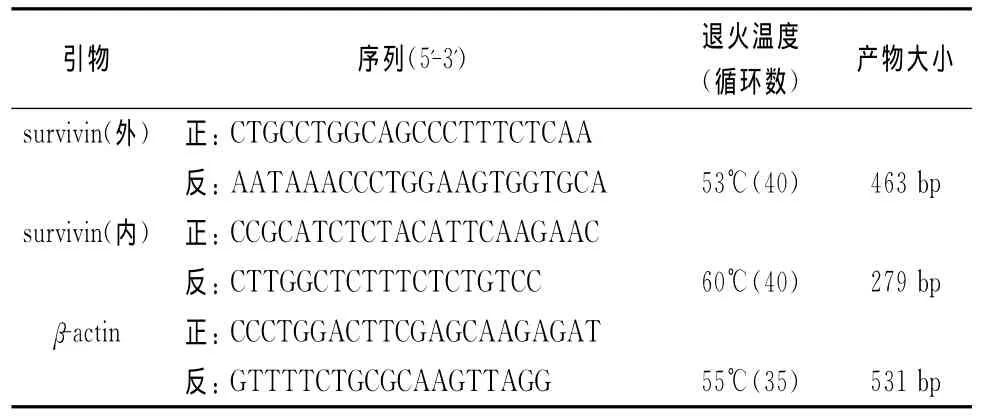
表1 巢式PCR引物序列及反应条件
1.3 统计学方法
采用SPSS 10.0统计学软件分析数据,应用Fisher确切概率法或χ2检验进行率的比较,采用Log-rank检验或Kaplan-Meier法进行生存分析,P<0.05为差异有统计学意义。
2 结果
2.1 CRC骨髓中STC-1表达
68例CRC患者骨髓中,survivin mRNA阳性者共20例。10例结直肠良性疾病患者骨髓survivin mRNA表达均为阴性,10例CRC术后组织标本的survivin mRNA表达均为阳性。典型的骨髓survivin mRNA表达见图1。
2.2 CRC患者临床病理特征与骨髓survivin表达的相关性
在CRC患者骨髓中,survivin mRNA阳性表达与临床分期(P=0.016)及淋巴结转移(P=0.010)密切相关,而与性别、年龄、肿瘤位置、肿瘤浸润深度及分化程度等无相关性(见表2)。
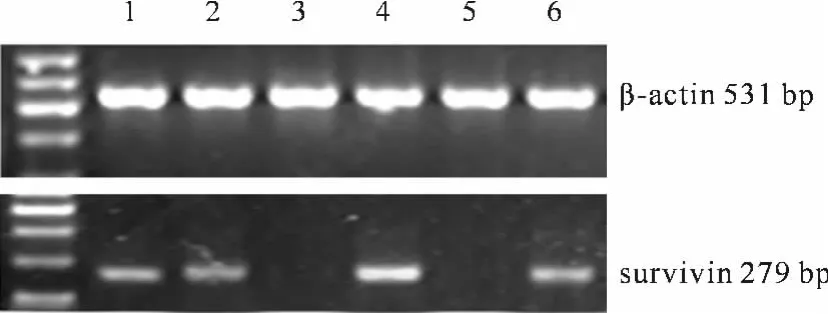
图1 CRC患者骨髓survivin mRNA表达
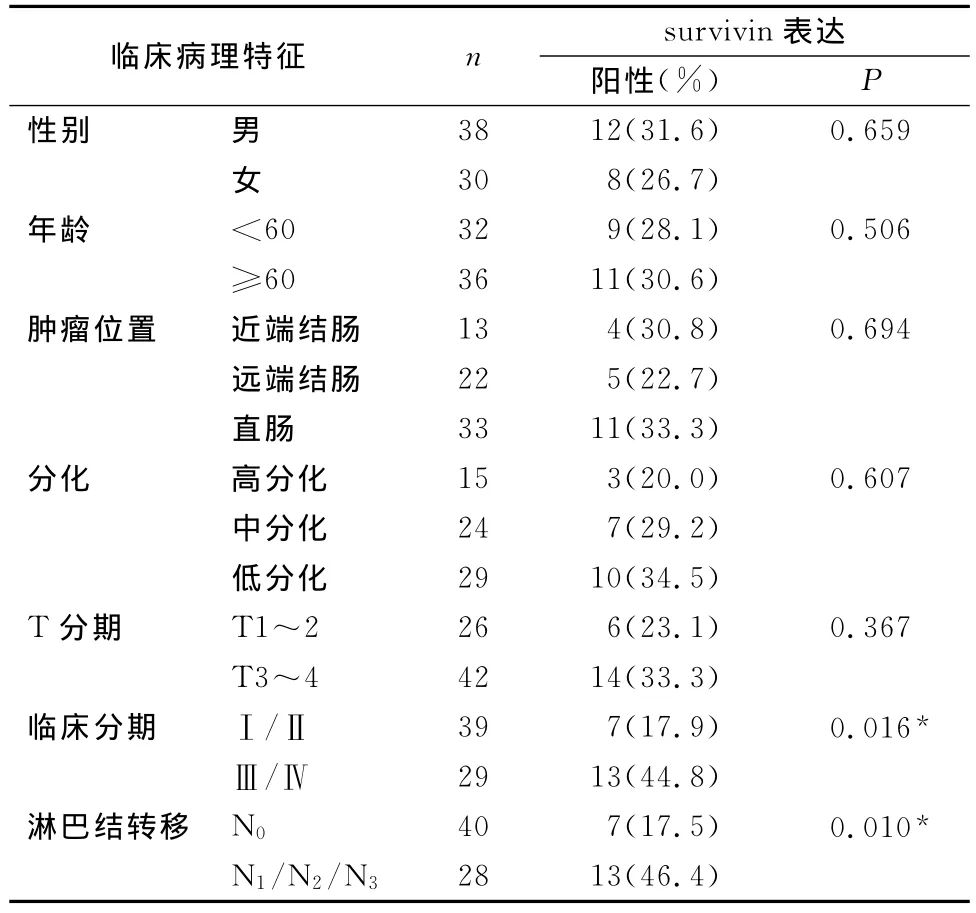
表2 CRC患者临床病理特征与骨髓survivin表达的相关性[n(%)]
2.3 骨髓survivin表达与CRC预后的关系
35例患者在术后2年内出现病情进展或复发,其中CRC骨髓中survivin表达阳性的患者平均2年无进展生存期(PFS)为18.3个月(95%CI:17.715~18.964),显著低于survivin阴性者的21.6个月(95%CI:21.227~21.789)(P<0.001)(见图2)。
3 讨论
骨髓是肿瘤细胞向靶器官转移的第二器官或中继站,通常在早期阶段肿瘤细胞便可转移至骨髓。有研究[3]表明,骨髓中存在的散播肿瘤细胞(DTCs)可能是肿瘤发生局部复发或转移的根本,因此检测骨髓中DTCs对于肿瘤诊断、分期、治疗及预后判断均具有十分重要的指导意义。人体的免疫系统可以消除多数DTCs,使其存活数量大大减少。反转录酶-聚合酶链锁反应(RT-PCR)因其具有高度敏感性,现已成为临床上用于检测微转移的有效方法[4]。

图2 骨髓survivin mRNA表达与CRC预后的关系
Survivin作为一种凋亡抑制因子,其作用最强,且主要通过抑制caspase3及caspase7来抑制细胞凋亡,其能有效维持细胞的有丝分裂,促进细胞增殖及血管形成,从而参与肿瘤的发生与发展[2]。Survivin在各种恶性肿瘤组织中的表达会增加,因此可作为肿瘤微转移的有效标记之一。近年来的研究[5]表明,在外周血、尿液、胸腹水等人体体液中,survivin的检测具有重要临床意义,并已获得广泛认可。Hernandez等[6]研究显示,在正常黏膜-结肠腺瘤-腺癌中,survivin的表达依次呈增加趋势;其在腺癌中的阳性率高达93%,且与肿瘤的分化程度呈负相关。Fang等[7]研究发现,CRC患者survivin高表达表明肿瘤肝转移及复发的风险有所增加,且患者生存期缩短。最近一项荟萃分析[8]表明,肿瘤组织中的survivin表达可以作为CRC复发及转移的一项重要判断指标。施朕善等[9]研究显示,survivin mRNA在CRC患者外周血中的阳性率为76.7%,其表达与淋巴结转移及肿瘤分期相关,且行根治手术后survivin mRNA表达明显降低;行姑息性化疗的患者中,有效组survivin mRNA表达水平较化疗前明显降低,而无效组表达升高,提示survivin mRNA检测对CRC诊断、预后及化疗疗效的预测均具有一定临床意义。本研究结果表明,CRC骨髓中survivin mRNA阳性率为29.4%,且与患者临床分期及淋巴结转移相关,进一步证实survivin mRNA可作为CRC微转移的有效标记物。
有研究[10]发现,作为一项独立的预后指标,微转移的价值甚至优于肿瘤TNM分期。截至目前为止,国内关于CRC微转移方面的研究相对较少,且多数均局限于淋巴结的微转移。因此,本研究为CRC的预后判断提供了一种新途径,对于骨髓中survivin阳性的患者,有必要采取积极的综合防治措施。
[1]Sirop S,Kanaan M,Korant A,etal.Detection and prognostic impact of micrometastasis in colorectal cancer[J].Journal of Surgical Oncology,2011,103(6):534-537.
[2]Cheung CH,Cheng L,Chang KY,etal.Investigations of survivin:the past,present and future[J].Frontiers in Bioscience:A Journal and Virtual Library,2011,16:952-961.
[3]Riethdorf S,Wikman H,Pantel K.Review:Biological relevance of disseminated tumor cells in cancer patients[J].International Journal of Cancer,2008,123(9):1991-2006.
[4]Ring AE,Zabaglo L,Ormerod MG,etal.Detection of circulating epithelial cells in the blood of patients with breast cancer:comparison of three techniques[J].British Journal of Cancer,2005,92(5):906-912.
[5]袁昕,殷旭东,薛金俊,等.食管鳞癌放疗前后外周血survivin检测的临床意义[J].南京医科大学学报:自然科学版,2012,32(2):231-235.
[6]Hernandez JM,Farma JM,Coppola D,etal.Expression of the antiapoptotic protein survivin in colon cancer[J].Clinical Colorectal Cancer,2011,10(3):188-193.
[7]Fang YJ,Lu ZH,Wang GQ,etal.Elevated expressions of MMP7,TROP2,and survivin are associated with survival,disease recurrence,and liver metastasis of colon cancer[J].International Journal of Colorectal Disease,2009,24(8):875-884.
[8]孙国贵,胡万宁,王雅棣,等.survivin蛋白在结直肠癌表达水平及与其临床关系的荟萃分析[J].中华全科医学,2012,10(9):1343-1346.
[9]施朕善,康马飞,李文见.抗survivin抗体与survivin mRNA在结直肠癌患者外周血中的表达及其临床意义[J].重庆医学,2012,41(16):1575-1578.
[10]Delides A,Maniadakis M,Stathopoulos E.Probabilities ofidentifying a micrometastasis in a cervical lymph node from laryngeal cancer:a stereometric approach[J].Anticancer Research,2013,33(8):3213-3216.

