大鼠疼痛模型研究进展*
沈立姿,房立丛,于津鹏,朱晓鹏,胡远艳,长孙东亭 综述,罗素兰审校
(海南大学热带生物资源教育部重点实验室/海南大学海口市海洋药物重点实验室,海口570228)
疼痛是实际的或潜在的组织损伤所引起的一种不愉快的感觉也是一种预警机制,防止机体遭受压迫或进一步损伤。疼痛包括机体受到伤害性刺激后的痛感觉和所做出的痛反应。按疼痛的发病机制,可分为生理性疼痛和病理性疼痛两种,而后者又可分为炎性疼痛和神经病理性疼痛。1994年,国际疼痛研究协会[1](IASP)将之定义为“一种与组织损伤或潜在的与损伤相关的不愉快的主观感觉和情感体验”。
疼痛并不是单一的感觉,它有复杂的发病机制[2-3]。虽然止痛药可以缓解不同类型的疼痛,但它的作用机制是千差万别的。因此,用单一的动物模型评价某种镇痛药药效是不完善的。炎症性痛是由于局部炎症病灶内钾离子、氢离子的积聚和炎症介质的刺激引起的。神经源性疼痛是由于疾病或外周、中枢神经损伤引起的疼痛综合征,是外周和中枢敏感化的结果。并且是临床上常见的疼痛,其发病机制比较复杂,治疗效果不尽理想。有报道统计美国约有1%的人患神经性疼痛,在当今世界这是一个相当可观的数字,已引起科学家的注意。动物模型被广泛地用于模仿各种疾病,并且用于研究各种临床疾病的发病机制。尽管不同的动物模型都有其局限性,但如同临床上疼痛的症状不完全相同,动物模型亦各有其特点,发生机制也不完全相同。本文将从物理刺激,化学刺激,神经疼痛3个方面为大家介绍几种大鼠疼痛模型及其研究进展。
1 物理刺激法
物理刺激主要是指机械、热、电等外界刺激引起机体产生一系列的反应。痛觉过敏是指皮肤对机械刺激产生过度敏感的现象,也是神经损伤后的一个特征重复性的伤害刺激可以导致持续性的疼痛,因此在实验过程中可以通过测量疼痛的阈值来间接量化疼痛的程度,使疼痛程度变成一个直观的数值。
1.1 大鼠机械痛觉测试 将实验大鼠放置在有机玻璃观察格中,观察格则放在顶部有网眼的金属架上,以方便von Frey测试。从而测定大鼠机械性缩足反射阈值(MWT)[4]。大鼠适应环境半小时,待大鼠不再四处张望、探究,较安静后,实验者用von Frey测试探针缓慢地轻柔地刺激大鼠待测后肢足底中部,使探针弯曲,持续几秒钟观察大鼠的缩足反应,大鼠若由于刺激而出现快速的缩足反应,则标记为阳性反应,若由于身体活动引起大鼠的缩足反应则不算在内。反复测量找到出现50%阳性反应时的压力值,这个值就是该只大鼠的MWT。Harry等[5]利用此方法确定了α-芋螺毒素可以明显增高神经结扎模型大鼠的机械痛阈值。α-芋螺毒素能选择性抑制N型Ga2+通道从而减轻特异性疼痛有望被开发成治疗慢性疼痛的药物。
1.2 大鼠热痛觉测试 大鼠适应性喂养,室内环境保持在25℃左右,将热板仪的温度设置在保持54℃左右。大鼠被放置在有密闭可拆卸的透明有机玻璃缸内的热板仪上记录其出现舔后足或跳跃反应的时间。Casarrubea等[6]确定此模型可用于镇痛药物的筛选也可用于增强学习能力,记忆能力等药物的研究。笔者实验室曾应用此模型筛选出一些有镇痛活性的芋螺毒素。
1.3 大鼠切口疼痛模型的建立 取清洁级SD大鼠麻醉,碘伏消毒大鼠一侧后足,用手术刀在大鼠足底做一长约5mm的纵向切口,用镊子夹起足底肌肉,并在切口左右纵向切割,动作轻柔保证其起止附着点的完整,用丝线缝合皮肤,并给予青霉素粉针,造模成功[7]。本模型制作简单,伤害直观,为术后镇痛药物的研究和开发提供了条件。Grzegorz等[8]通过实验确定μO-芋螺毒素可以提高切口疼痛模型大鼠的机械痛阈值,并且不会阻碍伤口的愈合。Sylvia等[9]确定脊髓部位的γ氨基丁酸(GABA)可以调节本模型大鼠痛觉过敏。笔者对上述3种物理刺激模型简单的进行了比较,见表1。
2 化学刺激法
许多刺激性化学物质接触皮肤黏膜或注入体内,均能引起炎性疼痛反应,可用作疼痛模型的制作,可用以研究疼痛生理及筛选镇痛药物。
2.1 大鼠足底炎性疼痛模型的建立 实验环境25℃,将大鼠放置在特制鼠笼里,大鼠右后足可伸出鼠笼,实验者左手固定大鼠右后足。用1mL注射器抽取100μL的5%甲醛溶液注射到大鼠有后足足底皮下,制作甲醛疼痛模型。王静捷等[10]酵母聚糖制作本模型,发现Zymosan表现出比Formalin更稳定的,可靠地热痛觉过敏和机械痛觉过敏,并有明显的水肿。Seungkyu等[11]通过实验确定ω-芋螺毒素FVIA作用于N型Ca2+通道,可以减少甲醛诱发的伤害性行为的累计时间,并且对与炎性疼痛和中枢致敏密切相关的第二时相更为有效。Yan等[12]也是利用本模型通过鞘内给药的方法确定ω-芋螺毒素SO-3也具有镇痛作用,并且有剂量效应。
甲醛诱导的炎性痛可表现为两个时相,第一时相为皮下注射甲醛后立即表现出的疼痛行为,是由甲醛直接刺激神经末梢所引起;第二时相为皮下注射甲醛约20min后发生的疼痛行为,是由于局部慢性炎症导致的伤害性信息持续传入引起的。大鼠在两个时相所表现出的痛反应是频繁的舔注射足。两个时相之间有一个10~15min的相对稳定期,这一时间内实验大鼠很少表现伤害性反应行为,较为安静。
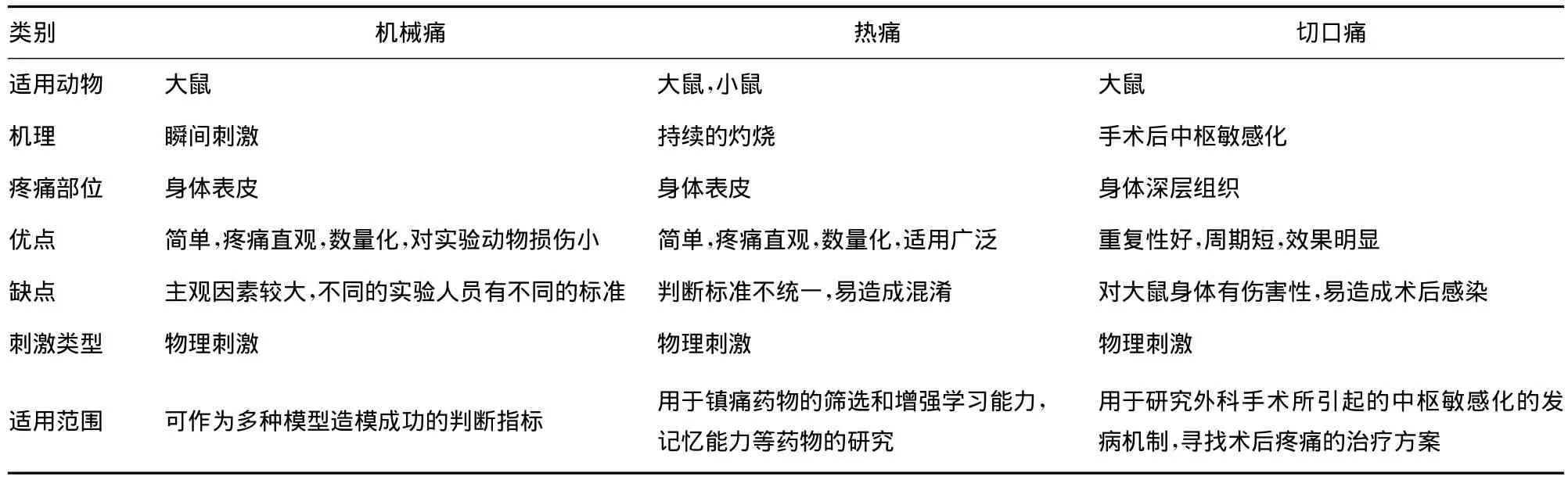
表1 物理刺激模型特点简明比较
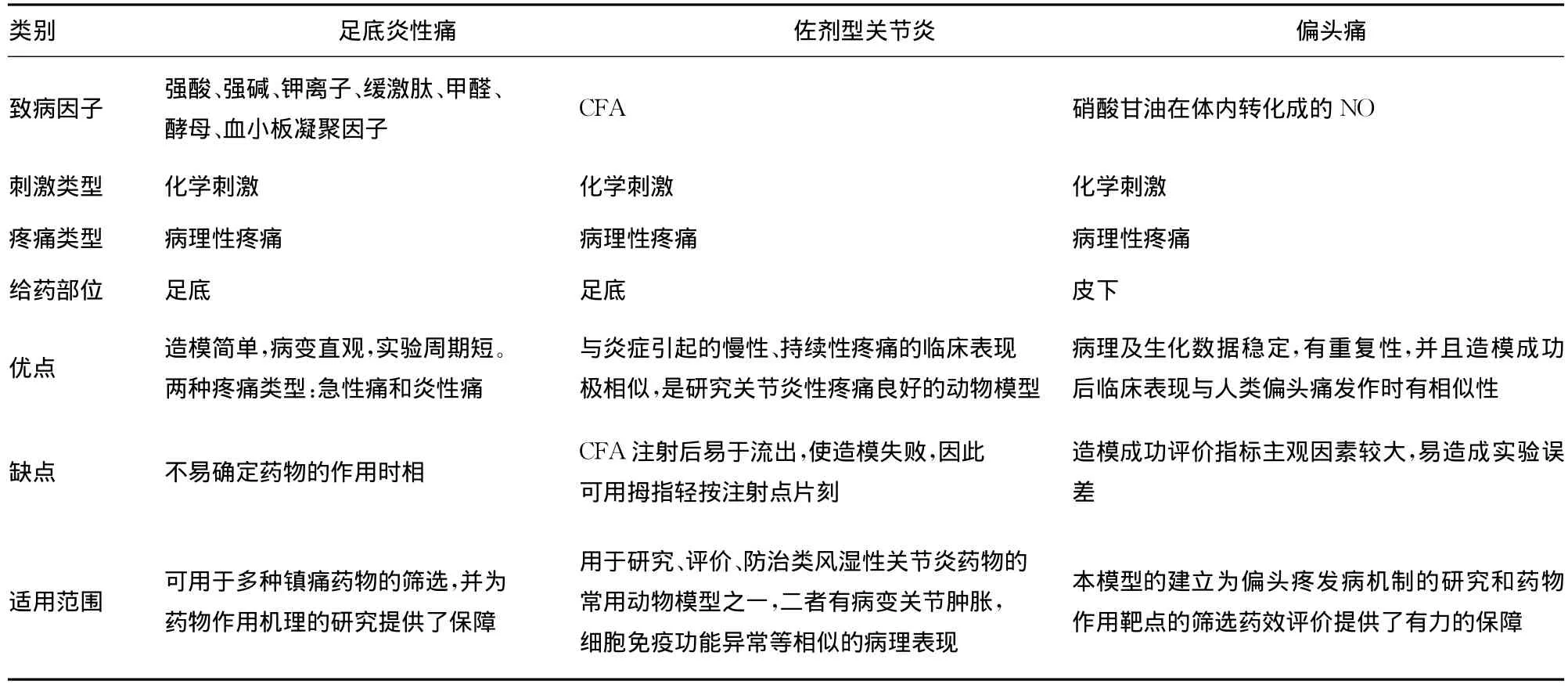
表2 化学刺激模型特点简明比较
2.2 大鼠关节炎模型的建立 大鼠以40mg/kg水合氯醛麻醉,将0.1mL的完全弗氏佐剂(CFA)注射到大鼠后足跖皮下,约4h后可出现原发性病变,注射点附近出现红肿。此现象可持续5d而7d后大鼠四肢的关节和脚掌部位会出现肿胀等继发性病变。陆继娣等通过实验确定中药熏蒸可以降低本模型大鼠血液和关节中的致炎因子白细胞介素的含量,并且存在剂量效应。Ekberg等[13]确定出μΟ-型芋螺毒素 MrVIB选择性阻断感觉神经元的Nav 1.8通道,对不引起运动障碍的慢性疼痛有效,同时也可以提高本模型大鼠的痛阈值。Toru等[14]利用Zymosan成功制作了大鼠关节炎疼痛模型,并确定在关节腔内注射骨形成蛋白7(BMP-7),通过提高BMP-7的水平和减少白细胞介素1β(IL-1β)的水平,从而对炎症性关节炎模型的软骨退变起到保护作用。
2.3 偏头痛大鼠模型的建立 取SD大鼠硝酸甘油注射剂,注射剂量按照15mg/kg进行皮下注射,实验大鼠2只耳朵红肿,且不停的左右甩头,用前肢抓挠头部毛发,烦躁,来回走动,用头部轻顶鼠笼,此现象持续2~3h后,大鼠安静的趴窝在鼠笼中,活动明显减少,模型制作成功。赵永烈等[15]通过本模型从组织学上确定芎芷地龙汤可以减少由硝酸甘油诱导的c-fos的表达,增加五羟色胺的表达,减少三叉神经脊束核神经细胞的兴奋性,激活五羟色胺下行镇痛系统,并且可持续较长时间,增高痛阈,阻止痛觉信息的传递,从而起到镇痛作用。彭成等人检测出在本模型大鼠的脑组织c-fos和c-jun基因表达异常。笔者对上述3种化学刺激模型简单的进行了比较,见表2。
3 神经病理性痛模型
神经源性疼痛是由于疾病或外周、中枢神经损伤引起的疼痛综合征,是外周和中枢敏感化的结果,其中脊髓敏感化起着十分重要的作用。机体的中枢或外周神经组织损伤后神经系统的结构和功能发生病理性改变,从而引起痛觉异常和痛觉过敏。
3.1 大鼠坐骨神经分支选择性损伤型神经病理痛模型(SNI)的建立 实验室温度保持在25℃,实验大鼠采用腹腔给药的方式进行麻醉,大鼠俯卧置于手术台上,右后腿剪毛,消毒,用手术剪剪开腿部皮肤[16],逐层分离皮下脂肪、浅筋膜,双手执眼科镊钝性分离股二头肌,使坐骨神经主干暴露在视野内,结扎并剪断其分支胫神经、腓总神经,保留并避免损伤腓肠神经,逐层缝合肌肉和皮肤,并在缝合前和缝合后在伤口处涂抹青霉素粉针剂,以防止手术后的感染。姜艳华等[17]利用本模型确定米诺环素可通过减少标记小胶质细胞(OX-42)的表达进一步抑制脊髓小胶质细胞的激活,最终达到减轻痛觉超敏和痛觉过敏的现象,并确定米诺环素具有剂量效应。Metz等[18]研究发现SNI模型大鼠的神经元树突比假手术大鼠的树突更长,分支也更多。
3.2 大鼠坐骨神经慢性挤压伤病理性痛模型(CCI)的建立实验室温度保持在25℃,实验大鼠采用腹腔给药的方式进行麻醉,大鼠俯卧置于手术台上,右后腿剪毛,消毒,用手术剪剪开腿部皮肤,逐层分离皮下脂肪、浅筋膜,双手执眼科镊钝性分离股二头肌,使坐骨神经主干暴露在视野内,用镊子将坐骨神经主干轻轻剥离,在坐骨神经干上每间隔约1mm用3-0铬制羊肠线做4个结扎,在结扎时保持力度一致,结扎强度以不完全阻断血管为宜,结扎时可见肢体轻微抽动。逐层缝合肌肉和皮肤,并在缝合前和缝合后在伤口处涂抹青霉素粉针剂,以防止手术后的感染。在本模型的发展过程中,也有人用不同材料如羊肠线、丝线、PE套管等对大鼠坐骨神经进行挤压,最终确定羊肠线和丝线经生理盐水浸泡后使用效果稳定,并且羊肠线更适用于此模型的制备[19]。Narmatha等[20]通过不同的给药部位确定α-芋螺毒素Vc 1.1可以提高大鼠的痛阈值。并且通过不同的给药部位(手术侧后肢,对侧后肢)确定其对大鼠的受损神经有修复作用。Richard等[21]认为用未成年大鼠制作CCI模型机械痛更易诱发炎性痛,并与人类新生儿神经损伤后的临床表现一致,保障研究人员进一步探索神经痛的发病机制和治疗方法。Joseph等[22]研究表明,ZZ-204G是一种作用于a9a10受体的小分子拮抗剂,是一种新型结构的镇痛剂。在治疗慢性炎症和神经性疼痛方面有潜在的应用前景。笔者实验室就采用此模型对芋螺毒素的镇痛活性进行筛选,先建立大鼠的CCI模型,喂养1周后对合格大鼠做鞘内置管作为中枢给药的给药途径。

表3 神经病理性疼痛模型特点比较
3.3 大鼠脊神经结扎模型的(SNL)建立 实验人员将大鼠麻醉,让其俯卧在手术台上,大鼠背部褪毛消毒,将腰部位置垫高,左手用镊子拉起大鼠L5-L6脊椎间的皮肤,右手用手术剪将其剪开,作一皮肤纵切口,钝性分离皮下的肌肉,使L5-L6关节突暴露在手术视野内,无菌条件下切除关节突,轻轻地分离L5-L6脊神经,用丝线结扎L6的背根神经节,逐层缝合肌肉和皮肤,并在缝合前和缝合后在伤口处涂抹青霉素粉针剂,以防止手术后的感染。Aldric等[23]通过实验确定芋螺毒素MVⅡA和con-G可以明显提高脊神经结扎模型大鼠的痛阈值,con-G降低周围神经痛的效果要强于甲醛模型的疼痛。
3.4 大鼠骨癌疼痛模型的建立 Medhurst等[24]将乳腺肿瘤细胞在培养基上扩大培养,用胰蛋白酶溶液降解,离心,用平衡盐溶液洗涤沉淀,在离心洗涤2次,最后肿瘤细胞会悬浮于盐溶液中,备用。大鼠麻醉后,在胫骨上段开一小口,先在胫骨干骺端穿刺打孔,再注入肿瘤细胞混悬液,用医用骨蜡封堵针孔,建立大鼠胫骨骨癌模型。有些研究者曾用前列腺肿瘤细胞成功制作大鼠骨癌疼痛模型,并确定肿瘤可以激活脊髓神经胶质细胞释放IL-1β和其他物质使痛觉过敏[25]。Anton等[26]确定作用于N-型电压敏感性钙离子通道的ω-芋螺毒素来考诺太与吗啡合用对骨癌疼痛模型大鼠有协同镇痛作用。Wala等[27]的研究表明,ZZ1-61c是作用于a9a10胆碱受体,有独特拮抗作用的新型化合物,对预防和减弱化疗导致的神经性疼痛有潜在的研究价值,因此它为避免胆碱受体激动剂的毒性提供了有效的治疗方法。笔者对上述4种神经病理性痛模型简单的进行了比较,见表3。
4 讨 论
疼痛是机体受到损害后一种保护性反应,也是某些疾病的一种症状,可使人感到痛苦。某些长期剧烈的疼痛对机体已成为一种难以忍受的折磨,使人们生活质量下降,对工作生活不利,这引起了科研人员的广泛关注。镇痛药物的研究是目前医学中最活跃的领域之一,由于疼痛的发病机制不同,因此各种疼痛模型的制备显得尤为重要。目前,笔者实验室正在选用上述模型,对被誉为“海洋药物宝库”的海南产芋螺毒素进行镇痛活性筛选,和药效评价,已筛选到镇痛作用强大、作用靶点清楚、无成瘾性的新型芋螺毒素先导药物,为下一步原创新型镇痛药物的研发奠定了坚实的基础。
[1] Luis R,Harald B,Helge R,et al.Chronic pain and sensory changes after augmentation mammoplasty:long term effects of preincisional administration of methylprednisolone[J].Pain,2006,124(1/2):92-99.
[2] Ji RR,Kohno T,Moore KA,et al.Central sensitization and LTP:do pain and memory share similar mechanism[J].Trends Neurosci,2003,26(12):696-705.
[3] Herrero JF,Laird JM,Lopez-Garcia JA.Wind-up of spinal cord neurones and pain sensation:much ado about something[J].Prog Neurobiol,2000,61(2):169-203.
[4] Chaplan SR,Bach FW,Pogrel M,et al.Quantitative assessment of tactile allodynia in the rat paw[J].Neurosci Meth,1994,53(1):55-63.
[5] Harry K,Adams DJ,Callaghan B,et al.A novel mechanism of inhibition of high-voltage activated calcium channels by a-conotoxins contributes to relief of nerve injuryinduced neuropathic pain[J].Pain,2011,152(2):259-266.
[6] Casarrubea M,Sorbera F,Santangelo A,et al.Learning influence on the behavioral structure of rat response to pain in hot-plate[J].Behav Brain Res,2011,225(1):177-183.
[7] Souza AH,Lima MC,Drewes CC,et al.Antiallodynic effect and side effects of Pha1b,a neurotoxin from the spider Phoneutria nigriventer:comparison with u-conotoxin MVIIA and morphine[J].Toxicon,2011,58(8):626-633.
[8] Grzegorz B,Zhang MM,Brad RG,et al.SyntheticμOConotoxin MrVIB Blocks TTX-Resistant Sodium Channel NaV1.8and Has a Long-Lasting Analgesic Activity[J].Biochemistry,2006,45(23):7404-7414.
[9] Sylvia R,Mirjam A,Peter KZ,et al.Peripheral and spinal GABAergic regulation of incisional pain in rats[J].Pain,2011,153(1):129-141.
[10]王静捷,陈雯,黄宇光,等.Zymosan足底炎性疼痛大鼠模型的建立及其脊髓背角COX-2表达水平变化[J].北京医学,2010,32(8):644-647.
[11]Seungkyu L,Yoonji K,Seung KB,et al.Analgesic effect of highly reversibleω-conotoxin FVIA on N type Ca2+channels[J].Mol Pain,2010,97(6):1-12.
[12]Yan LD,Liu YL,Zhang L,et al.Spinal antinociception of synthetic omega-conotoxin SO-3,a selective N-type neuronal voltage-sensitive calcium channel blocker,and its effects on morphine analgesia in chemical stimulus tests in rodent[J].Eur J Pharmacol,2010,636(1/3):73-81.
[13]Ekberg J,Jayamanne A,Vaughan CW,et al.μO-conotoxin MrVIB selectively blocks Nav1.8sensory neuron specific sodium channels and chronic pain behavior without motor deficits[J].PNAS,2006,103(7):17030-17035.
[14]Toru T,Takeshi M,Kunikazu T,et al.BMP-7inhibits cartilage degeneration through suppression of inflammation in rat zymosan-induced arthritis[J].Cell Tissue Res,2011,344(2):321-332.
[15]赵永烈,王玉来,高颖,等.芎芷地龙汤对偏头痛模型大鼠脑组织痛觉传导通路c-fos和5-HT蛋白表达的影响[J].中医杂志,2011,52(10):868-870.
[16]Decosterd I,Woolf CJ.Spared nerve injury:an animal model of persistent peripheral neuropathic pain[J].Pain,2000,87(2):149-158.
[17]姜艳华,王秋石,马虹.脊髓小胶质细胞激活对SNI模型大鼠神经病理性疼痛的影响[J].中国医科大学学报,2008,37(5):589-592.
[18]Metz AE,Yau HJ,Centeno MV,et al.Morphological and functional reorganization of rat medial prefrontal cortex in neuropathic pain[J].PNAS,2009,106(7):2423-2428.
[19]马骋,李翠贤,易建良,等.不同材料制备大鼠神经病理性疼痛CCI模型的比较[J].中国药理学通报,2008,24(4):555-557.
[20]Narmatha S,Bruce L,Ken G,et al.Alpha-conotoxin Vc1.1alleviates neuropathic pain and accelerates functional recovery of injured neurones[J].Brain Res,2005,1059(2):149-158.
[21]Richard FH,Suellen MW,Mota PM.The ontogeny of neuropathic pain:Postnatal onset of mechanical allodynia in rat spared nerve injury(SNI)and chronic constriction injury(CCI)models[J].Pain,2005,115(3):382-389.
[22]Joseph RH,Linda PD,Cheryl D,et al.The novel small moleculeα9α10nicotinic acetylcholine receptor antagonist ZZ-204Gis analgesic[J].Eur J Pharmacol,2011,670(2/3):500-508.
[23]Aldric H,Jacqueline S.Antinociceptive effects of the marine snail peptides conantokin-G and conotoxin MVIIA alone and in combination in rat models of pain[J].Neuropharmacology,2009,56(2):556-563.
[24]Medhurst SJ,Walker K,Bowes M,et al.A rat model of bone cancer pain[J].Pain,2002,96(122):129-140.
[25]Zhang RX,Liu B,Wang L,et al.Spinalglial activationin a new rat mod el of bone cancer pain produced by prostate cancer cell inoculation ofthe tibia[J].Pain,2005,118(1/2):125-136.
[26]Anton K,Lucia A,Elizabeth DW,et al.Intravenous injection of leconotide,an omega conotoxin:synergistic antihyperalgesic effects with morphine in a rat model of bone cancer pain[J].Pain Med,2011,12(6):923-941.
[27]Wala EP,Crooks PA,McIntosh JM.Novel small molecule α9α10nicotinic receptor antagonist prevents and reverses chemotherapy-evoked neuropathic pain in rats[J].Anesth Analg,2012,5(18):1.

