柞蚕丝素蛋白-羟基磷灰石-BMSCs组织工程化骨修复老龄动物骨缺损
张继波 杨依勇 孔令菊 裴 丹 姚素艳 郑德宇 (辽宁医学院解剖学教研室,辽宁 锦州 00)
现代骨修复技术主要有自体骨移植、异体(同种或异种)骨移植和人工骨材料移植。作为治疗骨缺损金标准的自体骨移植和标准方法的同种异体骨移植〔1~6〕,因其缺点如自体骨移植的骨来源有限、量不足、副损伤大、供区感染等,异体骨移植可传播疾病、免疫排斥反应、伦理等问题,导致两种骨移植方法受到限制。人工骨对于修复骨缺损的价值逐渐显现,但良好的人工骨材料应满足以下特点:①无毒;②具有一定的机械强度;③良好的生物相容性;④生物降解性和降解速率与骨修复速率匹配等。单一的材料不足以满足上述要求,故研制复合型生物活性支架材料是21世纪人工骨研究面临的挑战〔7〕。本实验将柞蚕丝素蛋白-羟基磷灰石(TSF-HA)与兔骨髓间充质干细胞(BMSCs)复合构建新的组织工程骨,用于修复老龄兔桡骨缺损,探讨此种新型植骨材料的骨缺损修复作用,希望为临床治疗骨缺损提供一种新的人工骨材料。
1 材料与方法
1.1 材料
1.1.1 主要试剂 成骨诱导剂:β-甘油磷酸钠(美国Sigma公司)、地塞米松(美国Sigma公司)、L-抗坏血酸(美国Sigma公司)。条件培养液:DMEM培养液中加入成骨诱导剂,构成条件培养液。
1.1.2 实验材料及实验动物 将TSF-HA复合材料制成1.5 cm×0.3 cm×0.3 cm长方体,与兔桡骨的粗细形状相近似,包装后经60Co消毒备用,该材料由辽宁医学院解剖教研室郑德宇和杨依勇提供。TSF-HA参数为:空隙率66%,平均孔径80 μm,表观密度0.76 g/cm3,压缩强度10.1 MPa。新西兰大耳白兔,12月龄,体质量1 800~2 000 g,雌雄不限(由辽宁医学院实验动物中心提供)。
1.2 试验方法
1.2.1 BMSCs的分离、培养及其成骨诱导 取出生24 h的乳兔,断颈处死,将其浸泡入75%酒精中20 min,无菌分离四肢骨,放入含双抗(青霉素200 U/ml、链霉素200 mg/ml)的 PBS缓冲液内,冲洗2次。更换培养皿,快速清除骨膜等结缔组织,剪去两端骨骺,注射器吸取完全培养基(DMEM,10%FBS,青霉素100 U/ml,链霉素100 mg/ml)冲洗骨髓腔。将冲洗液离心(1 000 r/min,10 min),弃上清液,吹打管反复吹打底部细胞。加入完全培养液,按1×106/ml的密度接种于25 ml培养瓶中,置于37℃,50 ml/L CO2饱和湿度条件下的培养箱进行培养。48 h后换液,以后每隔2~3 d换液1次。待细胞达80% ~90%融合后,0.25%胰酶消化,1∶3传代分瓶培养,记为P1。细胞生长再次铺满瓶底汇合时消化传代,记为P2。取P2代BMSCs,加入条件DMEM培养液,每隔3 d换液,进行成骨方向的定向诱导培养。待培养皿内单层细胞生长近汇合时消化传代,记为P3。继续使用条件培养液培养,用于后续实验。
1.2.2 材料与细胞共培养 无菌条件下将已灭菌的TSF-HA复合支架材料置入装有条件培养液培养皿中浸泡24 h预湿,紫外线照射下自然晾干。将经过条件培养液诱导后生长良好的第3代BMSCs消化、离心,以5×107/ml密度均匀滴加在预湿的支架材料上,接种后静置于37℃、体积百分比为5%CO2和100%湿度孵箱中培养4~6 h;然后加入条件培养液完全覆盖复合物,继续培养3~5 d备用。
1.2.3 实验动物分组及兔桡骨缺损模型的建立 新西兰老龄大耳白兔共54只(随机分3组:A、B、C组各18只)适应性饲养7 d后,予质量百分比为10%的水合氯醛耳缘静脉+腹腔各半量麻醉生效后,无菌操作下,于左前臂内侧中上段纵行约3 cm直切口,切开皮肤、皮下组织及深筋膜,沿肌间隙进入,充分暴露桡骨中下段,用牙科钻将长15 mm桡骨连同骨膜一并截除,造成节段性骨缺损。A组植入TSF-HA+BMSCs复合物,B组单纯植入TSF/HA,C组骨缺损区不植入任何材料。缝合皮下组织及皮肤,再次安尔碘消毒切口,患肢不行内外固定。术前肌肉注射青霉素20万 U/d,术后再次肌肉注射青霉素20万U/d,连续3 d,常规喂养。
1.2.4 观察指标 (1)观察术后老龄日本大耳白兔活动、进食、伤口愈合情况。(2)分别于术后8、12 w,每次随机选取6只兔麻醉后摄前肢正位X线片,观察各组桡骨缺损的骨修复程度;然后在麻醉状态下注入空气处死,取标本行肉眼观察及HE染色组织学观察骨缺损的修复水平。
2 结果
2.1 细胞培养及TSF-HA-BMSCs复合物的构建 原代培养的BMSCs呈长梭形或多角形,经成骨诱导后大约85%的细胞ALP染色呈阳性,说明细胞具有了骨系细胞的特点。诱导后的BMSCs与材料复合培养3 d后,可见细胞在材料表面生长状态良好,伸出伪足,并与材料紧密相贴。说明构建出了TSF-HA-BMSCs复合植骨材料(图1)。

图1 TSF/HA/BMSCs材料的构建
2.2 实验动物观察 术后动物体温、饮食正常,外界环境刺激敏感,切口无红肿、渗液等炎性反应。
2.3 影像学检查 4 w时复合支架组骨折端与支架开始交错,支架边缘隐约可见少量骨痂;单纯材料组清晰可见骨折端与支架间隙,未见明显骨痂形成。8 w时复合支架组骨折端与支架连接,支架降解,被大量骨痂覆盖;单纯支架组骨折端与支架间隙模糊,支架周围可见骨痂。12 w时复合材料组支架已基本被骨痂取代,骨密度较高,骨髓腔形成;单纯支架组可见部分支架,并与骨折端结合紧密,骨密度也增高;空白组骨折缺损处见有瘢痕愈合,由周围软组织填充,未见明显新生骨,趋向骨不连(图2)。
由图中可见8 w时实验组支架与骨折处紧密相连出现大量骨痂围绕支架;对照组支架与骨痂虽相连,但仍有一定的间隙。12 w时实验组支架大部分被吸收,骨密度增高,骨修复良好;对照组骨痂增多,但仍可见部分支架;空白组骨缺损几乎没有骨修复现象,被周围结缔组织填充。
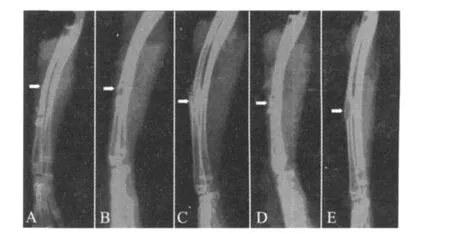
图2 实验动物的X线摄片
2.4 大体观察 各组植入的支架材料在骨创区无移位,材料的周围组织未见变性、坏死、化脓、积液等不良迹象。(1)8 w时,实验组出现骨质较薄的骨痂样硬组织,标本表面较为光滑,渐变暗红色,表面见少量支架;对照组材料周围颜色有变红趋势,支架开始降解。(2)12 w时,实验组骨创区呈现乳白色,可见血管,新生出皮质骨与骨折端皮质连续,骨修复完成;对照组仍有部分支架露出骨外,与骨痂相连,骨修复部分完成;空白对照组骨缺损区被周围结缔组织覆盖,未见明显骨痂。
2.5 组织学检查 4 w时镜下见A组有大量成纤维骨痂及少量成骨细胞,材料开始被降解;B组骨创区有少量纤维骨痂形成。8 w时A组出现大量较成熟的骨组织结构,周边可见成骨细胞,类似骨单位结构;B组支架开始降解,缺损区见大量纤维组织增生,边缘少量成骨细胞。12 w时,A组新生骨改建完成,材料周围见大量成熟的新生骨组织;B组出现新生骨组织,缺损区仍有部分纤维组织;C组缺损区见大量致密结缔组织(图3)。12 w时实验组支架几乎完全被降解,周围出现大量骨组织,对照组新生成骨细胞较实验组少,空白组见大量纤维结缔组织。
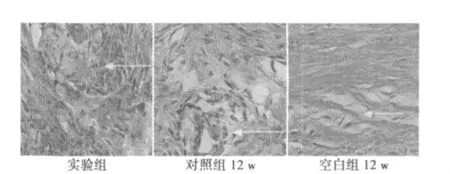
图3 12 w时各组组织学变化(HE染色,×400)
3 讨论
我国上世纪80年代四川大学和武汉工业大学等根据人体骨无机成分的主要成分羟基磷灰石(HA),先后研制出了HA支架材料,作为人体硬组织修复和替代组织工程材料,并很快应用于临床。但因HA质脆、吸收性差、不易降解等导致临床使用受到限制〔8〕。丝素蛋白是从天然蚕丝中提取出的天然纤维蛋白,具有独特机械特性和生物相容性,类似骨组织中的胶原,具有胶原的一些特性,但SF膜在体内引起的炎症反应要小于胶原蛋白膜〔9〕。通过RGD多肽表面修饰的丝素蛋白支架材料,能明显促进BMSCs在支架材料上黏附和铺展,但对细胞增殖作用不明显〔10〕。柞蚕丝蛋白不但具有家蚕丝素蛋白的特性,而且还含有大量的 Arg-Gly-Asp(精氨酸-乙氨酸-天门冬氨酸,RGD)三肽序列。RGD序列作为细胞膜整合素受体与细胞外配体相结合的识别位点,介导细胞与细胞外基质及细胞之间的相互作用,能够促进支架对细胞的黏附和伸展,利用细胞间信息传递。将羟基磷灰石多孔支架材料浸泡在柞蚕丝素蛋白的水溶液中,采取冷冻干燥制备的方法,进行羟基磷灰石支架表面修饰,制备的TSF-HA复合多孔支架材料达到优势互补的作用,并且材料价格低廉,制备工艺简单。
研究结果显示,TSF-HA复合支架材料构建的组织工程化骨有很好的成骨作用,与宿主骨直接键合〔11〕。放射学和组织学评分结果显示,15 mm的骨缺损在12 w左右能完全被TSFHA组织工程骨所替代和修复,骨皮质桥连接和髓腔相通,支架材料降解完毕。这表明BMSCs被支架载入体内后,细胞能在支架上继续生长、繁殖、分化,并发挥了成骨活性,说明TSF-HA无毒、具有良好的组织相容性和成骨作用,能作为治疗骨缺损的骨组织工程支架材料。
组织工程支架材料的吸水率及降解性吸水率是评价支架材料化学性质和自身结构的一个综合指标。它既反映了支架的有效孔隙率,又反映了支架本身的亲疏水性及降解性。羟基磷灰石的降解吸收分主动和被动两种方式。被动吸收主要是指支架的孔径、孔隙率,其孔隙率越大,吸水性也越大,降解速率也越快〔12〕;主动吸收则与成骨细胞活性有关。文献报道,最有利于成骨细胞渗入到内部的孔径要大于40 μm,孔隙率达到70%;当孔径在150 μm,孔隙率大于30%能为骨组织长入提供理想的场所〔13〕。笔者制作的TSF-HA支架,无论是孔径大小,还是孔隙率与HA支架都相差无几,基本符合以上标准。虽然两种材料孔隙率、孔径大小基本相同,但TSF-HA支架孔隙壁上吸附大量丝素蛋白颗粒,丝素蛋白作用于HA表面,与成骨细胞产生良好的亲活性,加大细胞的黏附、细胞间信号的联系促进成骨细胞的生长;同时丝素蛋白具有良好的亲水性,羟基磷灰石吸水性增加促使羟基磷灰石钙离子析出,从而诱导羟基磷灰石形成晶体状结构。结晶随着时间的延长,丝素蛋白的增多而不断增加,尤其这些结晶的结构、形态和人骨组织中的纳米微晶非常相似〔14〕。本实验结果显示:12 w左右TSF-HA组织工程化骨完成了对骨缺损的修复,与易诚青等〔15〕的研究结果相符,降解率适宜,作为骨缺损的爬行替代材料组织工程化骨可较快被自身骨组织取代,完成骨修复,基本符合现代骨组织工程学的标准。TSF-HA组织工程化骨克服了单纯HA降解极差的不足,显示了TSF-HA作为理想人工骨的良好前景,有望成为一种新的、优良的骨组织工程支架材料。对于TSF如何改变HA的理化性能、复合支架与BMSCs间和细胞与细胞间的相互作用,成骨等机制还不十分清楚,这些问题有待于进一步研究。
1 Smartt JM Jr,Elliott RM,Reid RR,et al.Analysis of differences in the cranial base and facial skeleton of patients with lambdoid synostosis and deformational plagiocephaly〔J〕.Plast Reconstr Surg,2011;127(1):303-12.
2 Rajan GP,Kuthubutheen J,Hedne N,et al.The role of preoperative,intratympanic glucocorticoids for hearing preservation in cochlear implantation:a prospective clinical study〔J〕.Laryngoscope,2012;122(1):190-5.
3 Farfalli GL,Aponte-Tinao LA,Rasumoff A,et al.Intraoperative ultrasound assistance for excision of impalpable musculoskeletal soft tissue tumors〔J〕.Orthopedics,2011;34(9):e570-3.
4 Sen MK,Miclau T.Autologous iliac crest bone graft:should it still be the gold standard for treating nonunions〔J〕?Injury,2007;38 Suppl 1:S75-80.
5 Johari A,Shingade V,Gajiwala AL,et al.The use of irradiated allograft in a padeiatric population:an Indian experience〔J〕.Cell Tissue Bank,2007;8(1):10-2.
6 Muscolo DL,Ayerza MA,Aponte-Tinao LA,et al.Use of distal femoral osteoarticular allografts in limb salvage Surgery.Surgical technique〔J〕.J Bone Joint Surg Am,2006;88 Suppl 1 Pt 2:305-21.
7 曹谊林,周广东.21世纪组织工程面临的机遇与挑战〔J〕.中华医学杂志,2005;85:2523-5.
8 唐文胜,蒋电明.羟基磷灰石及其复合材料在骨修复中的作用及研究进展〔J〕.中华创伤骨科杂志,2003;5:370-3.
9 Meinel L,Hofmann S,Karageorgiou V,et al.The inflammatory re-sponses to silk films in vitro and in vitro〔J〕.Biomaterials,2005;26:147-55.
10 Meinel L,Fajardo R,Hofmann S,et al.Silk implants for the healing of critical size bone defects〔J〕.Bone,2005;37:688-8.
11 Wang X,Bank RA,TeKoppele JM,et al.The role of collagen in determining bone mechanical properties〔J〕.J Orthop Bes,2001;19:1021-6.
12 Yunoki S,Ikoma T,Monkawa A,et al.Control of ponre structure and mechanical property in bydroxyapatite/collagen composite using unidirectional ice growth〔J〕.Materials Letters,2006;60(80):999-1002.
13 Lu JX,Flautre B,Anselme K,et al.Role of interconnetions in porous bioceramics on bone recolonization in vitro and in vivo〔J〕.J Mater Sci Mater Med,1999;10(2):111-20.
14 卢神州,李明忠,白 伦.羟基磷灰石/丝素蛋白纳米复合颗粒的制备〔J〕. 丝绸,2006;(2):17-23.
15 易诚青,杜靖远,郑启新.转化生长因子Bl转基因生物衍生型移植体修复骨缺损〔J〕.中华实验外科杂志,2006;23:157-9.

