缺氧诱导因子-1α及血管内皮生长因子在Ⅱ型胶原诱导性关节炎模型中的致病作用
刘 菁 梁 爽 黄大林 王 雯 李莎莎 陈森洲 (桂林医学院,广西 桂林 541004)
类风湿关节炎(RA)不仅累及关节,而且具有严重的并发症及多种关节外表现,其病因和发病机制迄今尚未明确。近年来研究发现,低氧诱导因子-1α(HIF-1α)在调节缺氧组织血管新生、细胞增殖存活、能量代谢、铁转运等方面具有重要作用。血管内皮生长因子(VEGF)可直接促进滑膜血管翳形成、加重滑膜炎症及骨与关节软骨的破坏。Tang等〔1〕通过对肿瘤内皮细胞敲除HIF-1α基因,证实了HIF-1α调控血管发生的功能。HIF-1α通过上调VEGF表达,促进血管生成,可能是其参与RA发病最重要机制之一。本文探讨HIF-1α在RA发病过程中的作用及其与VEGF之间的关系。
1 材料与方法
1.1 主要仪器 病理组织切片机(LEICA RM,2025,德国);制冰机(SLM-F124,日本);多功能高速冷冻离心机(Eppendorf,5804R,德国);生物组织自动脱水机(TS-12F,湖北)及病理组织包埋机和包埋冷冻台(BMJ-III,常州)等。
1.2 主要试剂 牛Ⅱ型胶原,不完全弗氏佐剂(Sigma,F5506-10 ml),TRIZOL(美国 Invitrogen 公司,批号 1382739),RT-PCR试剂盒(大连宝生物工程有限公司,DRR014A),HIF-1α一抗(Abcam,批号653496),二抗、DAB显色剂(福州迈新生物工程有限公司,批号:100301408A、1003150031),羊血清工作液(北京中衫金桥生物工程有限公司,批号:90519050)。
1.3 实验动物及分组 选用体重150~180 g的50只SD健康大鼠(雌雄各半),动物级别:SPF,由本院实验动物中心提供,动物许可证号:SCXK桂2007-0001,购入本实验室动物房分笼喂养,每笼5只。每日给予标准饲料,清洁自来水置笼侧自由饮用,适应性饲养1 w后进行实验。
1.4 模型制作〔2〕Ⅱ型胶原用0.1 mol/L冰醋酸溶解后,配成2 g/L溶液,置4℃冰箱过夜。第2天将搅拌好的Ⅱ型胶原醋酸溶液按1∶1在冰浴中滴加至 IFA,充分乳化后,终浓度为1 g/L。大鼠麻醉后,背部剃毛,在尾根部、背部分4~5点皮内注射乳化液0.5 ml,正常对照组(A组)同法同部位注射0.5 ml生理盐水,7 d后同法同部位(避开原注射部位)半量加强免疫一次。
1.5 病理标本制作 造模组B、C、D、E组大鼠分别于初次免疫后第21、28、35、42天处死,正常对照组大鼠于注射生理盐水后第42天处死,进行指标检测,取材部位为踝关节。将修剪后关节至4%多聚甲醛中固定12 h后,放入10%EDTA(pH7.0)中脱钙,脱钙液与标本体积保持>10∶1比例。将脱钙液和标本放入46℃水浴箱中,隔天换一次脱钙液,用大头针刺扎标本,直到针头可刺入骨密质为止,脱钙时间大约2~3 w〔3〕。脱钙完毕后,将标本脱水透明石蜡包埋,连续切片,片厚3 μm,分别行HE染色,SP免疫组织化学染色法检测HIF-1α蛋白的表达。
1.6 观察指标
1.6.1 大鼠一般状况及体重测定 造模前后动态观察大鼠体重、毛发色泽改变、神志、活动状态,食量变化及关节红肿情况,每周定期测量每只大鼠体重。
1.6.2 关节炎指数〔3〕(AI) 根据大鼠踝关节、跖趾关节、趾关节红肿程度及受影响关节数进行评分。0分:正常;1分:1个关节红肿;2分:2个及2个以上关节红肿;3分:踝关节以下足掌严重红肿;4分:包括踝关节在内的全部足爪红肿且不能负重。四肢分别评分,累计总和即为AI。AI>5分为造模成功。
1.6.3 踝关节影像学观察 初次免疫后第21天、第42天经1%戊巴比妥麻醉大鼠后,拍摄踝关节X线片。摄片条件为40 kV。
1.6.4 滑膜病理学评分〔4〕滑膜细胞增生、滑膜下层炎症程度及血管生成情况。滑膜细胞增生评分:少于3层为0分,3~4层为1分,5~6层为2分,6层以上为3分。炎症程度评分:无淋巴细胞浸润为0分,淋巴细胞聚集为1分,弥漫分布形成淋巴滤泡形成为2分,形成淋巴滤泡淋巴滤泡伴生发中心或生发中心为3分。血管生成评分:无新生血管生成为0分,轻度新生血管生成为1分,中度为2分,重度为3分。以上3项评分累计总和即为病理学总评分。
1.6.5 免疫组织化学染色结果判定及评分 采用半定量记分法判定:①按阳性着色程度评分。0分为无着色,与背景色一致;1分为浅黄色,略高于背堪色;2分为棕黄色,明显高于背景色;3分为棕褐色。②按阳性细胞所占比例评分。0分为阴性;1分为10%以下;2分为11% ~50%;3分为51% ~75%;4分为75%以上。③两者乘积判定阳性结果。HIF-1α阳性细胞为胞浆或胞核呈棕黄色或棕褐色。
1.7 统计学处理 全部数据采用SPSS13.0统计软件进行处理,正态分布资料用±s表示;多组间均数的比较采用单因素方差分析;半定量资料两组间比较采用Mann-Whitney秩和检验;对两组数据间的相关性进行Spearman等级相关分析。
2 结果
2.1 建立CIA大鼠模型 模型组50只大鼠在首次给药后第12天起,有26只出现踝、跖趾关节以及趾关节红肿。正常对照组未出现明显关节红肿。造模成功率为65%(26/40)。
2.2 一般情况 造模期间动物无死亡,对照组大鼠随着饲养时间的延长,体重逐渐增加、精神状态良好、毛发光泽、活动自如。模型组给药12 d后开始出现不同程度后足爪红肿、皮温升高、毛发失去光泽、竖毛、脱毛、懒动、扎堆、精神怠倦、体重增长减慢甚至下降、饮食饮水量下降。给药48 h后注射部位出现多个炎性小溃疡,红肿明显,逐渐加重并破溃,7~10 d破溃处形成硬痂,而后脱落溃疡愈合。模型组体重增长明显小于对照组大鼠。
2.3 CIA大鼠AI及关节肿胀度的变化 随着炎症的发展,AI值逐渐增加。初次免疫12 d及以后各时间点AI值均与正常组比较有差异(P<0.05),第21天达峰值,之后逐渐下降,42 d降至最低值,但仍高于正常组。正常对照组AI值均小于1(图1)。模型组大鼠初次免疫后第7天部分大鼠足趾表面发红,皮温升高,第12天开始相继出现后足爪明显肿胀,关节僵硬,活动受限,第21天达高峰,随后关节肿胀有所减轻,持续至第42天。正常对照组均未见明显肿胀。AI值与关节肿胀度均提示关节病变从第21天开始,持续至第42天,且21~28 d关节病变最明显。
2.4 X线改变 对照组大鼠踝关节软组织无肿胀,骨质无破坏,结构完整,足趾关节间隙清楚。CIA大鼠免疫后第21天,X线显示踝关节周围软组织肿胀,足趾关节间隙模糊、狭窄及融合等表现。第42天踝关节骨骼结构排列紊乱,关节间隙不清,除见囊性骨吸收和骨侵蚀、骨质疏松和新骨形成外,伴有关节僵直,提示CIA模型大鼠发生慢性侵蚀性关节炎。
2.5 大鼠踝关节病理学变化 正常大鼠滑膜由1~3层扁平滑膜细胞组成,无炎细胞浸润及血管增生,关节结构完整,软骨层较厚,表面光滑。CIA组大鼠初次免疫后21 d时滑膜细胞层增至10~15层,增生滑膜形成血管翳,炎细胞浸润;42 d侵蚀软骨及骨,关节软骨可见坏死脱落、纤维化,新生骨形成,关节腔狭窄,广泛炎细胞浸润,伴有不同程度软组织水肿,滑膜下层大量纤维增生及新生血管形成,呈肿瘤性侵袭生长。见表1。
2.6 CIA大鼠滑膜HIF-1α的表达 正常对照组均未见HIF-1α(0.20±0.42)。CIA 模型组 B、C、D、E 组大鼠滑膜 HIF-1α表达增强(8.00±0.76、7.40±1.67、6.00±0.82、5.00±1.26,P<0.01),HIF-1α在细胞核及细胞质中均表达。从免疫组化结果可以看出不仅滑膜细胞,滑膜下层巨噬细胞、部分血管内皮细胞、成纤维细胞等也表达HIF-1α。在第21、28天滑膜细胞阳性表达量及程度最高,随病程进展,阳性表达量及程度逐渐下降。见图2。
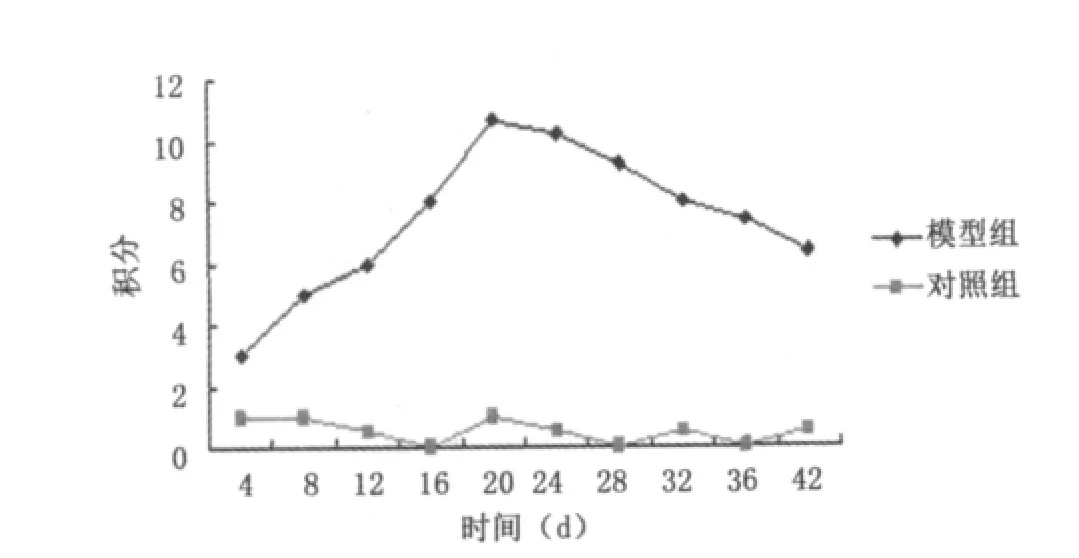
图1 大鼠AI平均积分
表1 各组大鼠滑膜病理学评分(±s)
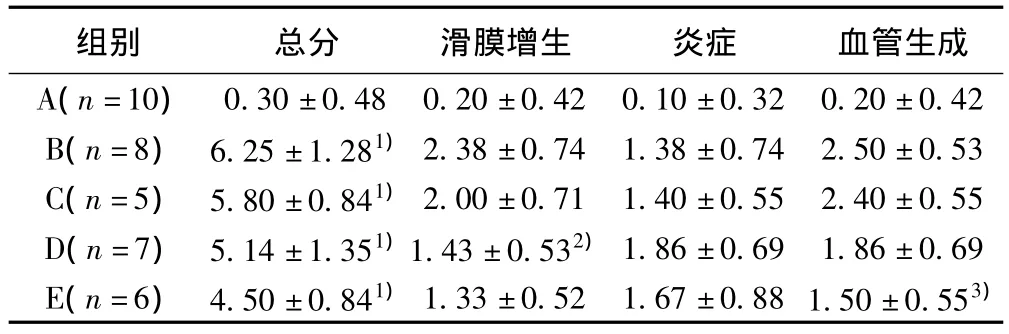
表1 各组大鼠滑膜病理学评分(±s)
与A组比较:1)P<0.01;与B组比较:2)P<0.05,3)P<0.01
组别 总分 滑膜增生 炎症 血管生成A(n=10)0.30±0.48 0.20±0.42 0.10±0.32 0.20±0.42 B(n=8) 6.25±1.281)2.38±0.74 1.38±0.74 2.50±0.53 C(n=5) 5.80±0.841)2.00±0.71 1.40±0.55 2.40±0.55 D(n=7) 5.14±1.351)1.43±0.532)1.86±0.69 1.86±0.69 E(n=6) 4.50±0.841)1.33±0.52 1.67±0.88 1.50±0.553)
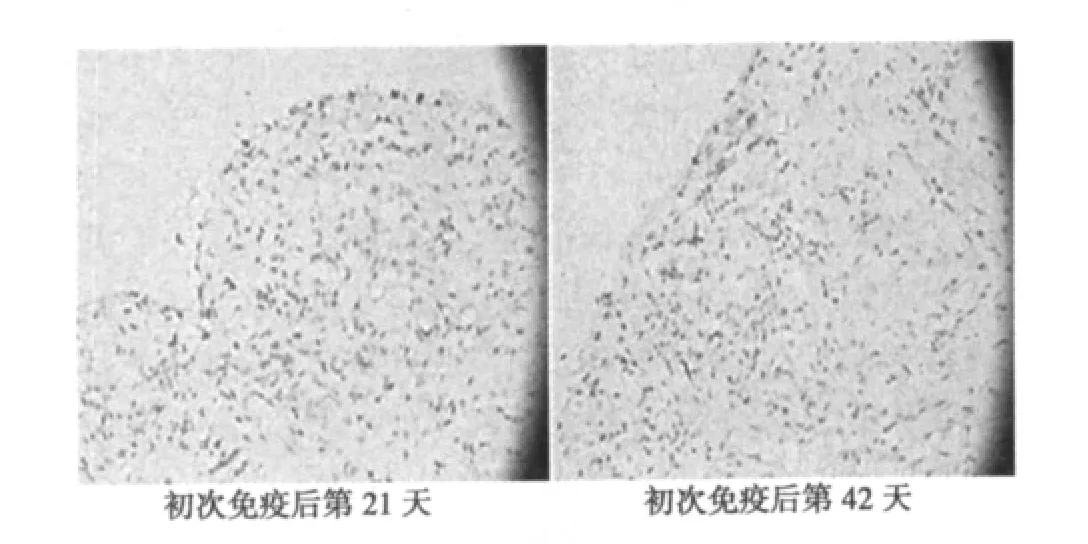
图2 模型组关节滑膜组织HIF-1α表达(DAB,×400)
2.7 CIA大鼠滑膜HIF-1α表达与AI的关系 HIF-1α表达情况分别与大鼠AI进行相关回归分析,均呈明显正相关(r值为0.73,P<0.05)。
2.8 CIA大鼠HIF-1α表达与病理学评分的关系 CIA大鼠各组HIF-1α蛋白表达的免疫组化评分与各组滑膜病理学总评分、滑膜增生评分及血管生成评分均呈明显正相关(r值分别为0.40、0.48及0.50,P<0.05),与炎症浸润评分无明显相关(r值为0.30,P>0.05)。
3 讨论
CIA是目前用于研究RA的最佳模型,通过使用尾跟部皮内注射天然Ⅱ型胶原免疫SD大鼠,成功构建了CIA模型。RA主要病理改变为滑膜炎,滑膜细胞增殖具有锚着非依赖性生长、失去接触抑制、凋亡减少及侵蚀性等类似肿瘤生长〔5〕的特点。滑膜细胞这种类肿瘤样增殖和大量炎症细胞的浸润,导致局部毛细血管氧弥散距离及耗氧量的增加,进而造成一个低氧微环境。本实验发现,CIA大鼠滑膜表达HIF-1α明显增强,造模后第21~28天模型组关节肿胀程度最显著,此时HIF-1α表达也比其他时间点明显升高,随着发病时间延长,表达量逐渐下降,HIF-1α在CIA大鼠关节病变过程中呈动态表达。且HIF-1α表达与关节炎活动指标及滑膜病理学总评分呈明显正相关,提示HIF-1α与VEGF在RA滑膜组织增生和血管生成中起重要作用〔6〕。
实验研究结果显示CIA大鼠关节滑膜表达HIF-1α,并与关节炎病情活动、滑膜增生及血管生成密切相关,提示HIF-1α很可能在RA中通过调控一系列下游靶基因,影响滑膜炎的发生、发展。由于RA是“难治之症”,因此,探究HIF-1α在RA的发病机制中所发挥关键作用,很可能是重要的治疗靶点。可通过对HIF-1α进行阻断,从而阻止滑膜炎的发生、发展,基于抗HIF-1α的靶向治疗有望对RA治疗提供科学的理论依据和可行的方法指导,从而为RA的治疗开辟新途径。
1 Tang N,Wang L,Esko J,et al.Loss of HIF-1alpha in endothelial cells disrupts a hypoxia-driven VEGF autocrine loop necessary for tumorigenesis〔J〕.Cancer Cell,2004;6(5):485-95.
2 Baharav E,Mor F,Halpern M,et al.Lactobacillus GG bacteria ameliorate arthritis in Lewis rats〔J〕.J Nutr,2004;134(8):1964-9.
3 Tsubaki T,Arita N,Kawakami T,et al.Characterization of histopathology and gene-expression profiles of synovitis in early rheumatoid arthritis using targeted biopsy specimens〔J〕.Arthritis Res Ther,2005;7(4):825-36.
4 王 雯,陈森洲,王险锋,等.HIF-1α、VEGF在CIA模型中的表达与意义〔J〕.第三军医大学学报,2010;32(6):563-7.
5 Rudolph EH,Woods JM.Chemokine expression and regulation of angiogenesis in rheumatoid arthritis〔J〕.Curr Pharm Des,2005;11(5):613-31.
6 陈森洲,王险峰,侯巧燕,等.低氧诱导因子-1α在CIA模型中的表达及其意义〔J〕.中华微生物学和免疫学杂志,2010;30(2):115-9.

