原花青素对阿尔茨海默病大鼠学习记忆功能及海马nNOS表达的影响
王 欢,姚 海,郑书国,马玉红,张俊秀,杨解人
(皖南医学院 药理学教研室,安徽 芜湖 241002)
阿尔茨海默病(Alzheimer's disease,AD)是威胁老年人身体健康的常见疾病,表现为慢性退行性神经系统病变,其基本的病理学特征为神经细胞外以β-淀粉样蛋白(β-amyloid,Aβ)沉积为核心的老年斑(senile plaques,SP)和神经细胞内以Tau蛋白过度磷酸化所致的神经元纤维缠结(neurofibrilary tangles,NFTs)[1],目前尚无有效的治疗药物[2]。
原花青素(procyanidins,PC)是植物中广泛存在的一种多酚化合物,是植物体内天然的抗氧化物质,具有抗氧化、抗肿瘤、抗炎、抗突变、抗病毒、抗真菌等多种生物学活性[3-4]。目前有关PC的研究主要集中于心血管、糖尿病及癌症等方面,极少涉及神经系统退行性疾病。鉴于PC具有强大的抗氧化能力,而AD发病机制中氧化应激是促进Aβ聚集,进而造成AD发病和进展的原因之一,故而推测PC对AD可能具有治疗作用。本实验采用腹腔注射D-半乳糖联合AlCl3灌胃制备大鼠AD模型,观察原花青素对AD的学习记忆功能及海马nNOS表达的影响,并探讨其可能机制。
1 材料与方法
1.1 实验动物 清洁级10周龄SD大鼠80只,体质量为(150±20)g,许可证号:SCXK(苏)2009-0002,购于苏州大学实验动物中心;正常颗粒饲料均购自于南京市江宁区青龙山动物试验中心。
1.2 主要试剂及仪器 原花青素为葡萄籽提取物(纯度>95%,天津尖峰天然产物公司);维生素E(北大国际医院集团西南合成制药股份有限公司,批号H50020272);三氯化铝(AlCl3)(国药集团化学试剂有限公司,批号20110506);D-半乳糖(D-gal)(reanta scientific technology company);SABC试剂盒(武汉博士德公司,编号SA-1052);nNOS抗体(北京博奥森生物技术有限公司,编号bs-0156R);辣根过氧化物酶标记山羊抗兔lgG(A0208)、尼氏(Nissl)染色液(C0117)、一氧化氮检测试剂盒(S0021)购于上海碧云天生物技术研究所。Morris水迷宫实验系统[5](中国科学院心理健康重点实验室隋南实验室馈赠);Olympus显微镜及成像系统(日本);黑马病理图像分析仪(珠海黑马仪器生产公司);DNM-9602酶标分析仪(北京普朗新技术有限公司)。
1.3 造模与分组 正常SD大鼠80只,设立空白对照组(NSip,NS ig)15只,其余大鼠腹腔注射D-半乳糖[D-gal,180 mg/(kg·d)]联合灌胃三氯化铝[AlCl3,15 mg/(kg·d)]连续 12 周后,Morris水迷宫法检测筛选造模成功大鼠,于第13周开始随机分为4组,每组15只,分别为AD模型组(NS ip,D-gal ip+AlCl3ig),原花青素高剂量组(PC 40 mg/kg;D-gal ip+AlCl3ig),原花青素低剂量组(PC 10 mg/kg;D-gal ip+AlCl3ig),维生素E阳性对照组(VitE 10 mg/kg;D-gal ip+AlCl3ig),继续给药8周后结束实验并分别检测相应指标。
1.4 大鼠学习记忆能力检测 全部给药结束后采用Morris水迷宫系统测试大鼠学习记忆能力[5]。定位航行实验,连续5 d,每日1次,包括分别从4个象限(随机)面向池壁入水,每个间隔30 s。软件的最长检测时间设为60 s,驻台时间5 s(作为找到平台的标准)。若大鼠能找到并登上平台,在平台上停留5 s后停止记录,将软件记录的大鼠在水中游泳的时间记为逃避潜伏期;若大鼠60 s内未找到平台,则在软件停止计时后由实验者引导其登上平台并停留15 s,此时的逃避潜伏期计为60 s。由此将4个象限入水的4个检测求出平均结果,记为当天的检测结果,最后取5 d的平均值来进行大鼠逃避潜伏期的统计。空间探索实验,在第5天定位航行实验结束后1 h,把平台撤离,将大鼠从原平台所在象限的对侧象限入水,进行空间探索实验1次,记录大鼠在60 s内穿越原平台所在位置的次数。数据采集和处理由Morris水迷宫视频追踪系统完成。
1.5 标本采集 行为学测试结束后,将大鼠称重、麻醉(1%戊巴比妥钠 0.3 ml/100 g,i.p)后迅速断头处死大鼠,每组各取7只大鼠的整脑,4%的多聚甲醛固定,常规脱水、浸蜡、包埋,石蜡切片用于病理学观察。每组剩下的8只大鼠取海马,-80℃保存备用。
1.6 尼氏(Nissl)染色 常规石蜡切片(5μm),放入60℃烘箱2 h烤干后,常规脱蜡至水。加入尼氏染色液5 min后,用蒸馏水冲洗两次后常规脱水、透明、中性树胶封片,光镜下观察大鼠海马神经元尼氏小体的变化。
1.7 海马NO含量检测 从-80℃冰箱取出大鼠海马,加入PBS缓冲液制成10%匀浆,4℃12 000 r/min离心10 min,取上清液按试剂盒说明采用Griess Reagent法检测NO含量。
1.8 免疫组化染色 常规石蜡切片(5μm)脱蜡至水,灭活内源性过氧化物酶后浸入0.01 mol/L枸橼酸盐缓冲液,微波热抗原修复,冷却后封闭。滴加一抗nNOS抗体(1∶200),4℃冰箱过夜后分别依次滴加二抗、SABC,PBS洗3次,DAB显色。显色之后常规脱水、透明、中性树胶封片,光镜下观察。每组选取相同冠状切面的切片7张,海马定位后观察每张切片海马各个区的神经元阳性细胞表达,并用黑马病理图像分析系统测量细胞平均灰度值。
1.9 数据处理 采用DAS 2.0软件包进行统计学分析,计量资料以均数±标准差(¯x±s)表示。多组均数间两两比较,方差齐时用t检验,方差不齐时则用t'检验。以P<0.05为有统计意义。
2 结果
2.1 原花青素对AD大鼠学习记忆能力的影响与正常对照组相比,模型组大鼠的逃避潜伏期明显延长(P<0.01),而穿越平台次数明显减少(P<0.01);与模型组相比,原花青素组和维生素E阳性组大鼠的逃避潜伏期均明显缩短(P<0.01或P<0.05),穿越平台次数明显增加(P<0.05)。说明原花青素组能有效改善AD大鼠的学习记忆能力(表1)。
2.2 尼氏(Nissl)染色 尼氏染色显示背景色为蓝色,正常对照组海马神经元细胞染色清晰,排列紧密、规则,形态完整。与正常对照组相比,AD大鼠模型组海马神经元细胞排列疏松不均,明显减少,细胞出现空染或淡染,形态不规则。与模型组相比,原花青素组和维生素E阳性组的海马神经元排列较紧密规则,空染或淡染细胞较少。说明原花青素对AD大鼠模型有一定的改善作用(图1~4)。
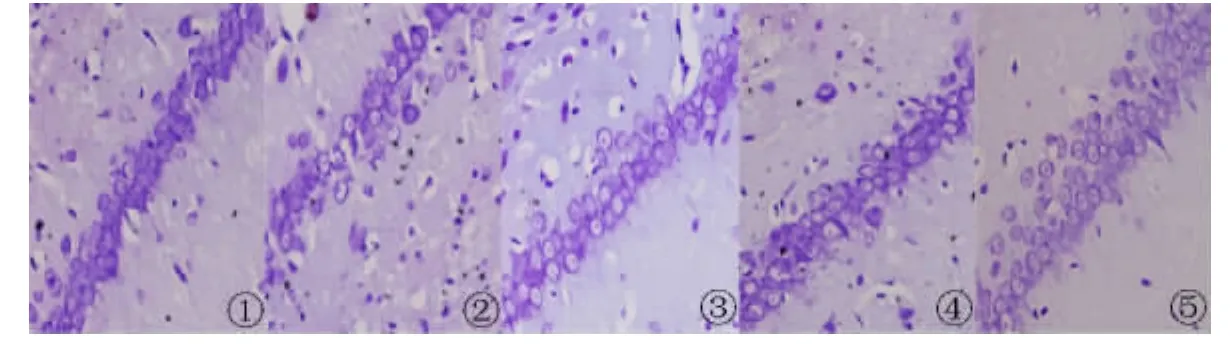
图1 大鼠海马CA1区尼氏染色(×400)1.正常对照组;2.模型组;3.维生素E阳性组;4.原花青素高剂量组;5.原花青素低剂量组Fig 1 Nissl staining for the hippocampal CA1 region(×400)1.Control group;2.Model group;3.Vitamin E group;4.High dosage of procyanidins;5.Low dosage of procyanidins
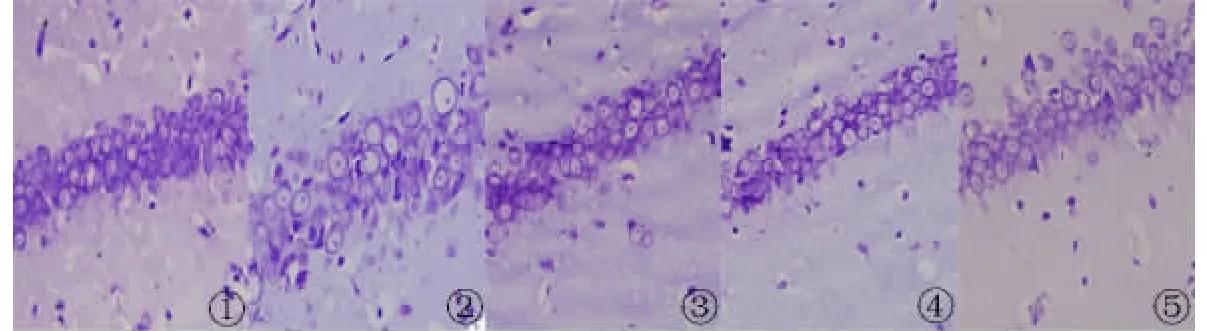
图2 大鼠海马CA2区尼氏染色(×400)1.正常对照组;2.模型组;3.维生素E阳性组;4.原花青素高剂量组;5.原花青素低剂量组Fig 2 Nissl staining for the hippocampal CA2 region(×400)1.Control group;2.Model group;3.Vitamin E group;4.High dosage of procyanidins;5.Low dosage of procyanidins
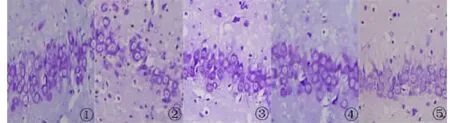
图3 大鼠海马CA3区尼氏染色(×400)1.正常对照组;2.模型组;3.维生素E阳性组;4.原花青素高剂量组;5.原花青素低剂量组Fig 3 Nissl staining for the hippocampal CA3 region(×400)1.Control group;2.Model group;3.Vitamin E group;4.High dosage of procyanidins;5.Low dosage of procyanidins
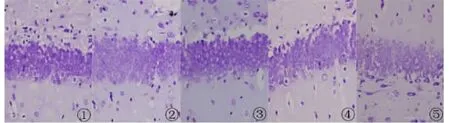
图4 大鼠海马DG区尼氏染色(×400)1.正常对照组;2.模型组;3.维生素E阳性组;4.原花青素高剂量组;5.原花青素低剂量组Fig 4 Nissl staining for the hippocampal DG region(×400)1.Control group;2.Model group;3.Vitamin E group;4.High dosage of procyanidins;5.Low dosage of procyanidins
2.3 大鼠海马组织NO含量 与正常对照组相比,模型组NO含量明显升高(P<0.01);与模型组相比,原花青素高剂量组和维生素E阳性对照组NO含量明显降低(P<0.01),而原花青素低剂量组NO含量有所降低,但无统计意义(表2)。
2.4 免疫组化染色 海马各个区内nNOS阳性神经元胞浆染色多呈棕色,少数深染呈棕褐色,胞体轮廓清晰。与正常对照组相比,模型组大鼠各个区nNOS阳性神经细胞表达均明显增多,灰度值明显降低(P<0.01),且以CA3区最为明显。与模型组相比,CA1、CA2、CA3、DG四个区的维生素E阳性组和原花青素高剂量组nNOS阳性神经细胞表达明显减少,灰度值明显升高(P<0.01),而原花青素低剂量组则在CA1区和DG区改变不是很明显,无统计意义(表3,图5~8)。

图5 大鼠海马CA1区nNOS的表达(×400)1.正常对照组;2.模型组;3.维生素E阳性组;4.原花青素高剂量组;5.原花青素低剂量组Fig 5 Expression of nNOSat the hippocampal CA1 region(×400)1.Control group;2.Model group;3.Vitamin E group;4.High dosage procyanidins;5.Low dosage of procyanidins

图6 大鼠海马CA2区nNOS的表达(×400)1.正常对照组;2.模型组;3.维生素E阳性组;4.原花青素高剂量组;5.原花青素低剂量组Fig 6 Expression of nNOSat the hippocampal CA2 region(×400)1.Control group;2.Model group;3.Vitamin E group;4.High dosage procyanidins;5.Low dosage of procyanidins

图7 大鼠海马CA3区nNOS的表达(×400)1.正常对照组;2.模型组;3.维生素E阳性组;4.原花青素高剂量组;5.原花青素低剂量组Fig 7 Expression of nNOSat the hippocampal CA3 region(×400)1.Control group;2.Model group;3.Vitamin E group;4.High dosage procyanidins;5.Low dosage of procyanidins

图8 大鼠海马DG区nNOS的表达(×400)1.正常对照组;2.模型组;3.维生素E阳性组;4.原花青素高剂量组;5.原花青素低剂量组Fig 8 Expression of nNOSat the hippocampal DG region(×400)1.Control group;2.Model group;3.Vitamin E group;4.High dosage procyanidins;5.Low dosage of procyanidins
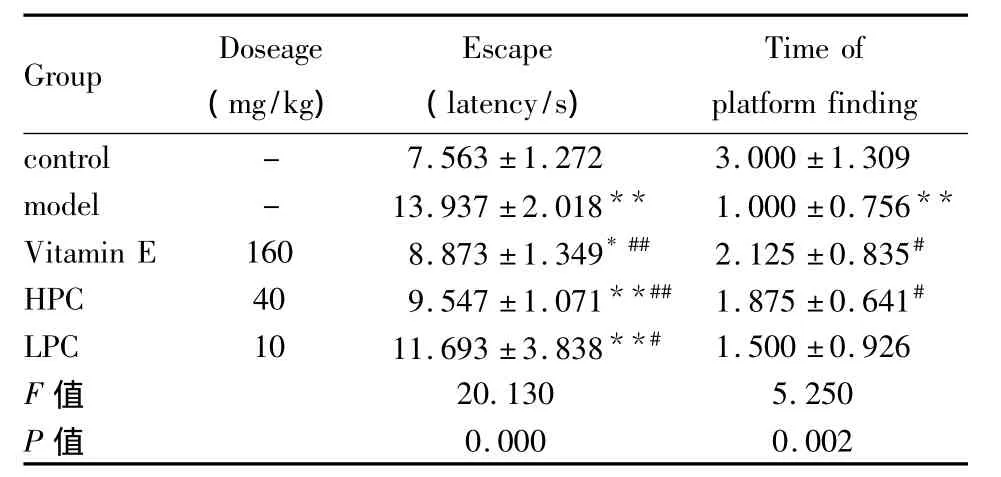
表1 不同剂量原花青素对AD大鼠学习记忆能力的影响(¯x±s,n=15)Tab 1 Effects of different dosage of procyanidins on the learning and memory ability in AD model rats(¯x±s,n=15)
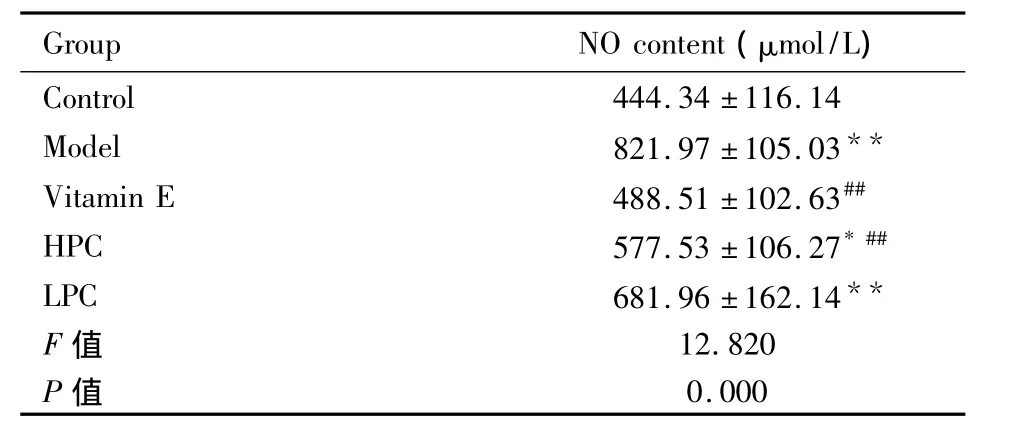
表2 海马组织NO含量变化(¯x±s,n=8)Tab 2 The changes in the content of NO at hippocampus(¯x±s,n=8)
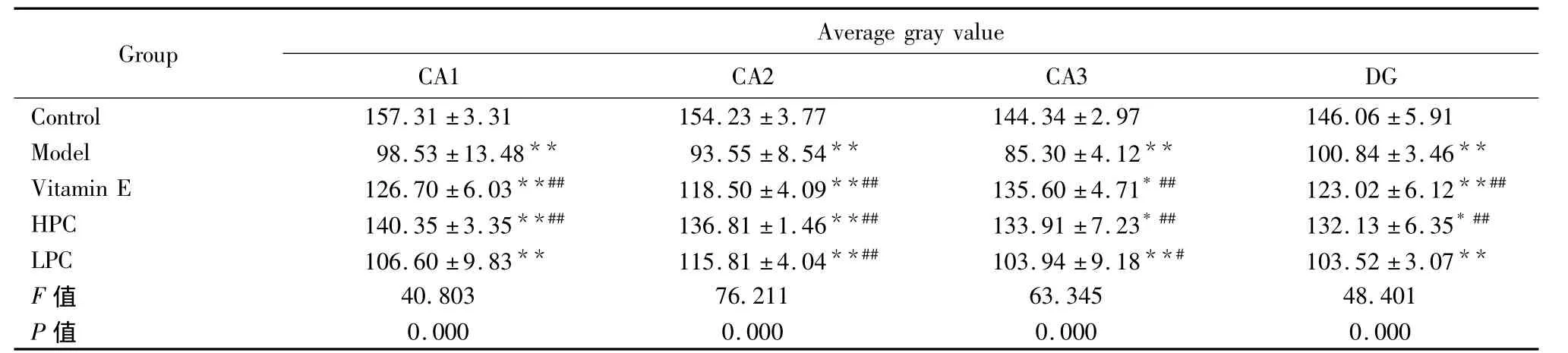
表3 不同剂量原花青素对AD大鼠海马各个区nNOS表达的影响(¯x±s,n=7)Tab 3 Effects of different dosage of procyanidins on nNOSexpression in AD model rats(¯x±s,n=7)
3 讨论
研究表明[6],动物长期注射D-半乳糖可以使其多器官功能衰退而出现亚急性衰老表现;铝是一种神经毒素,与 AD 的发生也密切相关[7-9];Abdel-Aal等[10]也证实了给动物服用或注射氯化铝,动物均出现明显的认知行为障碍。研究也已经证实,采用腹腔注射D-半乳糖和灌胃AlCl3合并制备大鼠AD模型,模型鼠出现了胆碱能神经元及其他神经元不同程度的丢失,学习记忆能力减退,脑组织出现Aβ沉积并有类SP和NFT形成,可较成功地模拟AD的发病及病理特征[11]。本实验通过Morris水迷宫法检测大鼠的学习记忆能力和尼氏染色观察海马神经元尼氏小体的变化也进一步证实了这一模型的成功。
在中枢神经系统中,海马是学习和记忆的关键脑区。海马的长时程增强(long-term potential,LTP)是公认的脑学习记忆功能在突触水平的研究模型和细胞基础。NO是参与LTP形成的逆行信使[12-13],主要通过谷氨酸-一氧化氮-环磷酸鸟苷(Glu-NO-cGMP)通路参与 LTP 的形成。研究表明[14-15],低浓度的NO可通过多种机制发挥细胞保护作用,而过量的NO则导致神经毒性从而引起认知功能障碍[16-17]。nNOS主要存在于中枢神经系统的大脑皮质、海马、小脑、下丘脑、脑干等部位的神经元内,神经元通过激活nNOS产生NO[18]。研究认为,nNOS的过度表达可作为一个重要介导因素引起NO的神经毒性作用,从而导致神经元的凋亡和变性坏死[19],而抑制nNOS的产生对神经元的损伤具有保护作用[20]。本实验结果也证实了AD大鼠模型海马内的nNOS表达是明显增加的,尤其以CA3区最为明显,提示海马CA3区可能是AD模型大鼠受损最严重的区域。
荷兰的一项流行病学调查结果显示,高剂量维生素C及维生素E能延缓AD的发展;银杏提取物EGB761及五味子酚等均是抗氧化剂,能清除自由基、增强中枢胆碱能功能、增加脑血流量以及改善脑正常功能代谢而延缓衰老,防治AD[21-22]。由于PC具有强大的抗氧化能力,故而推测PC对AD可能具有治疗作用。蔡洪斌等[23]证实了原花青素可以改善AD模型大鼠的认知功能,通过清除自由基和抗脂质过氧化作用来提高AD模型大鼠脑组织的抗氧化能力。本实验结果也说明了原花青素对nNOS的活性和表达有一定抑制作用,这一作用使NO含量减少,亦减少了NO的神经毒性。
本实验采用腹腔注射D-半乳糖和灌胃AlCl3合并成功制备大鼠AD模型。原花青素可能通过下调AD模型大鼠海马nNOS表达,从而减少因NO的产生所引起的神经损伤,这可能是原花青素治疗AD的机制之一。
[1] SATYABRATA KARN,Z WEI,DAVID MACTAVISH,et al.A beta peptide and Alzheimer's disease celebrating a century of research,A beta peptide and Alzheimer's disease[M].2007:159-160.
[2] CHUI HC,ZAROW C,MACK WJ,et al.Cognitive impact ot subcortical vascular arid Alzheimer's pathology[J].Ann Neurol,2006,60:677 -687.
[3] STRAUSAK D,MERCER JFB,DIETER HH,et al.Copper in disorders with neurologic symptoms:Alzheimer's,Menkes,and Wilson diseases[J].Brain Res Bull,2001,55:175 -185.
[4] LYNCH T,CHERNY RA,BUSH AI.Oxidative processes in Alzheimerps disease:the role of a beta-2 metal interactions[J].Exp Gerontol,2000,35(4):4452451.
[5] 秦雯,曲睿,汪萌芽.大鼠空间学习记忆能力测试的时反应量-效关系[J].皖南医学院学报,2010,29(6):462 -465.
[6] CUT X,ZUO P,ZHANG O,et al.Chronic systemic D-galactose exposure induces memory loss,ncurodegeneration,and oxidative damage in mice:protective effects of R-alpha-lipoic acid[J].Neurosci Res,2006,84:647 -654.
[7] TOMLJENOVIC L.Aluminum and Alzheimer's disease:after a century of controversy,is there a plausible link[J]?JAlzheimers Dis,2011,23(4):567 -598.
[8] WALTON JR.Aluminum disruption of calcium homeostasis and signal transduction resembles change that occurs in aging and Alzheimer's disease[J].J Alzheimers Dis,2012,29(2):255 -273.
[9] MIU AC,BENGA O.Aluminum and Alzheimer's disease:a new look[J].J Alzheimers Dis,2006,10(2 -3):179 -201.
[10] ABDEL-AAL RA,ASSI AA,KOSTANDY BB.Rivastigmine reverses aluminuminduced behavioral changes in rats[J].Eur J Pharmacol,2011,659:169 -176.
[11]罗红波,何明大.脑灵汤对模型大鼠学习记忆及海马内老年斑的影响[J].中国行为医学科学,2005,14(7):599 -600.
[12] FEIL R,KLEPPISCH T.NO/cGMP-dependent modulation of synaptic transmission[J].Handb Exp Pharmacol,2008(184):529 -560.
[13] NAMIKI S,KAKIZAWA S,HIROSE K,et al.NO signalling decodes frequency of neuronal activity and generates synapse-specific plasticity in mouse cerebellum[J].JPhysiol,2005,566(Pt 3):849-863.
[14] CALABRESE V,MANCUSO C,CALVANI M,et al.Nitricoxide in the central nervoussystem:neuroprotection versus neurotoxicity[J].Nature Reviews Neuroscience,2007,8(10):766 -775.
[15] CONTESTABILE A,MONTI B,AND CIANI E.Brain nitric oxide and its dual role in neurodegeneratio/neuroprotection:understanging molecular mechanisms to devise drug approaches[J].Current Medicinal Chemistry,2003,10(20):2147 -2174.
[16] MONCADA S,BOLANOS JP.Nitric oxide,Cell bioenergetics and neurode generation[J].Journal of Neuro chemistry,2006,97(6):1676-1689.
[17] ZANELLI SA,TRIMMER PA,SOLENSKI NJ.Nitric oxide,impairs mitochondrial movement incortical neurons during hypoxia[J].Journal of Neurochemistry,2006,97(3):724 -736.
[18] DREYER J,SCH LEICHER M,TAPPE A,et al.Nitric oxide synthase(NOS)interacting protein interacts with neuronal NOS and regulates it s di st ribut ion and act ivi ty[J].J N eurosci,2004,24(46):10454-10465.
[19] SCORZIELLO A,PELLEGRINI C,SECONDO A,et al.Neuronal NOSactivation during oxygen and glucose deprivation triggers cerebellar granule cell death in the later reoxygenation phase[J].Neuronal Res,2004,76(6):812 -821.
[20] KATSUKI H,YAMAMOTO R,NAKATA D,et al.Neuronal nitric oxide synthase is crucial for ganglion cell death in rat retinal explant cultures[J].JPharmacol Sci,2004,94(1):77 -80.
[21] ENGELHART MJ,GEERLINGS MI,RUITENBERGA,et al.Diet rayintake of antioxidants and risk of A lzheimer's disease[J].JAMA,2002,287(24):3223 -3229.
[22]吕建勇,拓两平,于方.华中五味子酮对阿尔茨海默病模型大鼠学习记忆的影响及其机制的研究[J].山西医药杂志,2007,36(1):27-29.
[23]蔡洪斌,王峰,张义军.原花青素对阿尔茨海默病模型大鼠脑组织的预防保护作用[J].中国老年学杂志,2011,22(11):4408-4410.

