瘢痕组织对手术部位感染及细菌定植的影响
刘文辉 黄晓璐 谢芸 李青峰
手术切口感染(Surgical site infection,SSI)是外科常见的术后并发症之一。SSI延长住院时间[1]、增加ICU入住率[2],并显著增加治疗费用[3-4]。同时SSI不利于术后切口的愈合和美观,会降低整复手术的效果。因此,SSI的术前预防应得到充分重视。研究表明,术前细菌携带状态是术后感染发生的重要危险因素,其中以金黄色葡萄球菌的携带状态最为典型。Bode等[5]报道的大样本(6492例病人)随机对照实验证实,住院患者发生SSI,与术前金葡菌的携带状态高度相关。另有报道证实,持续腹膜透析患者,切口周围带菌状态,使发生相关感染的风险增加了3倍,万古霉素的使用量增加了6倍[6]。
临床经验表明,涉及瘢痕的外科手术SSI率更高。可能是由于瘢痕组织的生理和病理状态与正常手术部位显著不同,导致细菌的异常定植,从而造成SSI。因此,本研究提出假设:瘢痕组织表面定植的病原菌可能明显多于正常手术部位,从而增加术后SSI风险。为检验这一假设,我们设计了以下的前瞻性研究,比较经瘢痕组织与经正常皮肤手术部位感染率,探索瘢痕组织细菌定植的流行病学和危险因素,为临床中是否应该将瘢痕组织作为特殊消毒部位以降低SSI风险提供理论依据。
1 对象与方法
1.1 研究对象
从我科2010年至2012年接受整复手术的住院患者中,筛选出129名符合标准的病例,纳入标准为:无代谢性疾病;无系统性疾病;年龄不超过65岁;无术前感染及皮肤慢性溃疡。所有资料在采集前均取得患者知情同意。
1.2 研究方法
1.2.1 资料收集
根据手术切口是否经过瘢痕区域,将患者分为瘢痕组和非瘢痕组,收集患者的基本人口学信息(姓名、年龄、性别、居住地等)、手术部位、SSI相关的危险因素(吸烟史、手术时间等)、瘢痕成因、瘢痕形成时间、烧伤深度(仅对烧伤患者),以及是否存在增生性瘢痕等。
1.2.2 SSI的确定
SSI的确定遵循卫生部 《外科手术部位感染预防与控制技术指南》,同时参考了美国疾控中心相关指南[7],并进一步分为浅部感染(仅涉及皮肤和皮下组织)和深部感染(累及深部软组织)。
1.2.3 细菌分离培养鉴定与药敏试验
有报道认为,从感染手术部位分离的致病菌株和术前在该部位定植的菌株通常一致[8-9],因此术前在手术部位采集微生物样本是揭示SSI致病菌的有效方法。采集工作在术前一天进行,用干燥无菌的拭子在手术部位擦拭4次,并标记样本取自瘢痕组(仅取经瘢痕手术部位样本)或是非瘢痕组(仅取正常手术部位样本),随后将标本送常规培养及药敏试验。标本严格按照《全国临床检验操作规程》进行进一步的分离、培养、鉴定,药敏试验同时也参考了CLSI指南[10],采用纸片扩散法操作并判断结果。
1.2.4 统计分析
采用SPSS 19.0软件,用描述性分析方法对患者的基线资料进行描述,用Pearson χ2检验比较瘢痕组和非瘢痕组的术后SSI率,并采用多重回归探究多种危险因素(病人年龄、性别、手术部位、病因等)与细菌定植和药敏结果间的联系。
2 结果
2.1 基线资料
本研究共纳入患者129例,其中男性77例(59.7%),女性 52例(40.3%),平均年龄为 30 岁。63.6%(82/129)的微生物样本取自瘢痕组,其中52.4%(43/82)为增生性瘢痕;其余标本取自非瘢痕组。瘢痕组平均手术时间172.6 min,非瘢痕组平均手术时间 148.8 min,t=1.31,P>0.05。
2.2 SSI结果
4.6 %的病人最终诊断为SSI,瘢痕组SSI为非瘢痕组的2.3倍(4.8%比2.1%),与上文提到的假设一致,也为探究瘢痕组织细菌定植模式提供了支持。
2.3 细菌定植情况
细菌定植状况检测提示,葡萄球菌属在瘢痕组织表面的定植率显著高于正常手术部位。129例患者中44例菌株阴性,85例菌株阳性,包括金葡菌19例(22.3%),表皮葡萄球菌15例(17.6%)。瘢痕组织与非瘢痕组织的细菌定植具有显著差异 (χ2=4.45;P<0.05)。此外,葡萄球菌属在瘢痕组织表面的定植率要远高于正常手术部位(表1)。
2.4 药敏结果
药敏试验检测的抗生素包括青霉素G、氨基青霉素、红霉素、β-内酰胺酶抑制剂、克林霉素、喹诺酮、四环素、糖肽类、磺胺和氨基糖苷类药物。药敏结果表明,葡萄球菌属对青霉素G和红霉素的耐药率较高,进一步的率差(Rate Difference,RD)结果表明,瘢痕组织表面的金黄色葡萄球菌更易产生耐药。表皮葡萄球菌则没有表现出类似的结果。χ2检验结果表明,瘢痕组织与多重耐药性没有明显的相关性(P=0.23)。多重耐药,即至少3类以上抗生素的多个抗生素抗性指标阳性[11](表2)。
2.5 细菌定植危险因素分析
Logistic回归分析结果表明,术前细菌定植状态与几个病因学因素相关度较高,如电击伤(β=20.8,P<0.05)、创伤(β=20.4,P<0.05)和化学物质(β=18.5,P<0.05)。本研究对可能影响体表菌群的人口学特征采用了多重回归进行分析,提示男性更易发生微生物定植。就解剖学位置而言,头部(β=17.9,P<0.05)和颈部(β=20.0,P<0.05)更容易产生细菌定植,尤其容易定植金葡菌。表皮葡萄球菌则更容易定植在躯干部(β=20.0,P<0.05)(表 3-5)。

表1 细菌培养结果Table 1 Culture results of the bacteria spectrum
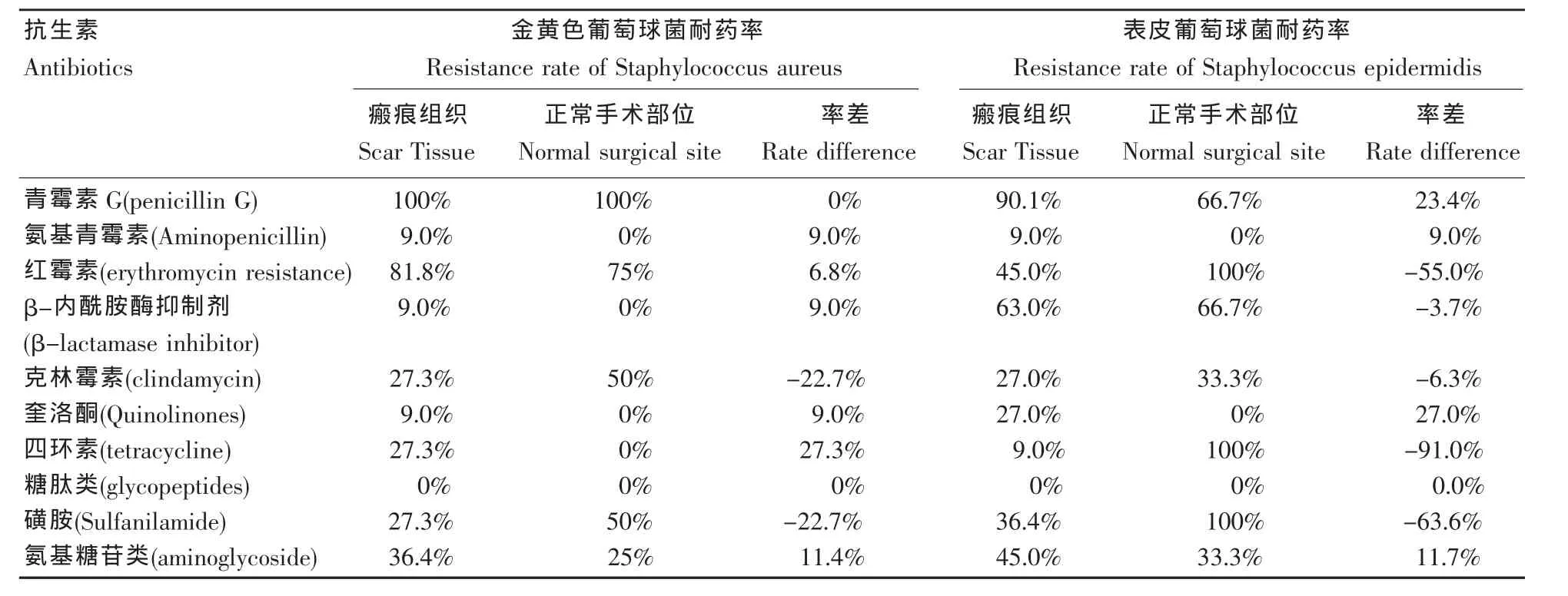
表2 葡萄球菌属主要病原菌耐药率(仅主要病原菌)Table 2 Drug resistance rate of the Staphylococcus spp spectrum(leading pathogens only)
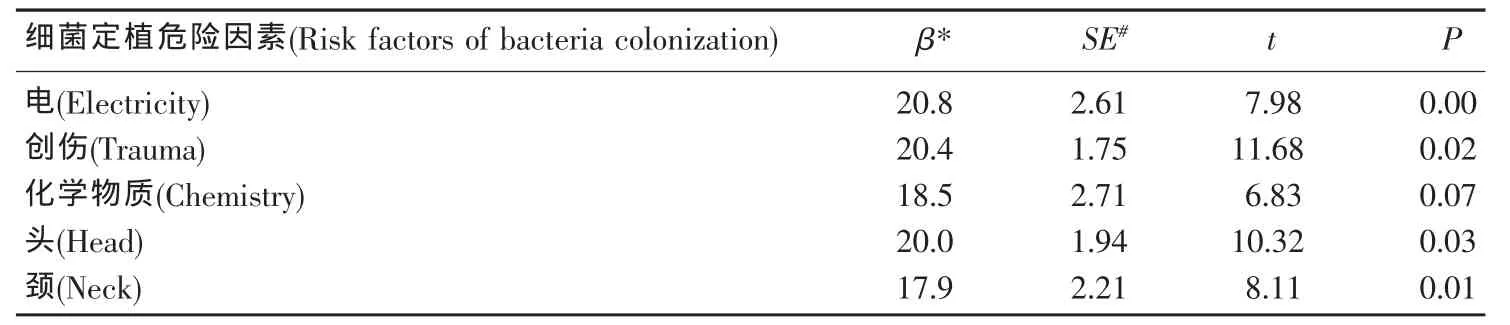
表3 细菌定植危险因素的多重回归Table 3 Multiple regression for risk factors of bacteria colonization

表4 金葡菌定植危险因素的多重回归Table 4 Multiple regression for risk factors of Staphylococcus aureus colonization

表5 表皮葡萄球菌定植危险因素的多重回归Table 5 Multiple regression for risk factors of Staphylococcus epidermidis colonization
3 结论
瘢痕组织定植的细菌显著多于正常手术部位,且耐药率和术后SSI率均高于正常手术部位,瘢痕组织是SSI的独立危险因素,所以涉及瘢痕组织的手术应作更加充分的术前准备和更加彻底的消毒,以减少SSI发生。
4 讨论
本组结果显示,经瘢痕手术切口的感染率是不经瘢痕切口的2.3倍(4.8%比2.1%),表明瘢痕组织比正常手术部位更易发生SSI。有文献认为,皮肤微生物定植状态可能是SSI的独立危险因素[12],并且2%~6%的患者在常规消毒后,于术中仍能检测到术前定植的细菌[13],这些细菌能够直接引起SSI。然而,正常皮肤与瘢痕组织之间细菌携带状况的差异尚不明确。
基于SSI与术前细菌定植状态显著相关的认识,本研究提出假设:瘢痕组织细菌定植状态与正常皮肤之间存在显著差异,从而导致SSI的发生。为探明细菌定植模式,本研究对接受整复手术的患者常规进行了术前微生物样本的采集、培养和药敏试验。
瘢痕组织与非瘢痕组织的细菌定植具有显著统计学差异(χ2=4.45;P<0.05)。其机制可能包括 3个方面:第一,瘢痕组织的物理特性与正常皮肤显著不同,瘢痕组织厚而粗糙的特性不利于彻底消毒;第二,瘢痕组织纤连蛋白的表达增高可能有助于细菌异常定植。研究证实,瘢痕组织、增生性瘢痕和瘢痕疙瘩产生的纤连蛋白和胶原蛋白要多于正常皮肤组织[14]。微生物在皮肤表面的定植依赖纤连蛋白充当黏附点,瘢痕组织中增多的纤连蛋白为微生物提供了有利的黏附环境;第三,烧伤或大面积创伤后,通常需要大量和长期使用抗生素,可能会抑制正常菌群,并增加其他微生物的定植[15]。这些患者通常住院时间较长,这也可能是耐药菌群定植增加的潜在原因。许多研究都已证实,健康个体和住院患者携带的菌群有显著差异[16]。这些因素可能是瘢痕组织表面异常菌落存在的主要原因。
本研究对可能影响体表菌群的人口学特征采用了多重回归进行分析。有证据表明,男性携带微生物的绝对数量和种类通常都高于女性[17-18]。本研究中多变量回归的结果也表明,男性更容易发生微生物定植。就解剖学位置而言,头颈部更容易产生细菌定植。作为身体的暴露部位,头颈部携带有更高比例的微生物,并且细菌的密度更高[19]。这一发现表明,当手术涉及头颈部瘢痕时,重复和彻底的消毒是极为必要的。
本研究存在以下局限。对手术涉及瘢痕修整或瘢痕切开的患者,应该进行术中微生物的采样检测,对发生SSI的患者也应该进行采样,以确认细菌种类的一致性。尽管已经有文献证实,术前定植的细菌类型通常与术后感染部位中分离的一致,但详细而完整的证据链仍须在未来的多中心研究中进一步完善。菌种的鉴定也应考虑引入PCR等技术。在未来的多中心研究中,我们将着力解决这些问题,并增大样本量,以增强本研究的证据强度。
需要注意的是,影响SSI发生的混杂因素众多,也是影响细菌定植的危险因素。严格的配对设计能够排除这些因素的干扰,但随着配对因素的增加,所需的样本量也将随之显著增多。本研究明确了多种危险因素对细菌定植的贡献度,这一结果能够在未来的多中心研究中帮助筛选有意义的配对因素,增强配对的可行性,同时也保证了进一步研究的科学性。
本研究的主要发现是瘢痕组织比正常皮肤组织更容易定植耐药菌,从而导致术后感染。这个结果提示,涉及瘢痕组织的手术需要更充分的术前准备和更彻底的消毒。未来的研究将着力探究彻底根除瘢痕组织细菌定植对接受瘢痕修整和切开手术的患的潜在收益。
[1] Kurz A,Sessler DI,Lenhardt R.Study of wound infections and temperature group:Perioperative normothermia to reduce the incidence of surgical-wound infection and shorten hospitalization[J].N Engl J Med,1996,334(19):1209-1215.
[2] Greif R,Akca O,Horn EP,et al.Supplemental perioperative oxygen to reduce the incidence of surgical-wound infection[J].N Engl J Med,2000,342(3):161-167.
[3] Gaynes RP,Culver DH,Horan TC,et al.Surgical site infection(SSI)rates in the United States,1992-1998:the National Nosocomial Infections Surveillance System basic SSI risk index[J].Clin Infect Dis,2001,33(Suppl 2):S69-S77.
[4] Swenson BR,Hollenbeak CS,Koltun WA.Hospital costs and risk factors associated with complications of the ileal pouch anal anastomosis[J].Surgery,2002,132(4):767-774.
[5] Bode LG,Kluytmans JA,Wertheim HF,et al.Preventing surgicalsite infections in nasal carriers of Staphylococcus aureus[J].N Engl J Med,2010,362(1):9-17.
[6] Nouwen J,Schouten J,Schneebergen P,et al.Staphylococcus aureus carriage patterns and the risk of infections associated with continuous peritoneal dialysis[J].J Clin Microbiol,2006,44(6):2233-2236.
[7] Mangram AJ,Horan TC,Pearson ML,et al.Guideline for prevention of surgical site infection,1999[J].Am J Infect Control,1999,27(2):97-134.
[8] Kluytmans J,van Belkum A,Verbrugh H.Nasal carriage of Staphylococcus aureus:epidemiology,underlying mechanisms,and associated risks[J].Clin Microbiol Rev,1997,10(3):505-520.
[9] Pignatari A,Pfaller M,Hollis R,et al.Staphylococcus aureus colonization and infection in patients on continuous ambulatory peritoneal dialysis[J].J Clin Microbiol,1990,28(9):1898-1902.
[10] CCAL Institute.Performance Standards for antimicrobial susceptibility testing;twentieth informational supplement[S].CLSI Document M100-S20,2010.
[11] Zulkifli Y,Alitheen NB,Raha AR,et al.Antibiotic resistance and plasmid profiling of Vibrio parahaemolyticus isolated from cockles in Padang[J].Indonesia Intl Food Res J,2009,16:53-58.
[12] Davidson AE,Clark C,Smith G.Postoperative wound infection:a computer analysis[J].Br J Surg,1971,58(5):333-337.
[13] Nakayama H,Yagi M,Yoshiya S,et al.Micro-organism colonization and intraoperative contamination in patients undergoing arthroscopic anterior cruciate ligament reconstruction[J].Arthroscopy,2012,28(5):667-671.
[14] Kischer CW,Wagner HN Jr,Pindur J,et al.Increased fibronectin production by cell lines from hypertrophic scar and keloid[J].Connect Tissue Res,1989,23(4):279-288.
[15] Eisenstein BI,Ofek I,Beachey EH.Interference with the mannose binding and epithelial cell adherence of Escherichia coli by sublethal concentrations of streptomycin[J].J Clin Invest,1979,63(6):1219-1228.
[16] Barth JH.Nasal carriage of staphylococci and streptococci[J].Int J Dermatol,1987,26(1):24-26.
[17] Marples RR.Sex,constancy,and skin bacteria[J].Arch Dermatol Res,1982,272(3):317-320.
[18] Noble WC,Pitcher DG.Microbial ecology of the human skin[J].Adv Microb Ecol,1978,2:245-489.
[19] Roth RR,James WD.Microbial ecology of the skin[J].Ann Rev Microbiol,1988,42(1):441-464.

