表达hTERT的大鼠骨髓间充质干细胞生物学特性研究
马迪 严佶祺 彭承宏 施敏敏 陈雪华 王维杰 李宏为
研究表明,骨髓间充质干细胞 (Bone marrow mesenchymal stem cells,BMSCs)已成为组织工程以及细胞移植治疗中的重要种子细胞,具有广阔的应用前景[1-2]。但是,由于Hayflick界限的存在,BMSCs会随着细胞的分裂出现衰老现象,严重影响其在组织工程及细胞移植治疗领域的作用。
随着对人端粒酶逆转录酶 (Human telomerase reverse transcriptase,hTERT)的深入研究,导入外源性的hTERT可使细胞的增殖能力、抗衰老能力得到增强,甚至获得永生化的能力[3]。将本研究前期已成功构建并包装获得的含hTERT的重组慢病毒液[4],感染大鼠BMSCs,观察细胞体外增殖分裂情况及其多向分化潜能,为组织工程及细胞移植治疗建立稳定的种子细胞储备。
1 材料与方法
1.1 主要试剂与仪器
P3大鼠BMSCs(上海消化外科研究所提供);10%FBS、L-DMEM细胞培养基 (美国Gibco公司);PBS(生工生物工程股份有限公司);PE标记CD29抗大鼠抗体、CD90抗大鼠抗体 (美国BD公司);PE标记CD34抗大鼠抗体 (美国Santa Cruz公司);PE标记CD45抗大鼠抗体(美国Biolegend公司);成脂诱导分化试剂盒、成骨诱导分化试剂盒(广州赛业生物科技有限公司);Trizol(美国Life Technologies公司);ReverTra Ace QPCR RT Kit、SYBR Green Realtime PCR Master Mix(日本 TOYOBO公司);polybrene(美国 Sigma 公司)。
台式离心机5810R (德国Eppendorf公司);倒置荧光显微镜 IX-71(日本 Olympus公司);BD FACS Calibur流式细胞仪 (美国BD公司);定量PCR仪(瑞士Roche公司);全光谱微孔板分光光度计(美国BIOTEK公司)。
1.2 实验方法
1.2.1 重组病毒液感染大鼠BMSCs
参照文献[4]方法,构建并获取含hTERT基因的重组慢病毒液,胰酶消化并调整大鼠BMSCs密度为2×104个/孔,加入24孔板,培养24 h后进行病毒感染。一个24孔板内按照每孔10 μL加入重组慢病毒液,另一个24孔板每孔加入空病毒10 μL,于各孔内分别加入polybrene,并调整终浓度为8 μg/mL,同时设置未感染组,分别命名为MSC-hTERT组、MSC-GFP组和MSC组,继续培养箱内培养。感染24 h后更换为含血清完全培养液,待荧光表达稳定后常规消化收集MSC-hTERT组及MSC-GFP组细胞,转入6孔板内继续体外增殖培养;同时,收集MSC组细胞,转入6孔板内同期体外增殖培养,观察各组荧光表达情况、细胞形态和传代情况。
1.2.2 hTERT基因mRNA水平的表达
收集各组细胞,分别加入Trizol,抽提总RNA,调整RNA浓度为0.5 μg/μL,按照 ReverTra Ace qPCR RT Kit说明书进行逆转录反应。根据hTERT的基因序列 (NM_198253.2),设计引物。F:5'GAGAACAAGCTGTTTGCGGG3';R:5'AAGTTCACCACGCAGCCATA3'。
收集各组细胞cDNA,按照SYBR Green Realtime PCR Master Mix说明配置反应体系,并进行Real-Time PCR检测目的基因的mRNA表达,以2-△Ct作为基因表达量,分析各组目的基因的表达情况。
1.2.3 MSC-hTERT组细胞周期的检测
取对数生长期的MSC-hTERT及MSC组细胞,常规胰酶消化收集,4℃离心后弃去上清,PBS适度吹打重悬。加入-20℃预冷的75%乙醇,吹打均匀,制成单细胞悬液,4℃固定24 h;隔日1 000 r/min离心5 min后弃去上清,PBS漂洗,适度吹打重悬,加入PI和RNA酶,并调节PI终浓度为20 μg/mL,RNA 酶终浓度为 50 μg/mL,37 ℃孵育 30 min,流式细胞仪检测分析细胞周期,并利用自带软件进行数据分析。
1.2.4 MSC-hTERT组细胞表型的鉴定
取对数生长期的MSC-hTERT组细胞,消化、离心后, 进行 CD29、CD34、CD45、CD90 抗体标记,流式细胞仪检测细胞表型。
1.2.5 MSC-hTERT的成脂诱导及检测
胰酶消化对数生长期的MSC-hTERT组细胞,设置诱导组及对照组,诱导组按照成脂诱导试剂盒说明书添加诱导液进行成脂诱导,对照组添加含10%FBS的L-DMEM培养液。待细胞内脂滴出现后进行油红O染色,显微镜下观察,鉴定其成脂分化能力。
1.2.6 MSC-hTERT的成骨诱导及检测
胰酶消化对数生长期的MSC-hTERT组细胞,设置诱导组及对照组,诱导组按照成骨诱导试剂盒说明书添加诱导液进行成骨诱导,对照组添加含10%FBS的L-DMEM培养液,诱导3周后进行茜素红染色,显微镜下观察,鉴定其成骨分化能力。
1.2.7 统计学分析
采用SPSS16.0统计软件分析,计量资料以均数±标准差表示,组间比较采用t检验,两组以上采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 MSC-hTERT组细胞荧光检测结果
感染重组慢病毒液后72 h,在荧光显微镜下及倒置相差显微镜下,观察细胞形态和荧光表达情况,荧光表达率约为75%。光镜下观察发现,细胞仍保持长梭形外观和贴壁能力(图1)。
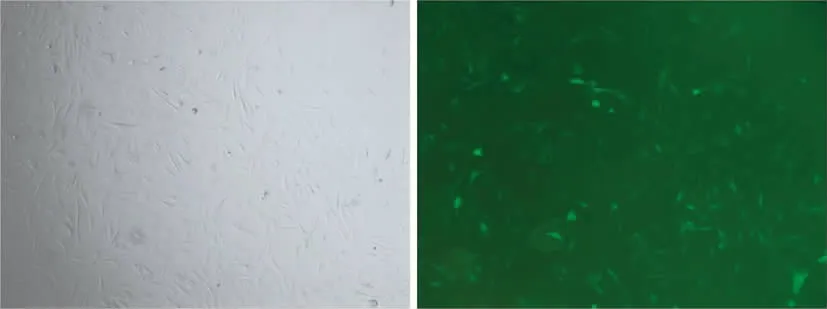
图1 重组慢病毒液感染后大鼠BMSCs(左:光学显微镜,40×;右:荧光显微镜, 40×)Fig.1 Morphological observation of rat BMSCs infected by recombinant virus supernatant.(Left:Light microscope,40×;Right:Fluorescence microscope,40×)
2.2 Real-Time PCR检测hTERT基因的表达
MSC-hTERT组的hTERT基因mRNA表达明显高于MSC组和MSC-GFP组,差异显著(P<0.05)。MSC组与MSC-GFP组hTERT基因表达量无明显差异(P>0.05)(图 2)。
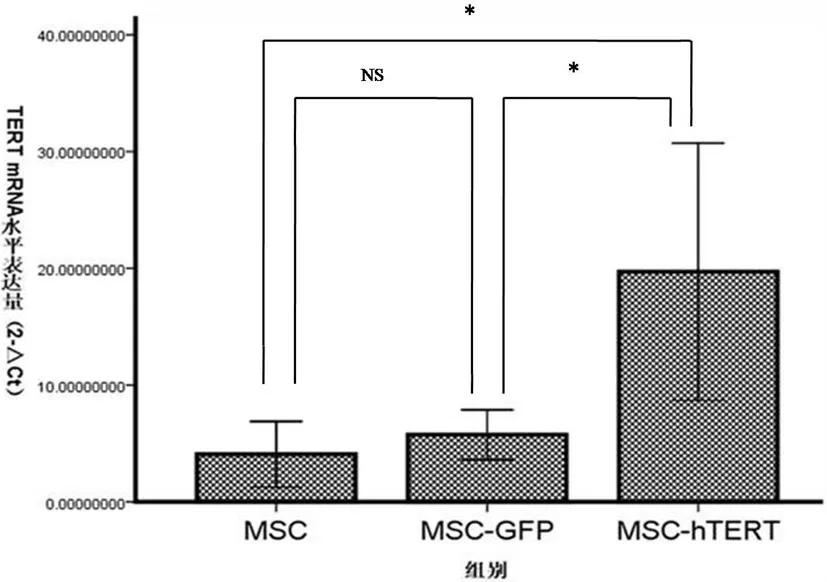
图2 各组hTERT基因的mRNA相对表达量Fig.2 The relative expression of hTERT mRNA in three groups
2.3 MSC-hTERT细胞周期检测及体外传代观察
采用流式细胞仪进行细胞周期的检测,比较MSC组及MSC-hTERT组细胞周期检测结果,显示MSC-hTERT组细胞G2期和S期细胞,较MSC组明显增多,增殖指数明显上升,分裂增殖潜力提升。体外传代观察发现,MSC-hTERT组细胞传代次数增多,细胞寿命较MSC组延长,且细胞形态得到较好保持(图 3)。
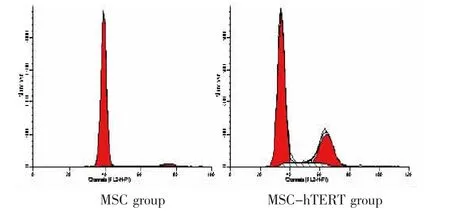
图3 MSC组及MSC-hTERT组细胞周期检测Fig.3 Cell cycle analysis of MSC group and MSC-hTERT group
2.4 MSC-hTERT组细胞表型检测
MSC-hTERT组CD29及CD90的阳性表达率分别高达99.83%和99.53%,而CD34及CD45的阳性表达率仅为0.05%和0.13%(图4)。

图4 MSC-hTERT组细胞表型的流式细胞仪检测结果Fig.4 The expression of surface markers in MSC-hTERT group detected by FCM
2.5 MSC-hTERT组分化潜能检测
通过成脂、成骨诱导以及特异性染色检测,MSC-hTERT组细胞仍然保持了多向分化潜能,在特异性诱导剂的作用下,可向脂肪细胞以及成骨细胞方向转化,而对照组均未见阳性染色结果(图5)。
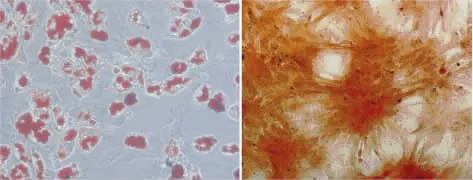
图5 MSC-hTERT组细胞成脂及成骨分化诱导结果(左:油红O 染色, 200×;右:茜素红染色, 200×)Fig.5 Histological observation of cells in MSC-hTERT groups after adipogenic and osteogenic induction(Oil red O staining,200×;Alizarin red staining of group,200×)
3 讨论
BMSCs具有很强的自我增殖能力,且能分泌很多细胞因子,经诱导可向成骨细胞、脂肪细胞、神经样细胞[5]、血管内皮细胞[6]等分化,并行使相应功能,但由于缺乏端粒酶活性,其生存时间以及分化能力会随着细胞的增殖分裂而受到影响。hTERT决定着人端粒酶的活性。研究表明,转入外源性的hTERT可以提高细胞端粒酶活性[7],使细胞增殖分裂能力增强,甚至可使细胞永生化。因此,通过外源性转入hTERT基因,恢复或者增加细胞的端粒酶活性,构建稳定表达hTERT的细胞系,对于维持BMSCs的分化增殖能力、延长寿命提供了新的方向,有望为组织工程和细胞移植治疗储备具有旺盛增殖能力的种子细胞。
本研究运用前期实验获得的重组慢病毒液和空病毒液,分别感染大鼠BMSCs,发现MSC-hTERT组能稳定表达绿色荧光,并且其hTERT基因的mRNA表达明显高于MSC组及MSC-GFP组,差异具有统计学意义(P<0.05);而在细胞周期的检测中,MSC-hTERT组的细胞增殖指数相较于MSC组有明显上升,提示具有复制潜力和分裂能力的细胞明显增多;而体外传代次数的增加,以及细胞形态能够在较长时间内保持原有特征等结果,也提示了异位表达hTERT能够上调细胞周期,通过DNA修复基因,使得细胞具有绕过危机期、延长寿命的能力[8]。
实验中所选用的细胞是否保持其原有生物学特性对于实验结果具有重要意义,由于不具备特异性表面标记分子,对MSCs的直接鉴定通常存在一定困难[9],本实验对MSC-hTERT组细胞进行了细胞形态、细胞表面标记物及定向分化能力的检测,结果显示MSC-hTERT组细胞仍能保持长梭形外观,并能够表现出BMSCs特有的贴壁能力,同时高表达CD29及CD90,低表达CD34及CD45,符合骨髓源性间充质干细胞的特性。在定向分化研究中,转染hTERT的BMSCs在诱导因子作用下能够显示出向骨细胞以及脂肪细胞分化的特性,提示MSC-hTERT具有与原代培养BMSCs相同的体外分化潜能。
本研究利用慢病毒载体将hTERT基因成功导入大鼠BMSCs并成功构建MSC-hTERT,细胞的增殖分裂能力得到明显加强,且仍然保持与BMSCs相同的生物学特性,可为组织工程研究及细胞移植治疗提供可靠的种子细胞。
虽然hTERT介导的永生化细胞系成瘤风险更低,但是基因改造后细胞可能存在的潜在致瘤性还是不容忽视的。已有研究提示,端粒酶活性已成为肿瘤检测的一个新标志[10],同时异常表达的hTERT与多项肿瘤成正相关[11-12]。因此,转染hTERT的大鼠BMSCs的成瘤风险评估,以及相关体内实验,是进一步研究的重点。
[1] 李佳滨,张文杰,崔福斋,等.P17-BMP2多肽促进大鼠骨髓间充质干细胞成骨分化的实验研究[J].组织工程与重建外科杂志,2012,8(2):65-68.
[2] 马迪,严佶祺,张明钧,等.骨髓间充质干细胞促进大鼠小体积肝移植后肝再生的实验研究[J].肝胆外科杂志,2012,20(4):301-303,316.
[3] Yuan J,Yang BM,Zhong ZH,et a1.Upregulation of survivin during immortalization ofnontransformed human fibroblasts transduced with telomerase reverse transcriptase[J].Oncogene,2009,28(29):2678-2689.
[4] 马迪,严佶祺,彭承宏,等.构建携带hTERT基因的慢病毒重组载体及其包装和表达[J].组织工程与重建外科,2013,9(2):85-88.
[5] Wang Y,Deng Z,Lai X,et al.Differentiation of human bone marrow stromal cells into neural-like cells induced by sodium ferulate in vitro[J].Cell Mol Immunol,2005,2(3):225-229.
[6] 方利君.骨髓间充质干细胞分化为血管内皮细胞的实验研究[J].中华烧伤杂志,2003,19(1):22-24.
[7] Li NF,Broad S,Lu YJ,et a1.Human ovarian surface epithelial cells immortalized with hTERT maintain functional pRb and p53 expression[J].Cell Prolif,2007,40(5):780-794.
[8] Liu TM,Ng WM,Tan HS,et al.Molecular basis of immortalization of human mesenchymal stem cells by combination of p53 knockdown and human telomerase reverse transcriptase overexpression[J].Stem Cells Dev,2013,22(2):268-278.
[9] Dominici M,Le BK,Mueller I,et al.POSITION PAPER:Minimal criteria for defining multipotent mesenchymal stromal cells.The International Society for Celluar Therapy position statement[J].Cytotherapy,2006,8(4):315-317.
[10] Bzarov AV,Hines WC,Mukhopadhyay R,et al.Telomerase activation by c-Myc in human mammary epithelial cells requires additional genomic changes[J].Cell Cycle,2009,8(20):3373-3378.
[11] 张业伟,牛坚,赵何伟,等.干细胞表面标志物CD90及端粒酶逆转录酶在原发性肝癌中的表达及临床意义[J].中华肝胆外科杂志,2012,18(1):37-39.
[12] Le S,Zhu JJ,Anthony DC,et al.Telomerase activity in human gliomas[J].Neurosurgery,1998,42(5):1120-1124.

