挤压组织化对小麦面筋蛋白结构影响的研究
马 宁 朱科学 郭晓娜 彭 伟 周惠明
(江南大学食品学院,无锡 214122)
近年来,由于禽流感、口蹄疫等动物疾病的发生和宗教信仰、素食主义等原因,替代肉制品越来越受到人们的重视。组织化植物蛋白(TVP)以植物蛋白为原料,经挤压加工得到。TVP蛋白质含量高(一般高于56%,干基),无胆固醇,复水后具有肉类的纤维结构和咀嚼感,是一种理想的肉类替代品[1]。
作为TVP的主要成分,蛋白质的变化及蛋白质-蛋白质之间的相互作用是TVP组织化得以形成的关键,也是挤压植物蛋白组织化机理研究的主要内容和焦点。前人的研究多集中在对大豆蛋白和花生蛋白的探讨上,研究表明,不同挤压原料、操作参数下得到的研究结果有很大出入[2]。本试验以谷朊粉为主要原料,系统研究了小麦面筋蛋白在挤压过程中的变化及挤压过程中蛋白质-蛋白质之间的作用,为制备高质量的TWP提供理论基础。
1 材料与方法
1.1 试验材料
谷朊粉:安徽古井集团,蛋白质质量分数76.2%,干基;小麦粉:安徽瑞福祥食品有限公司,蛋白质质量分数12.1%,干基。
1.2 仪器和设备
DYY-Ⅲ23A型电泳槽:北京六一仪器厂;Nexus智能傅立叶红外光谱仪:美国Thermo Nicolet公司;Agilent1100液相色谱仪:美国安捷伦公司;UV-2800型紫外分光光度计:尤尼柯上海仪器制造公司。
1.3 试验方法
1.3.1 小麦面筋蛋白挤压试验
挤压试验在布勒中国无锡挤压实验室完成,挤压机型号CAMPACtwinTM62,螺杆直径62 mm,长径比20∶1。喂料速度:150 kg/h;调制器用水温度:常温;挤压机Ⅱ区、Ⅲ区、Ⅴ区的温度分别为155℃、155℃、175℃;物料含水量:24.0%(以物料100%计);螺杆转速:400 r/min;模孔尺寸:2 mm×56 mm;小麦粉质量分数:7.0%,谷朊粉质量分数93.0%。
1.3.2 小麦面筋蛋白挤压前后亚基变化
采用SDS-PAGE法分析小麦面筋蛋白挤压前后亚基的变化[3]。
选用10%分离胶,4%浓缩胶,考马斯亮蓝G-250染色。上样液的配制:精确称取10.3 mg的样品溶解于1 mL的上样缓冲液中,离心(16 000×g,10 min)取上清液。还原和非还原的SDS-PAGE的区别在于加与不加β-巯基乙醇(2-ME)。采用兔磷酸化酶B(97 400 u)、牛血清白蛋白(66 200 u)、兔肌动蛋白(43 000 u)、牛碳酸酐酶(31 000 u)、胰蛋白酶抑制剂(20 100 u)、鸡蛋清溶菌酶(14 400 u)作为相对分子量标准。
1.3.3 小麦面筋蛋白挤压前后溶解度试验及化学交联键分析
参照 Prudencio-Ferreira等[4]的方法,利用蛋白质在不同裂解液中溶解度的不同分析蛋白质-蛋白质的交联方式。
浸提溶液:A、pH7.6,0.035 mol/L 磷酸盐缓冲液;B、pH7.6 ,A+0.015 g/mL SDS;C、pH7.6,A+0.1 mol/L 2 - ME;D、A+pH7.6,0.015 g/mLSDS+0.1 mol/L 2 -ME。
蛋白质浸提:原料(WG)和挤压样品(TWP)冷冻干燥后粉碎备用。称取冷冻干燥后的待测样0.500 g左右,分别加入10 mL上述不同浸提液中,在恒温水浴振荡器中室温浸提2 h,离心(16 000×g,10 min)后取上清液。沉淀中再分别加入10 mL上述浸提液,重复浸提,离心。合并两次上清液于50 mL容量瓶中,定容,得样品蛋白质浸提溶液。蛋白质含量用改良后微量凯氏定氮法测定。试验重复2次。
蛋白质溶解度=[上清液中蛋白质(g)/样品中蛋白质(g)]×100%
化学交联键分析:参考 Hanger[5]的方法。①天然状态蛋白质,即溶解于pH7.6磷酸盐缓冲液中的蛋白质;②以非共价键结合的蛋白质=溶于B-溶于A;③以共价键结合的蛋白质=溶于C-溶于A;④以二硫键和非共价键交互作用结合的蛋白质=溶于D-溶于B-溶于C+溶于A。
1.3.4 小麦面筋蛋白挤压前后游离巯基的变化
采用 DTNB 的方法测定[6-7]。称取240 mg左右的样品加到10 mL5 mol/L pH 8.0盐酸胍/Tris-Gly溶液中,磁力搅拌 10 min,离心(5 000×g,30 min),分别取5 mL盐酸胍/Tris-Gly和1.5 mL 1×10-3mol/L DTNB,将上述两种溶液分别加入到3 mL上清液中。混合液在25℃恒温水浴10 min后,在412 nm处测定吸光值。考马斯亮蓝法测定蛋白浓度。
游离巯基(μmol/g蛋白质)=(73.53×A412×D)/c
式中:73.53=106/13 600,D 为稀释倍数(取值为9.5/3),c为样品中蛋白质质量浓度/g/L。
1.3.5 小麦面筋蛋白挤压前后半胱氨酸分析[8]
称取120 mg的样品与10 mL水解管中,加入5 mL 6 mol/L的盐酸溶液酸水解,充氮封管,110℃下水解24 h。切开封管,洗涤定容至10 mL容量瓶中。抽干后,采用邻苯二甲醛OPA柱前自动衍生,上Agilent1100液相色谱仪进行氨基酸组成分析。
1.3.6 小麦面筋蛋白挤压前后二级结构的变化
采用傅里叶红外光谱测定挤压前后小麦面筋蛋白质的二级结构[9]。
样品用研钵研碎,37℃真空干燥。取少量样品与溴化钾混合,放入玛瑙研钵中,红外灯下研磨10 min。10 kg压力下压制成厚薄均匀、呈半透明状的薄片。将压制好的薄片放入红外光谱仪中扫描,得到样品的傅里叶红外光谱图。测试前,先测空白背景图。在 OmnicV6.2软件内扣除背景后,采用peakfitV4.2软件进行相应的图谱处理分析。
1.4 试验数据统计与分析
利用 Excel对数据进行整理和绘图。使用SPSS16.0软件对数据进行方差分析,选取Duncan测试,在P<0.05检验水平对数据进行统计学分析。
2 结果与讨论
2.1 挤压组织化对小麦面筋蛋白亚基的影响
从图1非还原SDS-PAGE可以得知,与原料Y2有多个亚基条带相比,J2样品中几乎观察不到亚基条带,仅在20 100 u和14 400 u有颜色较浅的条带出现,且泳道上方也未见蛋白质聚集体,表明没有出现溶出的蛋白未进入分离胶的情况。Anderson等[10]在研究面粉挤压前后的变化时,也得出相同结果。结合非还原的SDS-PAGE溶解液中只添加了SDS,无β-巯基乙醇,样品中只有以非共价键结合的蛋白质发生裂解,溶于样品溶解液中。可以推断:挤压过程中,大量的小麦面筋蛋白亚基以共价键的连接形式发生了交联,进而导致挤压组织化的样品并未被裂解溶于样品溶解液中,故J2中无明显条带出现。

图1 小麦面筋蛋白挤压前后SDS-PAGE电泳图
对比还原SDS-PAGE电泳图可以发现:J1样品电泳条带中,97 400~14 400 u之间各亚基条带颜色明显变浅,高分子质量蛋白区(97 400~47 000 u)颜色变浅尤为明显,但依然可以看出并未有条带消失。且未出现新的亚基条带,在大于97 400 u的位置和浓缩胶顶端出现了颜色较深的条带。结合以上现象可以得出:小麦面筋蛋白经挤压组织化后,并未发生亚基的裂解,而是发生聚合、交联等变性反应,生成分子质量较大的聚合物。这些聚合物中较大分子质量的不能透过浓缩胶进入分离胶,较小的则透过浓缩胶,在分离胶的顶端发生聚集[11]。且这些聚合物可能是以酰胺键的形式结合,因为还原性的SDSPAGE溶解液中含有SDS和β-巯基乙醇,可同时将非共价键和二硫键裂解。
2.2 挤压组织化对小麦面筋蛋白溶解度及化学交联键的影响
构成蛋白质高级结构的力的作用类型是多样的、复杂的,常见的有二硫键(共价键)、氢键、疏水作用、离子键、静电作用等其他非共价键。2-ME和SDS可以分别破坏蛋白质分子之间的二硫键和非共价键(主要是疏水作用和氢键),利用样品在不同化学键破坏溶剂中的溶解度的不同,可分析样品蛋白质之间力的作用类型和重要性[12]。

表1 挤压组织化对小麦面筋蛋白溶解度的影响
由表1可知,挤压组织化后,TWP在A(磷酸盐缓冲液)中的溶解度变化不显著(P>0.05),在 B(SDS)和、C(2-ME)、D(SDS+2-ME)溶液中的溶解度均显著下降(P<0.05)。
为了更直观的分析各交联键对维持蛋白质结构的贡献,将样品在不同裂解液中的溶解度转换为化学键的形式[4],如表2所示。

表2 不同结合状态小麦面筋蛋白的溶解度/%
从表2可知,维持原料小麦面筋蛋白之间交联的贡献大小依次是非共价键>二硫键和非共价键交互>天然状态>二硫键,挤压组织化之后,蛋白质之间的作用力依次是二硫键和非共价键交互>非共价键>天然状态>二硫键。可以推断,在挤压过程中,有少量的非共价键出现断裂,同时二硫键大量生成;维持TWP的主要化学键并不是某种单一的化学作用力,而是二硫键和非共价键之间的交互作用。
Liu等[13]分析了大豆蛋白在挤压过程中蛋白质-蛋白质之间的作用,结果发现:挤压过程中有大量的二硫键形成,非共价键并未有显著改变,二硫键对组织化蛋白纤维结构的形成起最重要作用;Cheftel[14]也指出,影响挤压组织化产品的化学键应该是共价键,因为在150℃、高剪切作用下,氢键、疏水键和静电作用可能会打破。但张汆[15]通过研究挤压花生蛋白认为:非共价键结合(疏水作用和氢键)作用是影响组织化结构的主要化学键,其次才是二硫键。不同研究结果可能是由于挤压机、挤压原料、挤压条件不同所致。为了更直观的探讨二硫键在挤压过程中的变化,我们对小麦蛋白挤压组织化前后游离巯基和半胱氨酸的含量进行了分析。
从表1中还可以发现:小麦面筋蛋白和TWP在D溶液中的溶解度分别为95.73%和84.67%。这说明,在小麦面筋蛋白和TWP中,还分别有15%、5%左右的蛋白质之间的交联键并未被SDS和2-ME打破,且挤压组织化之后,这部分蛋白显著的增加。这可能是由于:①SDS和2-ME并不能打破所有的非共价键和二硫键,尤其是种类较多的非共价键。未溶解的蛋白可能是以离子键、静电作用等其他SDS不能打破的非共价键的方式交联;②SDS和2-ME打破非共价键和二硫键的能力不足以完全破坏小麦面筋蛋白和TWP中的非共价键和二硫键,从而使蛋白质并未被完全浸提出。具体的原因还需进一步的研究探讨。
2.3 挤压组织化对小麦面筋蛋白游离巯基及半胱氨酸含量的影响
从表3可知,挤压组织化之后,小麦面筋蛋白中游离巯基含量显著的减少(P <0.05)。Li等[16]认为,挤压后游离巯基的减少可以说明小麦面筋蛋白在挤压过程中发生了变性,并通过分子间二硫键聚合。游离巯基减少通常伴随着二硫键的增加,一般学者认为这是由于巯基发生氧化所致。Anderson等[10]则认为,在挤压过程,巯基的减少还有可能是由于高剪切和热的作用。

表3 挤压组织化对小麦面筋蛋白中游离巯基的影响
小麦面筋蛋白中含硫氨基酸——半胱氨酸含量挤压过后减少了32%。半胱氨酸的减少可能是两个原因所致:半胱氨酸的巯基发生氧化,形成二硫键;半胱氨酸也可能与其他物质结合,生成具有挤压风味的挥发性有机物。但目前还未有研究结果可以支持后者[17]。因此,可以得出,小麦面筋蛋白在挤压组织化过程中,减少的半胱氨酸发生了氧化,生成二硫键。
2.4 挤压组织化对小麦面筋蛋白二级结构的影响
从图2可知,小麦面筋蛋白经挤压组织化后,α-螺旋、无规则卷曲、β-折叠均有所减少,其中α-螺旋减少了33%,最为剧烈。β-转角增加了73%。这可能是因为:α-螺旋在蛋白质二级结构中是最不稳定的结构[18]。因此,在挤压过程中,α-螺旋首先转化为较稳定的转角结构,但并未完全发生转变,仍保留部分α-螺旋。少量的无规卷曲和β-折叠也转变为β-转角。由此可见,挤压组织化过程中,蛋白质的二级结构并未被完全破坏,只是发生了由部分不稳定结构向稳定构象的转变。
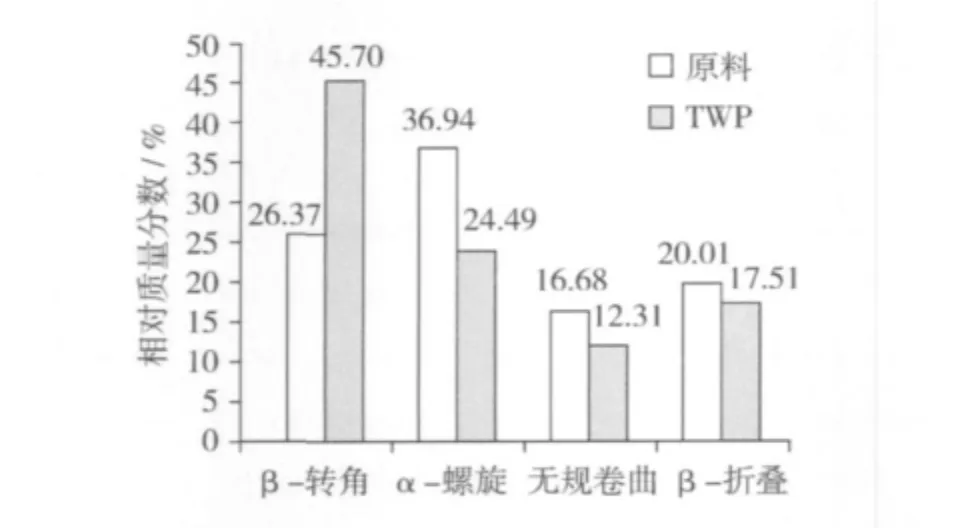
图2 谷朊粉挤压前后蛋白质二级结构的变化
前人对挤压植物蛋白组织化的二级结构研究很少,而且主要集中在大豆蛋白的研究。康立宁[9]认为,挤压大豆蛋白组织化时,β-折叠几乎保持不变,α-螺旋已完全转化为转角,无规卷曲也有所增加。且他指出,可将α-螺旋是否完全发生转化作为大豆蛋白是否完全组织化的微观标准。与本试验结果比较,有一定的相同点,如转角结构的增加和α-螺旋的减少,但并不完全相同。这可能与原料、挤压机、操作参数的不同所引起。综上所述,植物蛋白组织化过程中,蛋白质二级结构的变化是否有一定的共性,是否可以从二级结构的变化来判断组织化的形成及程度仍需要进一步的系统研究。
3 结论
3.1 综合小麦面筋蛋白挤压组织化前后 SDSPAGE、溶解度变化、游离巯基变化及半胱氨酸的变化可知,挤压组织化过程中,有大量二硫键生成,非共价键几乎不变。
3.2 维持TWP蛋白质之间的力主要是二硫键和非共价键的交互作用,以单一的非共价键和二硫键结合在一起的蛋白质仅占12.81%和0.91%。
3.3 挤压组织化并未完全破坏小麦面筋蛋白的的二级结构,其中的α-螺旋、无规则卷曲、β-折叠向稳定的β-转角转变。目前的研究还不能从二级结构的变化来判断组织化是否形成及形成程度。
[1]Asgar M A,Fazilah A,Huda N,et al.Nonmeat protein alternatives as meat extenders and meat analogs[J].Comprehensive Reviews in Food Science and Food Safety,2010,9(5):513-529
[2]Chen F L.Chemical Cross- Linking and Molecular Aggregation of Soybean Protein During Extrusion Cooking at Low and High Moisture Content[J].Food Science and Technology,2011,44(4):957 -962
[3]Pogna N E,Autran JC,Mellini F,et al.Chromosome1B - encoded gliadins and glutenin subunits in durum wheat:Genetics and relationship to gluten strength[J].Journal of Cereal Science,1990,11(1):15 -34
[4]Prudencio-Ferreira SH,Areas J A G.Protein-Protein Interactions in the Extrusion of Soya at Various Temperatures and Moisture Contents[J].Journal of Food Science,1993,58(2):378-381
[5]Hanger D F.Effect of extrusion upon soy concentrate solubility[J].Journal of Agriculture and Food Chemistry,1984,32(2):293-296
[6]Fischer T.Effect of extrusion cooking on protein modification in wheat flour[J].European Food Research and Technology,2004,218(2):128 -132
[7]李慧静,田益玲,李宁,等.转谷氨酰胺酶对小麦面粉加工品质的影响研究[J].农业工程学报,2008,24(02):232-236
[8]Koh BK,Lim ST.Effect of Hydroquinone on Wheat Gluten[J].Food Science and Biotech - Nology,2000.9(6):341 -345
[9]康立宁.大豆蛋白高水分挤压组织化技术和机理研究[D].杨凌:西北农林科技大学,2007
[10]Anderson A K,Ng P K W.Changes in disulfide and sulfhydryl contents and electrophoretic patterns of extruded wheat flour proteins[J].Cereal Chemistry,2000,77(3):354-359
[11]陈锋亮.植物蛋白挤压组织化过程中水分的作用[D].北京:中国农业科学院,2010
[12]Liu K S,Hsieh Fu - Hung.Protein - Protein Interactions in High Moisture-Extruded Meat Analogs and Heat-Induced Soy Protein Gels[J].Journal of The American Oil Chemistry’Society,2007(84):741 -748
[13]Liu K S,Hsieh F H.Protein - Protein Interactions during High-Moisture Extrusion for Fibrous Meat Analogues and Comparison of Protein Solubility Methods Using Different Solvent System [J].Journal of Agricultural and Food Chemistry ,2008,56(3):2681 -2687
[14]Cheftel J C.New Protein Texturization Processes by Extrusion Cooking at High Moisture Levels[J],Food Reviews International,1992,8(2):235 -275
[15]张汆.花生蛋白挤压组织化技术及其机理研究[D].杨凌:西北农林科技大学,2007
[16]Li M,Lee T C.Effect of extrusion temperature on solubility and molecularweight distribution of wheat flour proteins[J].Journal of Agricultural and Food Chemistry,1996,44(3):763-768
[17]Bredie W L P,Hassell G M,Guy R C E,et al.Aroma characteristics of extruded wheat flour and wheat starch containing added cysteine and reducing sugars[J].Journal of Cereal Science,1997,25(1):57 -63
[18]王彰,许时缨.食品化学[M].北京:中国轻工业出版社,2003:134.

