挤压膨化参数对转基因大豆外源基因降解的影响
王卫国 朱占齐 吴兴泉
(河南工业大学生物工程学院河南工业大学饲料工程技术研究所,郑州 450001)
转基因大豆是较早商业化生产的转基因作物之一。第一个大面积生产应用的转基因大豆是抗草甘膦大豆,是在传统大豆中转入外源基因CaMV-35S启动子、抗草甘膦基因CP4-EPSPS和NOS终止子而得到的。目前,转基因大豆的种植面积已占全球转基因农作物种植总面积的60%以上,占全部大豆种植面积的70%,获得了很大的经济效益和社会效益[1-2]。
目前在国际上对转基因食品安全性的评价原则是实质等同性原则[3-4]。据此,Monsanto公司对培育的抗草甘膦转基因大豆品种进行了食品安全评价,结果未表明CP4-EPSPS有毒。但人们对转基因大豆的食用和饲用的安全性仍存疑虑,需要作进一步研究。而利用加工手段使外源基因降解失效可能是提高转基因食品或饲料的安全性的途径之一。
在食品或饲料加工过程对转基因大豆外源基因影响的研究相对较少[5]。而挤压膨化加工对转基因大豆外源基因的影响也鲜见报道。本试验的目的是了解在不同温度、转速和水分参数的工艺条件下挤压膨化对Roundup Ready大豆外源基因CP4-EPSPS的降解作用。
1 材料与方法
1.1 材料
1.1.1 试验样品
转基因大豆:郑州阳光油脂有限公司提供。
1.1.2 CP4-EPSPS基因扩增引物
根据文献报道[6-8],在转基因大豆 Roundup Ready中,CP4-EPSPS蛋白基因共有1 946个碱基。根据 Genbank中 CP4-EPSPS基因的基因序列(AY125353),设计了扩增不同长度CP4-EPSPS基因片段的引物(引物序列见表1),所有引物均由英骏生物技术有限公司合成。

表1 抗草甘膦转基因大豆外源基因特异性引物序列
1.1.3 试剂
DP-320试剂盒:天根生化科技有限公司;Taq酶、dNTPs、PCR缓冲液、分子质量 Marker(100~2 000 bp)、无水乙醇、三氯甲烷、巯基乙醇、琼脂糖:郑州久是生物技术有限责任公司。
1.1.4 主要仪器与设备
9FQ20锤片粉碎机:江西红星机械厂;DS-2型双螺杆挤压膨化机:济南赛信膨化机械有限公司;AUCMA冷藏冷冻箱:青岛澳柯玛股份有限公司;梯度PCR仪:德国Bio-metra公司;JJ-CJ-1CU洁净工作台:吴江市净化设备总厂;DYY-6C型电泳仪:北京市六一仪器厂;紫外凝胶成像系统:美国Biorad公司。
1.2 方法
1.2.1 样品水分的测定
按GB 5479—1985粮食、油料检验水分测定法测定样品的水分。
1.2.2 样品的加工制备
挑选籽粒饱满的大豆,粉碎并过60目筛,按表2工艺条件进行挤压膨化,并收集样品进行CP4-EPSPS基因不同长度片段的扩增。

表2 转基因大豆挤压膨化加工的参数设置
表2中选取挤压腔温度为100、115、130℃的依据是,挤压膨化腔温度超过130℃到150℃时,会使大豆蛋白严重变性,降低饲用价值;选择物料水分为14%、17%、20%的考虑是这一范围对应于大豆挤压膨化的干法和湿法加工范围,可以与实际生产对应;螺杆转速选择范围对应于物料所受挤压剪切作用的强弱,而喂料转速梯度变化则可反映物料流量变化对挤压膨化效果的影响。
1.2.3 DNA 的提取
收集经各工艺条件加工的样品以提取DNA。称取固体样品60 mg,所有样品均采用天根DP305试剂盒进行DNA提取,方法按照天根生化科技有限公司提供的说明书进行。
1.2.4 抗草甘膦转基因大豆DNA质量浓度检测
采用紫外可见光光度计法测定抗草甘膦转基因大豆基因组的质量浓度,按公式(1)计算:

式中:Cm为总DNA质量浓度/ng/μL;为紫外可见光光度计读数;λ为50 ng/μL;Vw为双蒸水体积2 900μL;Vs为样品体积100μL。
1.2.5 PCR 扩增
本研究检测了抗草甘膦CP4-EPSPS目的基因4条长度不等的片段,使用未加工转基因大豆外源基因作为模板DNA作为阳性对照,确保试验操作和体系正常,双蒸水空白对照无检测产物出现,说明PCR操作过程无污染。
本试验建立和优化的抗草甘膦转基因大豆粉PCR检测方法均采用相同的PCR反应体系,总反应体积 50 μL,10 × Buffer 5 μL,dNTPs(10 μmol/L)2μL,引物(10 μmol/L)2 μL,Taq酶 1 U,模板 DNA 1μL(约100 ng),加ddH2O补足至50μL。
反应在PCR仪上进行,4条不同长度片段PCR检测反应条件如表3所示。

表3 PCR检测反应条件
1.2.6 最低检测限分析及序列测定
将质量浓度约为50 ng/μL的转基因大豆DNA和双蒸水分别按体积比为50%、25%、12.5%、5%和1%的比例充分混合,双蒸水为空白对照,按1.2.5优化的PCR检测方法进行检测,确定加工处理样品总DNA的最低检测限。
将阳性检测产物进行测序,4条片段分别随机测定一个反应,以避免出现假阳性。
1.2.7 PCR 扩增产物检测
PCR扩增产物在1%的琼脂糖凝胶上90 V电泳45 min,用凝胶成像仪观察结果。
2 结果与分析
2.1 转基因大豆的含水量
按GB 5479—1985粮食、油料检验水分测定法测得的转基因大豆的含水量为9.06%。
2.2 转基因大豆在挤压膨化过程中色泽变化
挤压膨化时,物料在高压、高温工况下呈现熔融状态,一旦由模孔挤出,压力骤然降为常压,水分便发生急骤的蒸发、汽化,产品随之膨胀,水分从物料中逸出中并带走大量热量,使物料在瞬间从挤压膨化时的高温迅速降至80℃左右,从而使物料固化定型,并保持膨化后的形状[8]。
挤压膨化产品的色泽是反映挤压膨化热处理程度的重要标志之一。当挤压腔温度为100℃时,各处理组挤压膨化后的转基因大豆样品均呈现金黄色,颗粒松散,不同处理间产品色泽差异不明显(图1);当挤压腔温度为115℃时,各处理组的转基因大豆样品均呈现黄褐色,同温度下的3个不同处理之间样品色泽差异不明显(图2);当挤压腔温度为130℃时,各处理组的转基因大豆样品均呈现深褐色,甚至有碳化黑色颗粒出现(图3)。由图1~图3可见,随着挤压腔温度的上升,转基因大豆样品中蛋白质的变性程度在加重。在处理温度130℃下,样品J8、J9中出现了少量碳化颗粒,表明部分蛋白质已经损坏,转基因大豆的外源基因也会造成部分损坏或降解。



2.3 挤压膨化处理抗草甘膦转基因大豆DNA质量浓度
按试验的方法提取转基因大豆基因组并测得抗草甘膦转基因大豆基因组质量浓度见表4。
试验测得未加工大豆外源基因组的质量浓度为85 ng/μL。由表4中的极差分析可知,挤压腔温度是影响大豆基因组质量浓度的最主要因素,温度越高,基因组质量浓度越低,由100℃上升到130℃,大豆基因组质量浓度平均下降39.7 ng/μL。含水量的影响趋势与温度相同,含水量越高,大豆基因组质量浓度越低,但该因素的影响程度远低于温度,水分由14%升至20%,大豆基因组质量浓度平均下降10.8 ng/μL。螺杆转速和喂料器转速对大豆基因组质量浓度的影响最小,且影响随参数值的增大先增加后降低。表明,螺杆转速和喂料器转速既不应过慢也不能过快,有一适宜值。经130℃挤压膨化处理后的质量浓度最低值降至35 ng/μL左右。

表4 不同挤压膨化处理抗草甘膦转基因大豆基因组质量浓度
2.4 转基因大豆在挤压膨化过程中外源基因CP4-EPSPS的降解情况
挤压膨化过程中大豆外源基因CP4-EPSPS受不同加工参数作用而降解的情况见图4。在挤压腔温度为100℃的条件下,挤压膨化大豆样品中大小为1 512、807、408和206 bp的外源基因片段都能检测到(图4各图中的1、2、3泳道图);在温度为115℃的挤压条件下,样品J4、J6中只能检测到807、408和206 bp的CP4-EPSPS基因的片段。而样品J5仅能检测到408 bp和206 bp的CP4-EPSPS基因的片段(图4);当挤压温度达到130℃时,外源基因片段骤然降至206 bp以下(图4),本试验中已经无法检测其外源基因的片段大小,表明外源基因已降解较充分。本次试验的结果可以看出,挤压腔内温度是影响外源基因降解的主要因素,其次为水分,二者的复合作用是正向加强的。
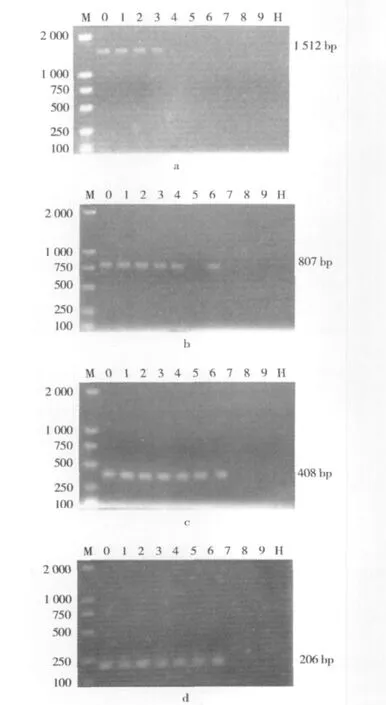
图4 挤压膨化抗草甘膦转基因大豆外源基因CP4-EPSPS的PCR检测
3 讨论
3.1 挤压腔温度对转基因大豆外源基因 CP4-EPSPS的影响
温度是影响植物内外源基因稳定性的最重要因素之一。对非转基因植物经不同加工处理后的DNA状态的研究表明,干热条件下,93℃加热处理4 min,小麦的DNA保持完整。93℃加热处理5 min以上时,小麦DNA发生部分降解。而95℃热处理5 min,小麦DNA降解。当采用100℃至125℃的高压蒸汽处理1 min以上时,小麦的DNA降解。其他研究发现,经过100℃温度处理的含GM菜粕和非GM菜粕的两种饲粮中的DNA的浓度较未经热处理的饲粮的DNA浓度有显著降低,但仍能检出大分子质量的DNA[5]。陈颖等[8]等研究表明,豆腐、豆奶、豆粉加工过程中经过磨浆、点浆、高温杀菌(110℃以上)、喷雾干燥等处理后,产品中只能检测出190 bp左右的外源基因片段。
Gawienowski等[9]研究表明,当玉米在135 ℃加热2 h后,在玉米蛋白中已无法检测到DNA,这说明当温度超过了135℃时,基因组破坏比较严重,甚至被完全降解。挤压膨化的特点是机械作用力强,温度高,物料在机内滞留时间短(少于30 s),本试验将挤压腔温度梯度选择在100~130℃是合理的。温度条件既要保证外源基因有效降解,又要最大限度保留大豆中必需氨基酸的生物学效价。研究结果表明,115℃和130℃的处理条件可以分别将EPSPS基因的片段降至807 bp和206 bp以下。但对必需氨基酸的生物学效价本次试验未作测定。
3.2 含水量对转基因大豆外源基因CP4-EPSPS降解的影响
水分是各种生化反应的媒介。低水分条件下,挤压膨化腔内大豆蛋白分子难以充分伸展,各类化学反应难以均匀进行,因而会影响蛋白质变性降解反应速率。
本试验的结果表明,同一挤压腔温度下,随着被挤压物料含水量增加,产品中大豆基因组质量浓度提取率降低,即大豆内外源基因组降解率提高。含水量与挤压腔温度有正向协同增效作用。在实际转基因大豆的挤压膨化加工中,应采用20%的含水量,这样既能提高外源基因降解效率,又可以提高设备生产率。
3.3 螺杆转速和喂料器转速对转基因大豆外源基因CP4-EPSPS降解的影响
螺杆转速影响物料在挤压膨化机内的滞留时间,螺杆转速越慢,物料在机内滞留时间越长,受热处理时间越长。但物料所受的机械剪切、挤压力则相对减弱。要获得好的处理效果,需要寻求热处理时间与机械剪切、挤压力之间的平衡。这就需要寻找一个最佳螺杆转速值。由表2的极差分析可以看出,中等螺杆转速(72 r/min)为适宜值。
喂料器转速主要影响挤压膨化机的流量,转速越高,喂料流量越大。当机内充满物料的情况下,增大流量会提高物料通过挤压膨化机的速度,减少滞留时间,但同时增大机械挤压剪切作用。因此,喂料器转速既不能过高也不能过低,需要一个最佳值。由表2的极差分析可以看出,中等喂料器转速(88 r/min)为适宜值。
3.4 转基因大豆外源基因CP4-EPSPS降解片段的安全性
目前,有关降解后的转基因大豆外源基因CP4-EPSPS片段大小的安全性尚无明确结论。一般认为,外源基因降解到100 bp以下,其作为特定基因已经被彻底降解,其原有的基因功能已经丧失。被降解的外源基因片段被动物食用后在体组织内重新组装或插入到动物自身内源基因中发挥外源基因功效或引起内源基因突变的情况未见报道。这些片段在动物组织内应是主要作为氨基酸供体或小肽供体为动物所利用。但要对它们的安全性作出最终明确结论尚需进一步的、长期的研究。
4 结论
本研究结果表明,挤压膨化加工是降解转基因大豆外源基因CP4-EPSPS的有效手段。挤压膨化参数中,对外源基因降解作用由强到弱的顺序为:挤压腔温度>物料水分>螺杆转速或喂料器转速。本试验条件下的最佳挤压膨化参数组合为:挤压腔温度130℃,物料水分20%,螺杆转速72 r/min,喂料器转速88 r/min。在此条件下,大豆外源基因片段可降至206 bp以下而未能检出。
[1]李静,李红芳,张换样,等.全球转基因作物的产业化发展[J].山西农业科学,2009,37(1):3 -8
[2]叶增民,潘婕.转基因大豆及其制品的安全性研究现状[J].生物技术通报,2009(2):26 -28
[3]叶汉英,杨伟华.转基因大豆中的发展及其安全性评价[J].粮油加工,2007(4):45 -48
[4]张军民,胡广东,高振川.转基因食品与饲料安全及其评价[J].中国农业科技导报,2002,4(4):21 -25
[5]王卫国,过世东.GM饲料DNA在加工和畜禽消化道中的降解——转基因饲料安全性评价[J].粮食与饲料工业,2004(10):38-40
[6]Meyer R.Development and application of DNA analytical methods for the detection of GMOs in food[J].Food Control,1999,10:391 -399
[7]Ahmed F E.Detection of genetically modified organisms in food[J].Trends in Biotechnology,2002,20(5):215 -223
[8]陈颖,王媛,徐宝梁,等.Roundup Ready大豆外源基因在食品加工过程中的降解变[J].中国油料作物学报,2005,27(2):10-14
[9]Gawienowski M C,Eckhoff SR,Yang P,et al.Fate of maize DNA during steeping and processing[J].Cereal Chemistry,1999,76(3):371 -374.

