酶法辅助提取北苍术挥发油的工艺及成分分析
孟利娜, 于 敬, 许 静, 南 楠, 周 晶
(天津医科大学药学院,天津市临床药物关键技术重点实验室,天津300070)
北苍术为菊科植物北苍术Atractylodes chinensis(DC.)Koidz.的干燥根茎[1],为《中国药典》2010年版收载的苍术药材之一。其性味辛、苦、温,归脾、胃经,具有健脾、燥湿、解郁、辟秽之功效[2]。现代药理研究表明,苍术挥发油具有抗溃疡、抗心率失常、降血压、利尿、保肝、抗菌等作用[3]。因此,简便而有效的获取苍术挥发油对充分利用苍术药材具有重要的实用价值。
目前苍术挥发油的提取方法有水蒸气蒸馏法[4],超临界 CO2萃取法[5],同时蒸馏萃取法[6],顶空固相微萃取法[7]等。上述方法中有的挥发油提取率较低,有的需要特定的设备,目前实施于生产中仍有一定的局限性。本实验采用酶法处理药材,结合直接蒸馏法提取北苍术挥发油,并通过正交实验优化得到最佳的酶解提取工艺,该条件下,不需要特殊的仪器设备即可以显著地提高苍术油的提取率。为生产中充分利用苍术药材资源及工业化生产推广提供了理论依据。
1 仪器与材料
1.1 仪器 气相色谱-质谱联用仪 (安捷伦公司7890A-5975C型),Agilent 190915-433 HP-5色谱柱:(30 m ×250 μm ×0.25μm);84-1磁力搅拌控温电热套 (华鲁电热公司);电子分析天平 (FA2004N),PHS-25型精密酸度计(杭州亚美电子仪器厂),电热恒温水浴锅 (北京科伟永鑫实验仪器设备厂)。
1.2 材料 酶 (活力单位5000 U/g)购自天津利华酶制品厂 (批号:11-08-30);北苍术 (河北安国市同利中药材有限公司提供,由天津医科大学生药教研室周晔教授鉴定),符合《中国药典》2010版 (一部)要求;柠檬酸、柠檬酸钠、无水乙醚 (分析纯,天津基准化学试剂有限公司);无水硫酸钠 (化学纯,天津市塘沽邓中化工厂);正己烷 (色谱纯,天津康科德试剂公司)。
2 方法与结果
2.1 水蒸气蒸馏法提取 精密称取40目北苍术50 g,置于1 000 m L的圆底烧瓶中,加入12倍量蒸馏水,按《中国药典》2010年版[1]项下的挥发油提取法提取4 h,所得挥发油经乙醚萃取,无水硫酸钠脱水,吸取乙醚溶液,挥干乙醚,得气味芳香的棕红色油状物,精密称取挥发油质量。
2.2 酶法辅助提取苍术油的单因素条件筛选
2.2.1 酶种类的选择 精密称取40目北苍术50 g,分别加入药材质量1.0%的纤维素酶、半纤维素酶、果胶酶、木聚糖酶,各溶于12倍量 pH4.5的柠檬酸缓冲液中,40℃条件下酶解1 h后,按照《中国药典》(2010版)项下的挥发油提取法提取4 h,以下操作同2.1项下,结果显示,由半纤维素酶处理的药材,其挥发油的提取量最高,因此选用半纤维素酶进行下列酶解工艺的条件筛选。
2.2.2 酶用量对挥发油产率的影响 精密称取40目北苍术50 g,依据2.2.1项结果,分别加入相当于药材质量的0、0.5%、1%、1.5%、2.0%、3.0% 的半纤维素酶,各溶于12倍量pH4.5的柠檬酸缓冲液中,40℃条件下酶解1 h后,以下操作同2.1项下,结果如图1所示。当酶用量小于1%时,随着酶用量的增加,挥发油产率升高,当酶用量达到1%后,产率稍有下降且趋于平稳,以酶用量为药材质量1%较好。
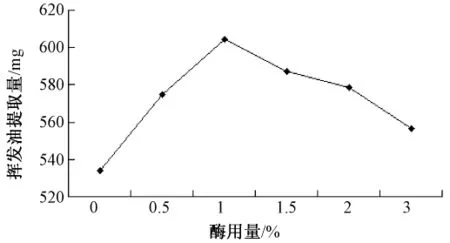
图1 酶用量对挥发油提取量的影响
2.2.3 酶解时间对挥发油产率的影响 精密称取40目北苍术50 g,依据2.2.2项结果,加入药材质量1%的半纤维素酶,以下操作同2.1项下,分别酶解0、0.5、1.0、1.5、2.0、3 h,结果见图2,随着酶解时间的延长,挥发油产率也有所提高,当酶解时间为1 h,挥发油产率最高,随后挥发油产率逐渐下降。
2.2.4 酶解pH值对挥发油产率的影响 精密称取40目北苍术50 g,加入药材质量1%的半纤维素酶,以下操作同2.1 项下,分别在pH3.0、4.0、4.5、5.0、5.5时酶解1 h,结果如图3所示。在pH4.5时,挥发油产率最高。pH过低或过高时挥发油产率都有所降低。

图2 酶解时间对挥发油提取量的影响
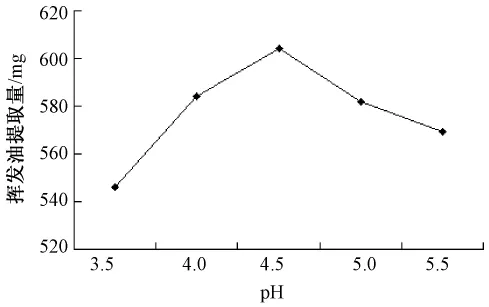
图3 不同pH对挥发油提取量的影响
2.2.5 酶解温度对挥发油产率的影响 精密称取40目北苍术50 g,加入药材质量1%的半纤维素酶,以下操作同2.1项下,分别在35、40、45、50、55℃条件下酶解1 h。不同酶解温度对挥发油产率的影响如图4所示。结果显示,45℃时挥发油产率最高,而温度过高或过低时产率都有所下降,其原因可能是温度过高使酶失活,温度过低又不能充分发挥酶的活性。
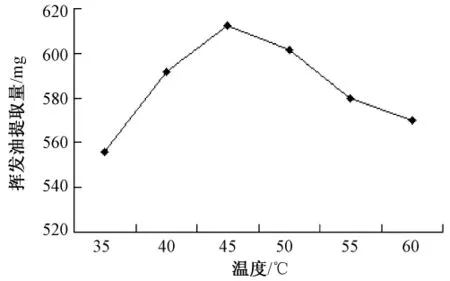
图4 不同温度对挥发油提取量的影响
2.3 正交设计优选工艺条件
2.3.1 正交试验设计 根据单因素初步实验结果,选取酶的用量、酶解时间、酶解温度以及酶解pH四因素,每个因素设计3个水平,见表1。

表1 L 9(34)正交试验因素水平
2.3.2 正交试验结果及方差分析 精密称取40目北苍术50 g,分别按L9(34)正交设计表设定的条件进行酶解后,按照《中国药典》2010年版挥发油项下提取挥发油,以下操作同2.1项下,以挥发油提取量为指标,结果见表2。方差分析结果见表3。
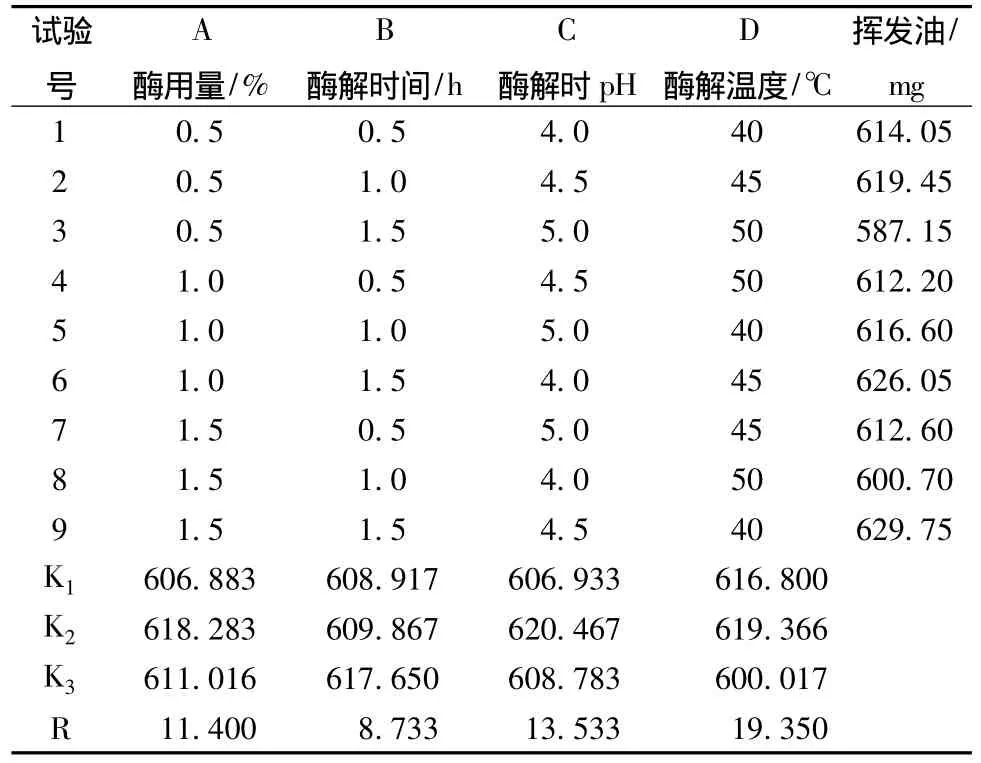
表2 正交试验方案与结果

表3 方差分析
从表2直观分析,各因素对北苍术挥发油提取率的影响程度大小为D(酶解温度) >C(酶解pH)>A(酶用量)>B(酶解时间),初步认为工艺条件最佳组合为A2B3C2D2。方差分析结果表明,其中酶解温度对挥发油提取量具显著性影响 (P<0.05),A、B、C的影响均无显著性 (P>0.05)。综合分析上述结果,确定最佳提取工艺条件是:酶用量为药材的1.0%,在pH4.5,45℃条件下酶解1.0 h。
2.3.3 验证试验 精密称取40目北苍术50g,按优选工艺条件进行重复验证试验,同时做对照试验,由表4可知,酶解-蒸馏法挥发油提取量比直接蒸馏法提高20.82%,且重现性好。

表4 验证试验结果
2.4 北苍术挥发油成分测定
2.4.1 气相色谱-质谱测定条件
气相色谱条件:HP-5弹性石英毛细管柱 (30 m ×250 mm ×0.25μm),初始温度60℃;程序以6℃/min升温至260℃;气化室温度260℃;进样量1.00μL;分流比10∶1;溶剂延迟3 min,载气为高纯氦气。
质谱条件:MS-EI离子源,电子能量70 eV,离子源温度230℃,扫描范围30~500 u;G1036A NIST2008版标准图库。
2.4.2 定性分析 分别取2.3.3项下直接蒸馏法和酶解辅助蒸馏法提取的挥发油适量,用气相色谱-质谱联用仪分析鉴定。通过ChemStation工作站检索NIST谱图库,再结合有关文献进行人工图谱解析,确认其化学成分。两种方法提取挥发油中各主要组分的相对百分含量见表5。蒸馏法、酶解-蒸馏法提取北苍术挥发油的气相色谱图见图5、图6。
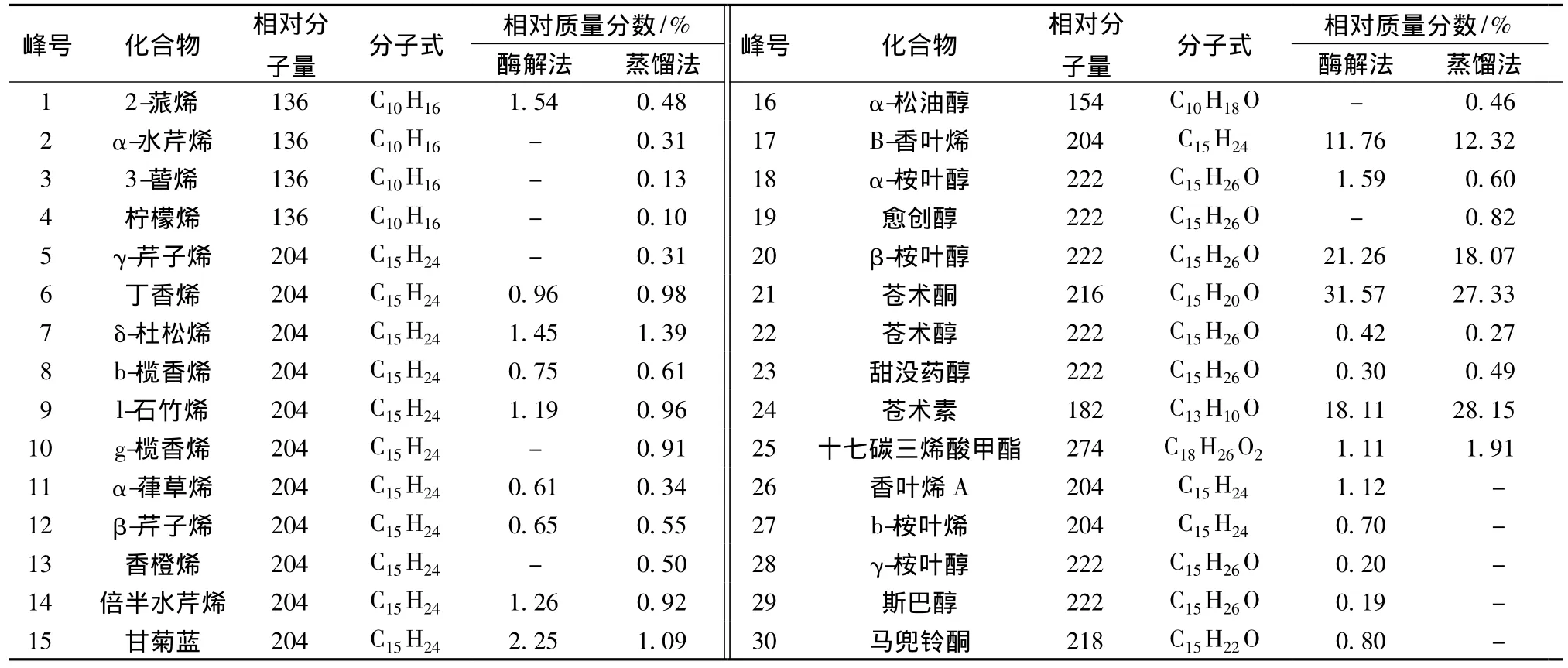
表5 酶解辅助提取法和SD法提取北苍术挥发油的化学成分及其相对质量分数
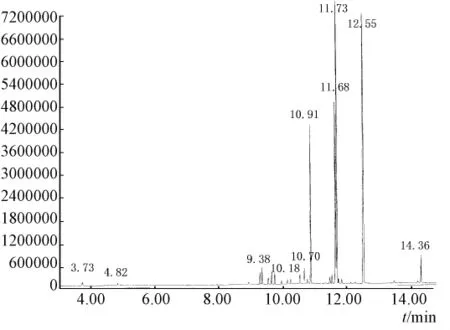
图5 直接蒸馏法提取北苍术挥发油GC图
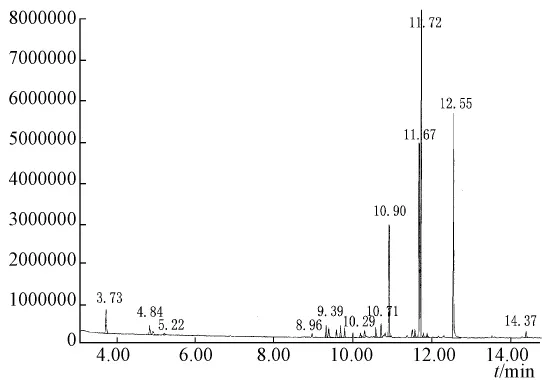
图6 酶解辅助提取北苍术挥发油GC图
图5和图6表明,蒸馏法和酶解辅助蒸馏法提取的北苍术挥发油气相色谱图整体相同,各物质的保留时间主要集中在9~15 min。由表5可知挥发油的主要成分为苍术素、苍术酮、β-桉叶醇和B-香叶烯,酶解后苍术酮和β-桉叶醇的百分含量明显提高。
3 讨论
2010 年版《中国药典》中挥发油的测定采用直接蒸馏法,本研究采用酶解-蒸馏法提取苍术油,其苍术油的质量分数较《中国药典》2010年版法提高了20.82%。这是因为植物细胞壁是由纤维素、半纤维素、果胶质等物质构成的致密结构,选用适当的酶,在合适的条件下,可以使细胞壁的组织水解,破坏细胞壁的致密构造,减少细胞内成分溶出的屏障,从而有利于有效成分的溶出。由于半纤维素酶是多种酶的复合体,由β-甘露聚糖酶、β-木聚糖酶、β-葡萄糖苷酶、阿拉伯糖苷酶、半乳糖苷酶等组成,所以,分解植物细胞壁效果好于单一纤维素酶与果胶酶[8]。酶解辅助提取植物中的活性成分,不仅可以提高有效成分浸出率,且不需要特定的设备,易于实施,成本较低,为北苍术挥发油的工业化生产提供科学依据和参考。
有研究表明,β-桉叶醇能够促进胃肠运动[9],抗缺氧[10],通过降低重复性刺激引起的乙酰胆碱的再生释放对抗新斯的明诱导的神经肌肉障碍[11]等;苍术酮具有细胞毒性,能抑制肝毒细胞对肝组织的破坏作用,修复肝损伤[12];也有体外实验证明,苍术酮在质量浓度为1 mg/mL时对甲型流感病毒H3N2亚型、高致病性禽流感病毒H5N1亚型和乙型流感病毒株均有杀灭作用[13]。本研究通过酶解辅助提取较直接蒸馏法提取苍术挥发油,其油中的活性成分苍术酮和β-桉叶醇的相对质量分数分别提高32.79%和34.61%,为提高苍术药材的临床应用效果、减小剂量提供借鉴。
[1]国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010:150-151.
[2]南京中医药大学.中药大辞典:上册[M].上海:上海科学技术出版社,2005:1482-1485.
[3]赵春颖,毛晓霞.北苍术化学成分与药理作用研究进展[J].承德医学院学报,2010,27(3):309-311.
[4]张兴德,李俊松,吕游春,等.北苍术挥发油不同提取工艺及药效学研究[J].现代中药研究与实践,2009,22(6):35-37.
[5]杨 凌,欧阳臻,宿树兰,等.茅苍术挥发油超临界萃取工艺及气质联用分析[J].江苏大学学报,2007,17(5):393-395.
[6]李西林,须丽茵,栾 晶,等.北苍术挥发油的提取与成分分析[J].上海中医药大学学报,2008,22(1):59-61.
[7]Guo Fangqiu,Huang Lanfang.Comparison of the volatile compounds of Atractylodes medicinal plants by headspace solidphase microextraction-gas chromatography-mass spectrometry[J].Analytica Chimica Acta,2006,570(1):73-78.
[8]周 晶,冯淑华.中药提取分离新技术[M].北京:科学出版社,2010:44-46.
[9]王金华,薛宝云,梁爱华,等.苍术有效成分β-桉叶醇对小鼠小肠推动功能的影响[J].中国药学杂志,2002,37(4):266.
[10]冯 慧,苏克林,侣正彬,等.茅苍术生物活性研究进展[J].军医进修学院学报,2008,29(6):552-554.
[11]赵爱梅.苍术的药理作用研究[J].光明中医,2009,24(1):181-182.
[12]文 震,刘 波,郑宗坤,等.苍术酮脂质体及其制备方法:中国,101703549A[P].2010-05-12.
[13]苏子仁,赖小平,陈建南,等.苍术酮、含苍术酮的植物及苍术酮提取物在制备抗流感病毒药物中的用途:中国,1857358A[P].2006-11-08.