苓桂术甘汤对急性心肌梗死后心室重构模型大鼠TNF-α的影响
王 靓, 侯晓燕, 黄金玲, 施 慧
(安徽中医学院,安徽合肥230038)
急性心肌梗死 (acute myocardial infarction)后缺血性心肌病已经成为慢性心力衰竭 (chronic heart failure)最常见的原因之一,急性心肌梗死后心室重构 (ventricular remodeling)是导致患者临床症状不断恶化,慢性心力衰竭发生、发展的重要病理生理学基础。既往研究显示[1-2],益气温阳、健脾化饮之经典名方苓桂术甘汤能够显著抑制急性心肌梗死后6周慢性心力衰竭模型大鼠神经内分泌及细胞因子过度表达,阻抑心室重构,改善血流动力学指标,对急性心肌梗死所致慢性心力衰竭有积极的防治作用。本实验观察苓桂术甘汤对急性心肌梗死2周后心室重构模型大鼠肿瘤坏死因子 α (tumor necrosis factor-α,TNF-α)的影响,探讨其干预心室重构的作用机制。
1 材料
1.1 实验药物 苓桂术甘汤 (茯苓12 g、桂枝9 g、白术9 g、甘草6 g)由亳州兴和药业有限公司提供,参考文献[3]提取制成干浸膏粉末 (4.8 g生药/g,其中桂皮醛9.945 mg/g,甘草酸14.71 mg/g);卡托普利为中美上海施贵宝制药有限公司产品 (批号:011031)。
1.2 实验动物 清洁级SD大鼠,雄性,体质量0.18~0.22 kg,由安徽医科大学实验动物中心提供,动物合格证号:SCXK(皖)2011-002。
1.3 主要试剂 Trizol Reagent、大鼠TNF-α荧光定量引物及探针均由invitrogen公司设计合成,批号:42801、NSO-512728-019;逆转录试剂盒、PCR试剂和Taq DNA聚合酶均由美国 Fermentas公司生产,批号为 00097559、00090703、00093869;荧光定量试剂盒由TaKaRa公司生产,批号BK7203;PVDF膜由美国millipore公司生产,批号K1JA0907MK;ECL试剂盒由美国pierce公司生产,批号MJ161901;TNF-α大鼠ELISA检测剂盒由上海森雄科技实业有限公司生产,批号20111105248。
1.4 主要仪器 ABI 2720型PCR仪和ABI 7500型RT-PCR仪均由美国ABI公司生产;Bio-pro CN-UV型GSM凝胶图像分析系统由美国Sim公司生产;Multiskan MK2型酶标仪由芬兰Labsystem公司生产;Modulus多功能光度计由美国Turner Biosystems公司生产;FR-180A型电泳槽由上海复旦生物实验技术研究所生产;DYY-Ⅱ型电泳仪由北京市六一仪器厂生产;5417R型高速低温离心机由德国Eppendorf公司生产;NABILA 175型-80℃低温冰箱由日本松下电器公司生产。
2 方法
2.1 急性心肌梗死模型复制 参考文献 [4]采用冠状动脉结扎法。取雄性SD大鼠130只,乙醚麻醉后在呼吸机辅助下,无菌开胸,用6-0眼科缝合线在距左冠状动脉根3 mm处结扎冠状动脉左前降支,左心室颜色变浅,闭胸。术后大鼠心电图Ⅱ导联S-T段抬高者视为造模成功,假手术组大鼠只穿线不结扎。
2.2 动物分组、给药及方法 冠状动脉结扎术后2周,将模型大鼠随机分为5组 (每组12只):模型组,苓桂术甘汤小、中、大剂量组 (2.1、4.2、8.4 g生药/kg,按体表面积法计算相当于临床成人等效量的0.5、1、2倍),卡托普利组 (4.375 mg/kg,按体表面积法计算相当于临床成人等效量的1倍),另设假手术组 (10只)。各组大鼠灌胃给药,模型组和假手术组灌胃等容积蒸馏水,灌胃容积为10 mL/kg体质量,每日1次,连续4周。
2.3 观察指标及方法 连续灌胃处理4周后,各组大鼠腹腔注射乌拉坦5 mL/kg体质量麻醉,背位固定,于大鼠腹主动脉取血,静置4 h,低温3 500 r/min离心10 min,分离血清,-20℃冰箱保存待测。采血后,无菌剖取心脏,冰生理盐水冲洗,剪取左心室心肌组织 (含室间隔),-80℃冰箱保存待测。
2.3.1 采用Western blot检测大鼠心肌组织TNF-α蛋白取左心室心肌组织50 mg,添加RIPA细胞裂解液,制备心肌组织匀浆,离心取上清,按1∶4比例加入5×SDS-PAGE蛋白上样缓冲液,沸水浴5 min,冷却至室温后,取蛋白样品上样,电泳,转膜 (β-actin蛋白分子量为43 kDa,TNF-α蛋白分子量为17 kDa),加入Western封闭液室温封闭2 h,按照说明书一抗孵育2 h,二抗孵育1.5 h,洗膜后使用ECL发光试剂盒检测蛋白,结果采用Quantity one灰度分析软件进行分析。
2.3.2 采用RT-PCR法检测大鼠心肌TNF-αmRNA表达取左心室心肌组织50 mg,加入1 mol Trizol,分步经三氯甲烷、异丙醇、75%乙醇处理后,抽提总RNA,加入80μL DEPC水,55℃ 10 min使RNA溶解,以actin为内对照进行Real-time PCR反应。引物及探针序列如下:actin(上游5’-CGATGCCCTGAGGCTCTTT-3’、下 游 5’-TGGATGCCACAGGATTCCA-3’、探针 5’-CCAGCCTTCCTTCTT-3’),TNF-α (上 游 5’-CTGGCCAATGGCATGGAT-3’、下 游5’-GGTACAGCCCATCTGCTGGTA-3’、探针 5’-TCAAAGACAACCAACTGGT-3’)。反应体系:2×Goldstar Taqman mixture10μL,上游引物 (10μmol/L)0.4μL,下游引物(10μmol/L)0.4 μL,探针 (10μmol/L)0.4μL,Template DNA 2μL,加无菌水至20μL。反应条件:95℃预变性10 min,95℃变性15 s,60℃退火1 min,共40个循环。采用relative quantification study分析方法,相对表达量采用的指标为 2-ΔΔCt(Ct为循环值)。
2.3.3 采用ELISA法检测大鼠血清TNF-α量 取分离冻存的大鼠血清按照试剂盒说明书方法步骤,用酶标仪检测TNF-α 量。
3 统计方法
实验数据采用SPSS 17.0统计软件进行统计学处理。连续性变量采用“均数±标准差 (±s)”表示,多样本均数间比较采用One-Way ANOVA检验,P<0.05为具有统计学意义。
4 结果
4.1 对心室重构模型大鼠心肌组织TNF-α蛋白的影响连续处理4周,急性心肌梗死2周后心室重构模型组大鼠左室心肌组织TNF-α蛋白量显著升高,与假手术组比具有显著性差异 (P<0.01);苓桂术甘汤各剂量组及卡托普利组大鼠心肌组织TNF-α蛋白量显著降低,与模型组比有统计学意义 (P<0.01),表明苓桂术甘汤能够显著地抑制模型大鼠心肌组织TNF-α蛋白的过度表达。结果见图1、2。
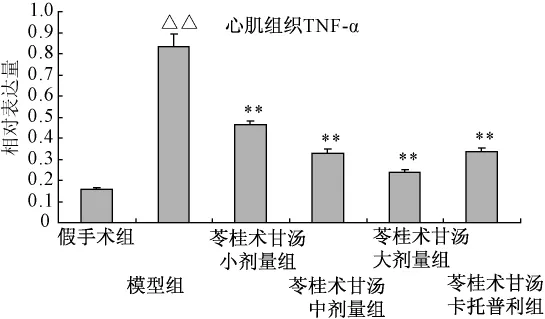
图1 对心室重构模型大鼠心肌组织TNF-α蛋白的影响
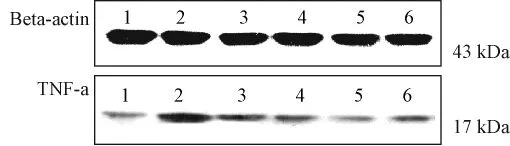
图2 各组大鼠左心室心肌组织TNF-α蛋白表达
4.2 对心室重构模型大鼠心肌组织TNF-αmRNA表达的影响 连续处理4周,急性心肌梗死2周后心室重构模型组大鼠左室心肌组织TNF-αmRNA表达显著增强,与假手术组比较具有显著性差异 (P<0.01);苓桂术甘汤各剂量组及卡托普利组大鼠左室心肌组织TNF-αmRNA表达则明显降低,与模型组比较具有统计学意义 (P<0.01),表明苓桂术甘汤能够显著地抑制模型大鼠心肌组织TNF-αmRNA表达。结果见表1、图3。
表1 对心室重构模型大鼠心肌组织TNF-αm RNA表达的影响(±s,n=6)

表1 对心室重构模型大鼠心肌组织TNF-αm RNA表达的影响(±s,n=6)
注:与假手术组比较,△△P<0.01;与模型组比较,**P <0.01。
组 别 剂量/(g·kg-1) Ct值假手术组 -32.034±0.118模型组 - 27.871±0.132△△苓桂术甘汤小剂量组 2.100 29.817±0.662**苓桂术甘汤中剂量组 4.200 30.646±0.518**苓桂术甘汤大剂量组 8.400 31.645±0.229**卡托普利组 0.004 30.914±0.622**
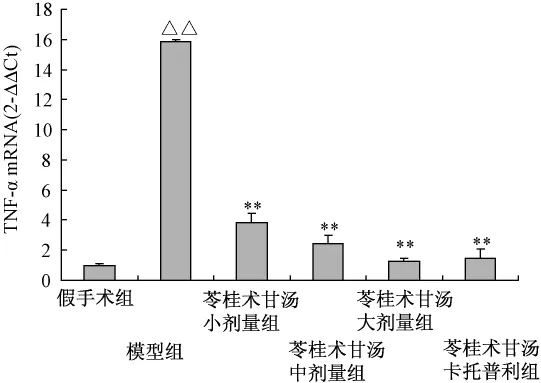
图3 各组大鼠心肌组织TNF-αm RNA的相对表达量
4.3 对心室重构模型大鼠血清TNF-α量的影响 连续处理4周后,急性心肌梗死2周后心室重构模型组大鼠血清TNF-α量显著增加,与假手术组比具有显著性差异 (P<0.01);苓桂术甘汤各剂量组及卡托普利组大鼠血清TNF-α量显著降低,与模型组比有统计学意义 (P<0.01),表明苓桂术甘汤能够显著地降低模型大鼠血清TNF-α量。结果见表2。
表2 对心室重构模型大鼠血清TNF-α量的影响(±s)
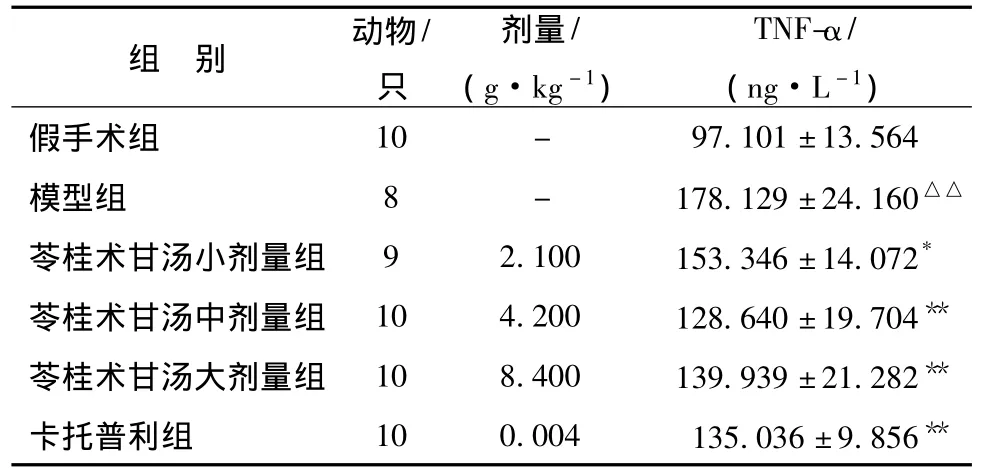
表2 对心室重构模型大鼠血清TNF-α量的影响(±s)
注:与假手术组比较,△△P<0.01;与模型组比较,*P<0.05,**P <0.01。
组 别 动物/只剂量/(g·kg-1)TNF-α/(ng·L-1)假手术组10 - 97.101±13.564模型组 8 - 178.129±24.160△△苓桂术甘汤小剂量组 9 2.100 153.346±14.072*苓桂术甘汤中剂量组 10 4.200 128.640±19.704**苓桂术甘汤大剂量组 10 8.400 139.939±21.282**卡托普利组 10 0.004 135.036±9.856**
5 讨论
慢性心力衰竭临床表现复杂,属祖国医学“心悸”、“痰饮”、“水肿”等范畴,系本虚标实之证。“心脏属火,为阳中之太阳。上居于胸,秉火阳之权威,震慑下焦水寒之邪不敢越雷池一步”。“心阳一虚,则坐镇水寒之权威失势,下焦水寒阴气便有上乘之机”,乃有“心水”发生[5]。阳虚饮停日久则致血行瘀滞不利,久者历岁,渐见心悸怔忡,少尿水肿等虚、痰、瘀兼夹之候。其病理重点当责之于心之阳气虚衰,心阳气虚是本病的发病关键,是贯穿其始终的基本病理,以温阳益气为首要[6]。苓桂术甘汤是汉《伤寒杂病论》温心阳化水饮之代表方,由桂枝、茯苓、白术和甘草组成,本方内寓桂枝甘草汤,此乃仲景用以温心阳者,柯琴《伤寒附翼》视之为“温心阳之峻剂”;桂苓相辅,则温阳化气,消饮宁心;白术协茯苓,培土以制水。配伍谨严,临床效著[5,7-8]。
现代研究表明心脏受损后神经内分泌因子网络激活,诱导心室重构的发生,并最终导致心功能恶化,进展为慢性心力衰竭。TNF-α作为细胞因子网络的关键因子之一,在心肌受损后的心室重构过程中发挥重要的调控作用[9]。TNF-a是由激活的巨噬细胞分泌的一种具有多种生物学效应的细胞因子,促进炎性细胞的聚集和炎性递质的释放,通过心肌局部自分泌和旁分泌参与对心肌细胞及心肌间质细胞的生长和分化的调控[10]。一方面通过促进IL-1、IL-6和hs-CRP等细胞因子的表达,调控炎症的发生与发展[11-12],另一方面通过激活Caspase参与心肌细胞凋亡的调控,同时还通过调节基质金属蛋白酶参与心肌纤维化的调控[13],还可通过刺激心肌细胞膜IκB降解,进而激活NK-κB表达,导致依赖NK-κB激活的相关基因转录并与核DNA结合增加,进一步诱导心肌细胞坏死、凋亡[14]。因此,TNF-α在心肌损伤后发挥着刺激心肌细胞肥大,促进心肌细胞坏死,诱导心肌细胞凋亡,调节心肌细胞外基质改变,影响胶原的合成促进基质分解等作用,最终导致心脏结构破坏、功能受损,促进心室重构及心衰发生、发展[15]。
2009 年美国心脏病学会和心脏学会联合发布的《心力衰竭指南》指南强调早期干预对减少心衰发生、改善患者预后以及降低整体医疗成本有着积极的促进作用。本实验在既往研究基础上,观察苓桂术甘汤对急性心肌梗死后早期干预对慢性心力衰竭的防治作用及机制。研究结果显示,在急性心肌梗死后2周用苓桂术甘汤连续干预4周,模型大鼠心肌组织TNF-α、TNF-αmRNA的表达及血清TNF-α量均明显降低,表明抑制炎症因子TNF-α过度激活是该方阻抑心室重构、防治心力衰竭作用的重要机制之一。关于苓桂术甘汤对其他炎症因子及神经内分泌因子的调控作用已另文发表或正待发表。
[1]方海雁,黄金玲,桑方方,等.苓桂术甘汤对慢性心衰大鼠AngⅡ、ET-1、TNF-α 和 IL-β 的影响[J].安徽中医学院学报,2010,29(2):53-55.
[2]黄金玲,桑方方,王桐生,等.苓桂术甘汤对充血性心衰竭大鼠心脏指数与血流动力学的影响[J].安徽中医学院学报,2009,28(5):58-60.
[3]黄金玲,王慧慧,陈慧芳,等.正交试验法优选苓桂术甘汤的提取工艺[J].安徽中医学院学报,2011,30(6):65-67.
[4]徐淑云,卞如濂,陈 修.药理实验方法学[M].3版.北京:人民卫生出版社,2003:1053-1054.
[5]刘渡舟.《伤寒论》临证指要[M].2版,北京:学苑出版社,2003:54-55.
[6]李七一.方祝元.心脑血管疾病中医诊治[M].北京:人民卫生出版社,2000:40-49.
[7]盛生宽,盛全成.苓桂术甘汤加味治疗充血性心力衰竭体会[J].江西中医,2004,35(6):37-39.
[8]李小球,耿小茵,王沙燕.苓桂术甘汤治疗充血性心力衰竭的临床研究[J].中华中医药杂志,2005,20(4):220-222.
[9]何文俊,张 涛,蒋学俊.炎症因子与慢性心力衰竭[J].中华临床医师杂志,2011,5(2):457-460.
[10]闫晋康,张志平,王苏芳.心力衰竭与肿瘤坏死因子、白细胞介素相关性的研究进展[J].中西医结合心脑血管病杂志,2009,7(8):946-948.
[11]孙海霞,刘波泉.慢性充血性心力衰竭患者促炎性细胞因子和心肌纤维化与心功能分级的相关性研究[J].四川医学,2009,30(7):1035-1037.
[12]李 春,王 勇,仇 琪,等.肿瘤坏死因子在冠心病心肌缺血模型证候演变中的表达[J].中华中医药杂志,2011,26(5):1194-1197.
[13]段纬喆,赵延恕.肿瘤坏死因子α与心力衰竭及心肌细胞凋亡的研究进展[J].医学综述,2010,16(9):1284-1286.
[14]卢 琳,贾如意.急性心肌梗死后心衰大鼠核因子-κB与炎性细胞因子的相关性研究[J].心脏杂志,2011,23(3):309-311.
[15]周清芬,张凤如.肿瘤坏死因子与心力衰竭关系的研究[J].国际心血管病杂志,2010,37(3):146-148.

