碳纳米管复合微球修饰L-色氨酸及其对LDL的吸附性能
卢月美 巩前明 梁 吉 聂庆东
(1福州大学机械工程及自动化学院,福州 350108)
(2清华大学机械工程系,北京 100084)
(3清华大学校医院,北京 100084)
0 引 言
心脑血管疾病已成为目前威胁人类健康和生命的“头号杀手”,而研究发现血浆中的低密度脂蛋白(LDL)水平与心脑血管疾病的发生率呈正相关[1-3]。基于吸附作用的血液灌流是现今治疗高LDL的理想选择[4-5]。人血中的LDL在正常生理pH环境下是直径为18~25 nm的球形颗粒体,表面既有正电荷富集区又有疏水区[6],因此要想通过吸附剂与LDL之间的特异性作用选择性吸附LDL,则吸附剂的孔结构及表面性质是关键。
目前国外研制并临床应用的LDL血液灌流吸附剂有日本Kaneka公司的Liposorber系列 (其中的吸附剂是以球形纤维素为载体,以硫酸右旋糖酐为配基)[7-8]及德国Fresenius公司的DALI系统(聚丙烯酸覆盖的聚丙酰胺柱全血吸附剂)[9-10]。这些吸附剂是通过吸附剂表面的酸性基团与LDL之间的静电结合作用来吸附LDL,虽然它们对LDL有较好的吸附能力和良好的血液相容性,但存在价格昂贵的缺点[11],给LDL血液灌流的人群带来了很大的经济负担,难以在我国临床上广泛应用。而国内对LDL吸附剂的研究报道有南开大学,重庆大学,华东理工大学,四川大学,上海海洋大学等课题组,他们或以酸性基团为配基,制得负电型LDL吸附剂[11-20];或以吲哚-3-乙酸、色氨酸、十二醇或胆固醇等为配基制得疏水型LDL吸附剂[21-25];或既有负电性配基又有疏水性配基的双亲型LDL吸附剂[26-30]。这些吸附剂虽然对LDL的有一定的吸附能力,但均以现有的大孔树脂为载体(多孔壳聚糖、葡聚糖、纤维素微球,大孔珠状聚乙烯醇或聚丙烯酰胺微球等),其孔结构不是专门针对LDL的,且都仍处于实验室研究阶段。因此有必要开发一种孔结构及表面性质均适合LDL的专用LDL吸附剂。
多壁碳纳米管(CNTs)具有发达的中、大孔和高的比表面积,研究表明其对中分子物质不仅具有优异的吸附能力,而且吸附速率快[31]。碳纳米管作为生物医学材料使用时,具有良好的血液相容性[32,33]。另外,碳纳米管表面易于修饰,可以共价键或非共价键的方式修饰各种基团[34-39],可以通过与LDL之间的特异性作用来选择性吸附LDL。且随着碳纳米管制备和纯化技术的成熟,宏观量合成碳纳米管已成为可能,碳纳米管的应用成本也越来越低。因此碳纳米管有望成为良好的新型LDL血液灌流吸附剂载体材料。
L-色氨酸(L-Trp,C11H12N2O2),含有吲哚基团,具有疏水性,可以与LDL表面的疏水区域(未酯化胆固醇区)之间的疏水作用来识别LDL。同时L-Trp还含有弱酸性的羧酸,修饰至复合微球后可同时改善复合微球的亲水性;另外,L-Trp还含有活性氨基,这有利于与其它活性基团的反应,实现与复合微球的连接。另L-Trp本身就是人和动物生命活动中8种必需氨基酸之一,被广泛应用于医药,食品及饲料添加等领域,所以修饰L-Trp不会对人体造成不良的影响。因此L-Trp应是LDL吸附剂良好的配基。
本文以具有良好球形度和一定强度的多孔碳纳米管/活性炭(CNTs/AC)复合微球为载体,采用环氧氯丙烷偶联法修饰L-Trp,制备出含有一定配基数量的CNTs/AC复合微球(L-CNTs/AC),并进行LDL吸附试验,以期得到具有良好吸附能力的LDL吸附剂。
1 实验部分
1.1 主要原材料
多壁碳纳米管(CNTs,自制,化学气相沉积法制备并混酸 (浓硫酸与浓硝酸)纯化,外径约为20~40 nm,内径~10 nm);线型酚醛树脂(化学纯,中科院化学所);六次甲基四胺(分析纯,北京益利精细化学品有限公司);十二烷基硫酸钠(SDS)(化学纯,国药集团化学试剂有限公司);聚乙烯醇(PVA)(平均聚合度:1750,北京益利精细化学品有限公司);苯磺酰氯(化学纯,上海金山亭新化工试剂厂);浓硫酸(95.0%~98.0%,分析纯,北京化工厂);浓硝酸(65.0%~68.0%,分析纯,北京化工厂);L-色氨酸(L-Trp,生化试剂,国药集团化学试剂有限公司);环氧氯丙烷(ECH,分析纯,汕头市西陇化工厂有限公司);二甲基亚砜(DMSO)(分析纯,北京现代东方精细化学品有限公司);其它试剂均为市售分析纯试剂。高LDL病人血清(清华大学校医院提供)。
1.2 碳纳米管/活性炭复合微球修饰L-色氨酸
首先采用悬浮聚合、炭化、活化的方法制备得到不同碳纳米管加入量的碳纳米管/活性炭(CNTs/AC)复合微球[40]。将不同加入量(占酚醛树脂的质量分数)的CNTs超声分散在无水乙醇中(KS-900F超声波细胞粉碎机(宁波海曙科生超声设备有限公司),功率450 W,频率20 kHZ,碳纳米管分散时间为9 h),然后将酚醛树脂和六次甲基四胺 (占酚醛树脂的20wt%)溶于碳纳米管乙醇溶液中,制得均匀分散相。150 mL 0.3wt%SDS 及 1.89wt%PVA 的混合水溶液为连续相。将分散相在600~700 r·min-1机械搅拌作用下加入70℃的连续相中,搅拌混合液20 min后升温至96℃恒温搅拌3 h,酚醛树脂在苯磺酰氯催化下完全固化。依次用去离子水、无水乙醇清洗,烘干后即获得碳纳米管/酚醛树脂复合微球。将此微球在600℃下炭化、水蒸气850℃下活化90 min制得CNTs/AC复合微球。
其次采用环氧氯丙烷偶联法修饰L-Trp。(1)复合微球上引入羟基:将体积量是复合微球质量40倍的浓硝酸于70℃水浴下浸泡氧化2 h,清洗烘干后备用;(2)环氧氯丙烷(ECH)活化复合微球,通过羟基引入环氧基团(如图1(a)):将0.100 g样品与 20 mL DMSO,5 mL ECH,20 mL 1.4 mol·L-1的 NaOH 溶液混合均匀后于40℃下反应2 h;(3)偶联L-Trp(如图1(b)):0.6 g L-Trp,5 mL 1.4 mol·L-1NaOH,20 mL 0.1 mol·L-1碳酸钠-碳酸氢钠缓冲液超声混匀后加入ECH活化的样品,65℃下反应15 h,生理盐水、去离子水清洗至中性,60℃真空干燥24 h以上即得到修饰了L-Trp的CNTs/AC复合微球。
1.3 复合微球的表征
采用德国LEO-1530型热场发射扫描电子显微镜观察微球的形貌及EDS能谱定性分析微球的表面元素种类;采用美国Thermo Electron公司Sorptomatic 1990型分析仪在77 K下测定多孔微球的氮气吸脱附曲线,由脱附曲线用Barrett-Joyner-Halen(BJH)模型得到多孔微球的孔结构。采用美国PerkinElmer公司Spectrum Gx型傅立叶红外拉曼光谱仪 (分辨率:4 cm-1)、美国 TA Instruments公司Q5000IR型热重分析仪、美国PERKING-ELMER Physics Electronics公司的PHI5300型X射线光电子能谱表征复合微球的L-色氨酸的修饰效果。
采用北京瑞利分析仪器厂的UV9100型紫外-可见分光光度计测定L-色氨酸的浓度,制得L-色氨酸浓度-吸光度的标准曲线 (相关系数R2为0.999 6),而后得到 L-Trp 浓度 c(μg·mL-1)与吸光度 A 的关系为:

而后根据578 nm处测得的吸光度值,由式(1)计算得到不同碳纳米管加入量的复合微球所修饰的L-Trp 的浓度 c(μg·mL-1)。
1.4 复合微球对LDL的吸附实验
采用体外静态吸附法进行LDL吸附实验。将0.04 g不同CNTs加入量的L-CNTs/AC复合微球在生理盐水中充分浸泡24 h,然后吸干水分,加入1.0 mL左右的高LDL血清,于37℃下恒温振荡2 h。用日本7170型全自动生化分析仪测定吸附前、后血清中的LDL含量,吸附效果用吸附量(AQ(mg·g-1))来表征,其计算方法如式(2)。
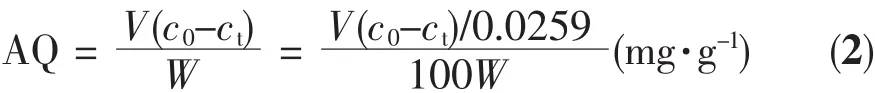
式中,c0—吸附前血清中LDL-C的浓度 (mmol·L-1);
ct—吸附后血清中 LDL-C 的浓度(mmol·L-1);
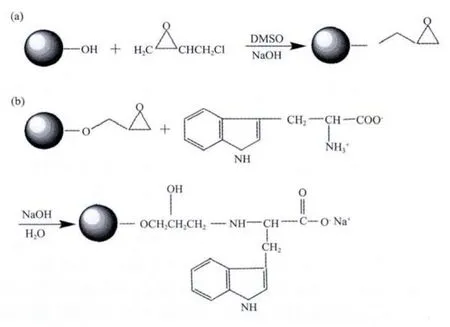
图1 CNTs/AC复合微球的环氧氯丙烷活化(a)及偶联L-Trp(b)Fig.1 Activation by epichlorohydrin(a)and coupling with L-Trp(b)of CNTs/ACcomposite beads
V—静态吸附中所加的血清量(mL);
W—静态吸附中所用吸附剂的质量(g)。
2 结果与讨论
2.1 复合微球的孔结构
以酚醛树脂为粘结剂的悬浮聚合法、炭化及活化法可制得球形度良好,粒径合适、强度适中的CNTs加入量高达45wt%的CNTs/AC复合微球,如图2(a)所示。
由图2(b)复合微球的孔径分布图可见,未加CNTs的酚醛基活性炭微球,中、大孔孔容极小;随着CNTs加入量的增加,中、大孔的孔容增大,尤其是20~100 nm的孔容显著增多。CNTs本身的堆积孔是复合微球中直径为20~100 nm孔形成的主要原因,如图2(c)所示。

图2 CNTs/AC复合微球的宏观形貌(a)孔径分布(b)及复合微球中CNTs形成的堆积孔(c)Fig.2 Morphology(a)pore size distribution(b)and aggregated pores of CNTs(c)of CNTs/ACcomposite beads
2.2 复合微球修饰的L-色氨酸
在修饰了L-Trp的复合微球微观形貌照片中可以看到复合微球的表面出现了针状物质 (如图3(a)所示),通过X射线能谱(图3(b))发现在复合微球表面上不仅含有较明显的氧元素,而且出现了氯元素,这应是ECH活化复合微球后在复合微球上存在的未偶联L-Trp的环氧基团。
图4为复合微球修饰L-Trp前后的傅立叶红外光谱图,修饰了L-Trp之后,由硝酸氧化得到羟基的吸收峰变弱了,这是因为羟基在ECH活化环节被环氧基活化了。而在3 434 cm-1处出现了一个较弱的吸收峰,这可能是引入环氧基团后的N-H伸缩振动峰。1 571 cm-1是石墨烯C的红外基频模,出现了明显的蓝移。1 698 cm-1处的吸收峰可能为N-酰化氨基酸的-C=O和羧酸中的羰基叠加峰[41];1 200 cm-1是C-O的伸缩振动;而742 cm-1为色氨酸的苯环邻位双取代峰[42]。这说明了复合微球表面修饰有LTrp。
从图5可以看出,修饰了L-Trp之后,300℃之后的失重比浓硝酸氧化态的复合微球有了明显的增大,这是因为300℃之后修饰上的L-Trp上的基团也参与了热分解造成的。
由复合微球的XPS全谱图(图6(a))可见,在修饰L-Trp之前,复合微球中没有氮(N)元素,偶联L-Trp后出现了明显的氮元素,且氧(O)元素的含量也增多。由XPS作表面元素半定量分析表明,修饰了LTrp的复合微球中表面元素nN/nC比为2.1/100。

图3 40wt%CNTs/AC复合微球修饰L-Trp后的微观形貌(a)及能谱图(b)Fig.3 Morphology(a)and energy spectra(b)of 40wt%L-CNTs/ACcomposite beads
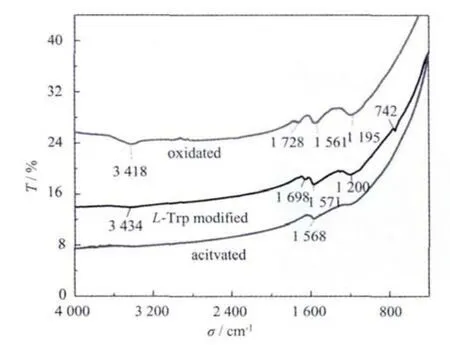
图4 30wt%CNTs/AC复合微球修饰L-Trp前后的傅立叶红外光谱Fig.4 Fourier transform infrared spectroscopy of 30wt%CNTs/ACcomposite beads
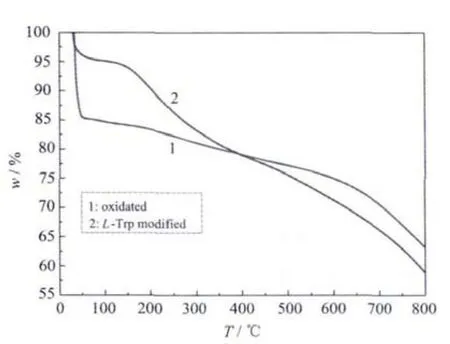
图5 30wt%CNTs/AC复合微球修饰L-Trp前后的热失重曲线Fig.5 Thermogravimetric curves of 30wt%CNTs/AC composite beads
将修饰了L-Trp的样品各元素的XPS窄谱进行计算机拟合分析,其中C1s的XPS峰可分解为:284.7,285.2,286.9 eV 及 288.0 eV(图 6(b)),分别归属于C-C,C-H,C-N,-COOH基团的C1s峰。由于修饰了L-Trp,使得C-C峰的比例仅有34.83%(如表1所示),C-H键的比例占多数,达58.41%。O1s的结合能为 532.5,533.0 eV(图 6(c)),分别是复合微球表面的C-OH和/或C-O-C基氧;N1s在400.4 eV(图6(d))的峰值是由于σ*(N-H)响应,而在406.3 eV处是由于σ*(N-C)的响应[43-44]。这些都表明了L-Trp已成功地偶联到复合微球上。
随着对复合微球的修饰处理 (活化-氧化-修饰基团),复合微球的晶化程度(R值)也在不断变化。30wt%CNTs/AC复合微球活化态的R值为2.378,氧化态的R值增大为2.467,而修饰了L-Trp之后,R值增大到2.473,这表明了复合微球的表面修饰(氧化处理、修饰L-Trp)会使复合微球的缺陷增多(R值增大)。这是因为氧化处理在复合微球表面引入了含氧官能团,修饰L-Trp的处理过程则引入了吲哚基团和羧基等,这些异质原子的引入使微球的缺陷增多,晶化程度下降,这样复合微球的表面活性增强,有利于吸附的进行[45]。
修饰处理不仅改变了复合微球的表面性质,而且对复合微球的强度也产生了一定的影响。由表2可见,修饰会使复合微球的强度受到损失,氧化处理使强度降低较严重,但修饰L-Trp的过程不会明显降低强度。总之表面修饰之后复合微球的强度是未修饰前的约50%,仍能满足血液灌流的要求(>5N)。
2.3 L-CNTs/AC复合微球对LDL的吸附性能
从图7中可以看出,L-CNTs/AC复合微球对LDL的吸附量随着CNTs加入量的增加而不断增大。当CNTs加入量达45wt%时(本文所制备复合微球的最高 CNTs加入量),LDL 吸附量达 4.623 mg·g-1,是未添加碳纳米管的2.3倍多,且LDL吸附能力还有随CNTs加入量增多而增大的趋势。
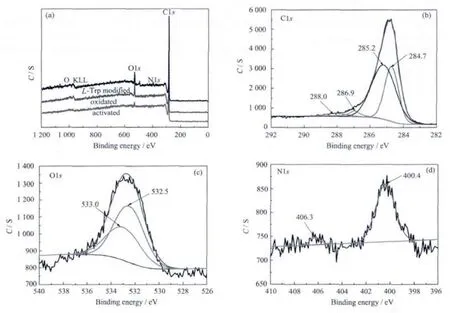
图6 修饰L-Trp的30wt%CNTs/AC复合微球的XPS全谱图(a)C1s(b)O1s(c)及N1s(d)Fig.6 Survey spectrum(a)C1s(b)O1s(c)and N1s(d)of 30wt%L-CNTs/ACcomposite beads by X-ray photoelectron spectroscopy
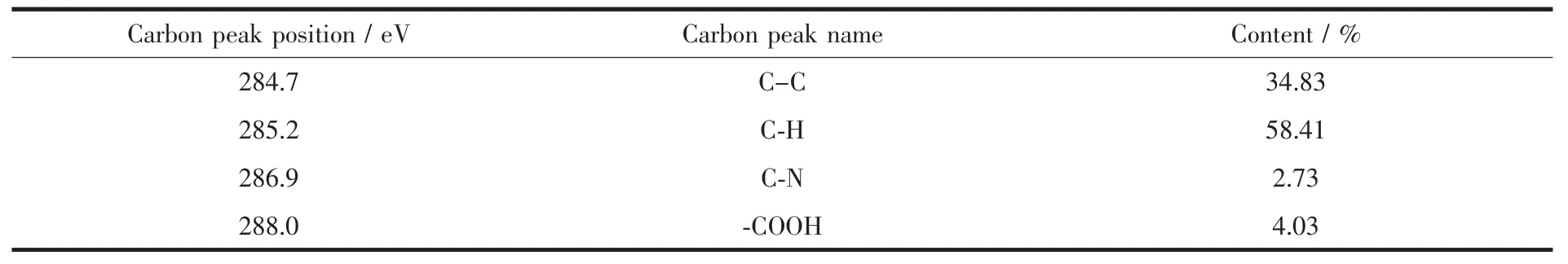
表1 修饰L-Trp的30wt%CNTs/AC复合微球碳峰的XPS半定量分析Table 1 XPSsemi-quantitative analysis about Carbon peaks of 30wt%L-CNTs/AC composite beads

表2 修饰处理对CNTs/AC复合微球抗压强度的影响Table 2 Effect of modification on the compressive strength of the CNTs/AC composite beads
L-CNTs/AC复合微球是依靠所修饰的L-Trp上的吲哚基团与LDL表面层的未酯化胆固醇区之间的疏水作用来识别并吸附LDL的,因此复合微球上配基的数量对复合微球吸附LDL来说是至关重要的。另外,由于LDL是一种大分子(18~25 nm的球形颗粒体),所以复合微球内部大中孔(20~100 nm)的孔容也是复合微球对LDL吸附能力的关键因素。
CNTs加入量的增多有利于复合微球上所能修饰上的配基-L-Trp修饰量的增大,当CNTs加入量为 0、10wt%、30wt%、40wt%、45wt%时, 所能修饰上L-Trp 的量分别为 4.8、4.9、5.1、5.6、6.0 μg·mL-1。 这是因为混酸处理的CNTs表面缺陷多,表面具有易于修饰。由于配基修饰量增大,复合微球的亲水性得到了明显改善 (修饰L-Trp后复合微球可充分浸泡于血清中,而修饰L-Trp前复合微球则是漂浮于血清之上),这有利于复合微球与LDL分子的充分接触,有利于增强与LDL之间的疏水作用力的发挥,对LDL吸附能力增强。另外,随着CNTs加入量的增加(>20wt%),复合微球中适合吸附LDL的孔容(20~100 nm)增多(如图 2(b)所示)。因此,此时复合微球对LDL的吸附能力显著增强。
总之,CNTs在复合微球吸附LDL的过程中起到了两个方面的重要作用 (如图8所示),一方面CNTs本身形成的堆积孔促进复合微球中20~100 nm孔的形成,这些中大孔在复合微球中互相连通,构建了通畅的LDL扩散通道,从而进一步促进LDL吸附过程的进行;另一方面CNTs又可作为配基的载体,促进L-Trp配基修饰量的增多,L-Trp上的吲哚基团通过疏水作用特异性吸附血清中LDL,从而促进LDL在CNTs堆积孔间的吸附。

表3 修饰配基对40wt%CNTs/AC复合微球孔结构的影响Table 3 Effect of modification on the pores structure of 40wt%CNTs/AC composite beads
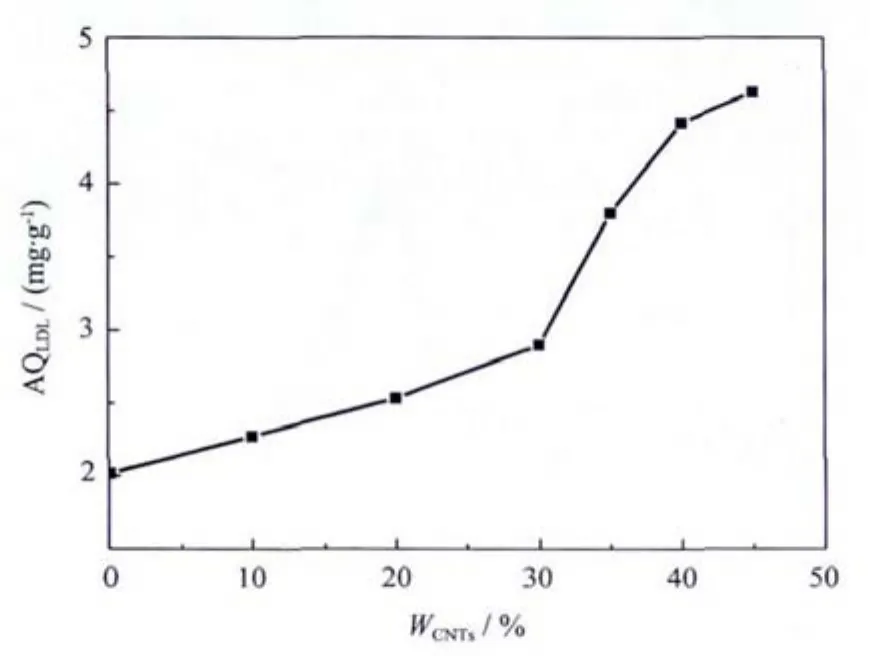
图7 不同CNTs加入量的修饰了L-Trp的复合微球对LDL的吸附量Fig.7 LDL adsorption amount on L-CNTs/ACcomposited beads with different CNTs mass ratio
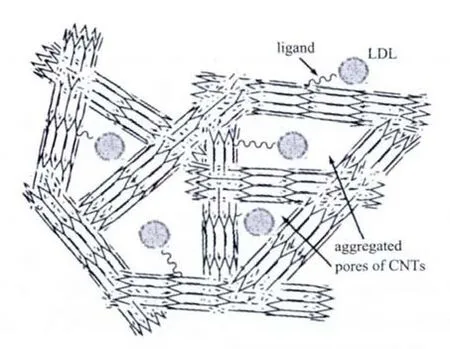
图8 CNTs在吸附LDL过程中所起作用示意图Fig.8 Role of CNTs in the process of LDL adsorption
但当CNTs加入量达40wt%以上时,LDL吸附量增长缓慢,这与修饰配基后复合微球孔结构发生变化有关:由于修饰处理不同程度地引入了异质原子,这些异质原子会占据原有孔腔的部分位置,从而使复合微球的各孔孔容均有所降低 (如图9所示)。40wt%L-CNTs/AC复合微球,L-Trp修饰量为5.6 μg·mL-1, 其中 20~100 nm 的孔容为 0.244 cm3·g-1,仅为活化态时的40%(如表3所示)。所以使LCNTs/AC复合微球在吸附LDL时的有效孔容减少。
因此CNTs含量高时,虽然一方面修饰的配基密度增大,促进LDL吸附量的增加,但另一方面由于配基占据了一定的孔隙位置,使得有效孔容增长幅度降低,从而使得LDL的吸附量增长减缓。但总的趋势仍是L-CNTs/AC复合微球对LDL的吸附能力随着CNTs加入量的增大而增强。
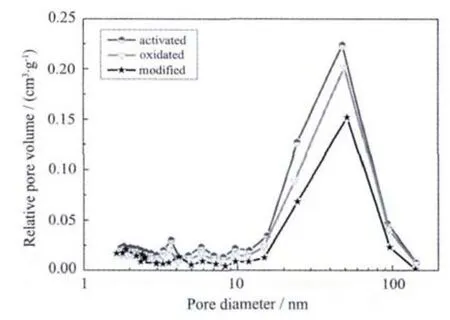
图9 修饰处理对40wt%CNTs/AC复合微球孔结构的影响Fig.9 Effect of modification on the pores structure of 40wt%CNTs/ACcomposite beads
3 结 论
(1)环氧氯丙烷偶联法可将L-Trp修饰至CNTs/AC复合微球上。
(2)CNTs/AC复合微球中CNTs加入量越多,对LDL的吸附能力越强;当CNTs加入量为45wt%时,LDL吸附量达4.623 mg·g-1,是未添加碳纳米管的2.3倍多。因此修饰了L-Trp的碳纳米管基复合微球在作为血液灌流LDL吸附剂方面有较好的应用前景。
(3)CNTs在复合微球吸附LDL的过程中起到了重要的作用,一方面由于本身的堆积孔促进了复合微球内中大孔的形成,构建了通畅的LDL扩散通道;另一方面促进了配基在复合微球表面修饰量的增多,增强了复合微球与LDL之间的作用。
(4)在今后的研究中还需进一步考察此复合材料对高密度脂蛋白及血液相容性的影响。
[1]Brown M S,Goldstein JL.Science,2006,311:1721-1723
[2]Rizzo M,Berneis K.Eur.J.Inter.Med.,2006,17:77-80
[3]WANG Jun-Jun(汪俊军),ZHANG Chun-Ni(张春妮),ZHUANG Yi-Yi(庄一义).Chin.J.Arterioscler.(Zhongguo Dongmai Yinghua Zazhi),2007,15(6):473-475
[4]Bambauer R.Ther.Apher.Dial.,2005,9:142-147
[5]Thompson GR.Atherosclerosis,2008,198:247-255
[6]Hevonoja T,Pentikinen M O,Hyvnen M T,et al.Biochim.Biophys.Aata,2000,1488:189-210
[7]Tasaki H,Yamashita K,Saito Y,et al.Ther.Apher.Dial.,2006,10(1):32-41
[8]Julius U,Parhofer KG,Heibges A,et al.J.Clin.Apher.,2007,22(4):215-223
[9]Wendler T,Schilling R,Lennertz A,et al.J.Clin.Apher.,2003,18(4):157-166
[10]Bosch T,Gahr S,Belschner U,et al.Ther.Apher.Dial.,2006,10(3):210-218
[11]WANGTao(王涛),WANG Wei-Chao(王为超),WANG Lian-Yong(王连永),et al.Chin.J.Biomed.Eng.(Zhongguo Shengwu Yixue Gongcheng Xuebao),2008,27(1):132-136
[12]Fu G Q,Li H Y,Yu H F,et al.R eact.Funct.Polym.,2006,66:239-246
[13]GUO Xian-Quan(郭贤权),SUN Yue(孙越),CHEN You-An(陈友安),et al.Chin.J.Biomed.Engin.(Zhongguo Shengwu Yixue Gongcheng Xuebao),2001,20(1):17-22
[14]Wang W C,Xie H,Sun L S,et al.Biomed.Mater.,2009,4:1-8
[15]YUAN Yi(袁毅),WANG Yan-Ming(王燕铭),YU Yao-Ting(俞耀庭).Ion Exchan.Adsorpt.(Lizi Jiaohuan Yu Xifu),2008,24(1):1-9
[16]Ma K W,Dai X Z,Feng S Y,et al.Transfus.Apher.Sci.,2011,44:3-9
[17]DANG Ying-Ping(党英萍),CAI Shao-Xi(蔡绍皙),MA Kai-Wang(麻开旺).Chin.J.Med.Phys.(ZhongguoYixue Wulixue Zazhi),2007,24(6):435-439
[18]ZHAO Hui(赵辉),CHEN Jing-Jing(陈晶晶),FANG Bo(方波),etal.J.Biomed.Eng.Res.(ShengwuYixue Gongcheng Yanjiu),2008,27(3):217-220
[19]YU Xi-Xun(余喜讯),LI Li(李莉),YUE Yi-Lun(乐以伦),et al.J.Biomed.Eng.(Shengwu Yixue Gongchengxue Zazhi),2004,21(4):582-586
[20]DING Yong(丁 勇 ),YANG Qing(杨 清 ),QI Wen-Qing(祈文卿).Pharm.Biotechnol.(Yaowu Shengwu Jishu),2009,16(5):463-464
[21]FU Guo-Qi(傅国旗),SHI Ke-Yu(石可瑜),YUAN Zhi(袁直),et al.Chin.Sci.Bull.(Kexue Tongbao),2003,48(17):1840-1843
[22]FU Guo-Qi(傅国旗),CHEN Xin-Fu(陈新福),YUAN Zhi(袁直),et al.Chem.J.Chinese Universities(Gaodeng Xuexiao Huaxue Xuebao),2004,25(6):1183-1185
[23]WANG Rui-Rui(王睿睿),ZHAO Hui(赵辉),XIA Chun-Lan(夏春岚),etal.Chem.World(HuaxueShijie),2008,5:262-263[24]CAO Ning-Ning(曹宁宁),YU Yao-Ting(俞耀庭),WANG Man-Yan(王满燕),et al.Chem.J.Chinese Universities(Gaodeng Xuexiao Huaxue Xuebao),2002,23(8):1524-1528
[25]CONG Hai-Xia(丛海霞),DU Long-Bing(杜龙兵),FANG Bo(方波),et al.J.Biomed.Eng.(Shengwu Yixue Gongchengxue Zazhi),2010,27(3):671-674
[26]YUAN Yi(袁毅),YU Yao-Ting(俞耀庭).Ion Exchan.Adsorpt.(Lizi Jiaohuan Yu Xifu),2003,19(1):49-54
[27]ZHAO Hui(赵 辉),FANG Bo(方 波),CHEN Jing-Jing(陈晶晶),et al.J.Biomed.Eng.(Shengwu Yixue Gongchengxue Zazhi),2009,26(5):1039-1042
[28]CUI Tao(崔 韬),CHENG Yan(程 焱),WANG Shen-Qi(王深琪),et al.Chin.J.Biomed.Eng.(ZhongguoShengwu Yixue Xuebao),2005,24(1):50-53
[29]HUANG Li(黄 丽),FANG Bo(方 波),ZHU Ye(朱 叶),et al.Chin.J.Hemorh.(Zhongguo Xueye Liubianxue Zazhi),2006,16(4):509-522
[30]WANG Rui-Rui(王睿睿),FANG Bo(方波),YANG Guang(杨光),et al.J.Biomed.Eng.(Shengwu Yixue Gongchengxue Zazhi),2009,26(3):585-589
[31]YE Chao(叶超).Thesis for the Doctorate of Tsinghua University(清华大学博士论文).2008.
[32]Firme CP,Bandaru PR.Nanomed.Nanotechnol.Biol.Med.,2010,6(2):245-256
[33]YUAN Li(袁丽).Thesis for the Master of Tianjin Normal University(天津师范大学硕士论文).2010.
[34]Wepasnick K A,Smith B A,Bitter JL,et al.Anal.Bioanal.Chem.,2010,396:1003-1014
[35]Balasubramanian K,Burghard M.Small,2005,1:180-192
[36]Wang Z,Shi Z,Gu Z.Chem.-Asian J.,2010,5:1030-1038
[37]KONG De-Jing(孔德静),SHEN Shui-Fa(沈水发),YU Hai-Yang(于海洋),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2010,26:817-821
[38]WANG Huan-Ying(王环颖),LI Wen-Jun(李文军),CHANG Zhi-Dong(常志东),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2011,27:269-275
[39]WU Zhen-Yi(吴振奕),YANG Sheng-Yan(杨绳岩).Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2011,27:1295-1301
[40]LU Yue-Mei(卢月美),GONG Qian-Ming(巩前明),LU Fang-Ping(卢方平),et al.Acta Chim.Sin.(Wuli Huaxue Xuebao),2011,27:683-688
[41]WANGZong-Hua(王宗花),LU Jie(陆捷),YAN Yong-Cheng(闫永臣),et al.J.Instru.Anal.(Fenxi Ceshi Xuebao),2007,26(1):62-65
[42]Defini D O,Solomon P H,Translated by WANG Xu-Ming(王绪明).Infrared spectroscopic analysis of 100 Cases(红外光谱分析100例).Beijing:Science Press,1984:128,153
[43]Graf N,Yegen E,Gross T,et al.Surf.Sci.,2009,603:2849-2860
[44]Zhang L,Zhang CH,Lian J Y.Biosens.Bioelectron.,2008,24:690-695
[45]Chaudhuri SN,Chaudhuri R A,Benner R E,et al.Compos.Struct.,2006,76:375-387

