肝星状细胞通过SDF-1/CXCR4轴诱导肝癌细胞上皮间质转分化并促进其侵袭
李四光,常远鸿,刘凯歌
(1.西安医学院临床医学院,陕西西安710021;2.西安市第四医院消化内科,陕西西安710004;3.西安医学院附属医院消化内科,陕西西安710077)
肝星状细胞(hepatic stellate cell,HSC)是肝脏正常或病理状态下细胞外基质的主要来源,有实验表明肝癌肿瘤微环境中的肝星状细胞可能促进肝癌细胞的增殖、侵袭与转移[1]。
SDF-1(stromal cell derived factor-1,基质细胞衍生因子-1)是Cys-X-Cys类趋化蛋白,在肿瘤细胞转移、归巢等方面有多重作用。细胞趋化因子受体CXCR4是SDF-1的特异性受体,相互为一配一的唯一性配体/受体关系[2]。SDF-1结合激活CXCR4后使细胞肌动蛋白丝聚合,形成假伪足,定向迁移侵袭。许多恶性肿瘤中均有CXCR4异常表达[3]。有研究揭示,CXCR4在肝癌组织中异常高表达,且与预后明确相关[4];而活化的肝星状细胞是SDF-1的主要来源[5]。本研究拟通过肝星状细胞与肝癌细胞共培养的模型,进一步研究肝星状细胞通过SDF-1/CXCR4轴对肝癌细胞侵袭的作用与机制。
1 材料与方法
1.1 材料
人肝细胞癌细胞系 MHCC97、SMMC7721、Hep3B、HepG2和人肝星状细胞系LX02由西安交通大学医学院中心实验室保存。四甲基偶氮唑盐(MTT)/二甲基亚砜(DMSO)(Sigma公司)。聚偏二氟乙烯膜(PVDF膜),Transwell小室(Milliproe公司)。鼠抗人p-REK、鼠抗人t-ERK抗体及鼠抗人β-actin(Signal公司),兔抗人 CXCR4抗体,兔抗人E-cadherin及兔抗人Vimentin抗体(Santa Cruz公司),HRP标记山羊抗兔IgG二抗(北京中衫金桥公司)。转染试剂 Lipofectamine 2000(Invitrogen公司),G418(Gibico公司)。PCR引物(于上海生工公司合成),real-time PCR试剂体系(TaKaRa公司)。质粒载体PRNAT-U6.1/Neo-CXCR4-shRNA(西安交通大学医学院第一附属医院王铮副教授馈赠)。
1.2 Westen blot检测蛋白表达
选择生长良好的细胞,提取细胞总蛋白。SDSPAGE凝胶电泳后转至PVDF膜。5%脱脂牛奶室温封闭1 h。加一抗稀释液4℃孵育过夜。洗膜后加入二抗稀释液室温孵育1 h。ECL化学发光,胶片暗室显影并扫描记录分析。蛋白表达以吸光度表示,以目的蛋白/内参蛋白β-actin表示蛋白的相对表达量。
1.3 Real-time RT-PCR检测mRNA转录
用Trizol-氯仿-异丙醇法提取各组细胞总RNA。取5 μg按反转录试剂盒说明反转录为 cDNA。以cDNA为模板PCR扩增CXCR4,以GAPDH为内参照。各目的基因引物序列如下:CXCR4:5'-CTGCG AGCAGAGGGTCCAG-3',5'-ATGAATGTCCACCTCGC TT-3';E-钙黏附蛋白:5'-ATTCTGATTCTGCTGCTCT TG-3',5'-AGTCCTGGTCCTCTTCTCC-3';波形蛋白:5'-AATGACCGCTTCGCCAAC-3',5'-CCGCATCTCCT CCTCGTAG-3';甘油醛-3-磷酸脱氢酶:5'-GTAAAG ACCTCTATGCCATCA-3',5'-GGACTCATCGTACTCC TGCT3-3'。实时定量PCR在Bio-Rad公司Real time PCR仪上进行。PCR反应条件:预变性94℃ 5 s,94 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s共40个循环;溶解曲线条件:95℃ 15 s,60℃ 30 s,95℃ 15 s。基因相对表达水平通过2ΔΔ法计算。
1.4 细胞培养与转染
参照Lipofectamine2000转染试剂盒说明书进行转染。转染前取对数生长期的细胞进行消化,用含10%胎牛血清无抗生素的PRIM-1640培养基调整细胞数为4×105/mL,以0.5 mL/孔于24孔培养板培养过夜,约75%细胞汇合后进行转染。瞬时转染48 h后细胞按1∶6接种于 6孔板,并加600 μg/mL G418进行稳定转染筛选。14 d后出现多个G418抗性的集落,由于质粒带有绿色荧光蛋白GFP,在荧光显微镜下可见绿色荧光的阳性集落。显微镜下,用移液器枪头吸取少量胰蛋白酶后挑取带绿色荧光的单个集落。挑取的集落移入24孔培养板,G418维持培养,经过4周可以获得稳定转染的细胞集落。对细胞进行单集落的筛选并扩大培养后,镜下可见稳定转染的细胞90%以上表达绿色荧光蛋白。
1.5 肝癌细胞、肝星状细胞直接共培养和Transwell小室侵袭实验
取生长良好的LX02细胞,消化后按5×104个细胞/mL的浓度500 μL接种24孔板内。以预冷的RPMI-1640 与 Matrigel胶1∶1稀释后,取100 μL稀释胶加到Transwell上层小室中,于37℃孵育6 h。收集各组肝癌细胞,消化成单细胞悬液,用含1%胎牛血清的RPMI-1640培养基重悬,按5×104个/mL的浓度100 μL接种于Transwell上层小室。下室分别为含10%胎牛血清的正常培养液,含10%胎牛血清的正常培养液加100 ng/mL SDF-1,或2.5×104个LX02细胞。置于37℃,5%CO2的培养箱中培养12 h。用棉签沾PBS轻轻地擦去小室上层聚碳酸酯膜上贴壁生长但未能穿过膜的细胞。将膜取出放入预先装有95%乙醇的24孔板内固定10 min。吸弃乙醇,加0.1%的结晶紫染色30 min,用PBS小心洗去多余的染料,翻转聚碳酸酯膜,小心撕下,晾干,置载玻片上加中性树胶盖玻片封片。在200倍放大倍数下随机观察并计10个视野内穿过聚碳酸酯膜的细胞数,照相记录。重复3次。
1.6 统计学分析
2 结果
2.1 SDF-1及配体CXCR4在肝星状细胞和肝癌细胞中的表达
肝星状细胞LX02中有SDF-1蛋白强烈表达而其配体CXCR4蛋白不表达;4株肝细胞癌细胞系均不表达或微弱表达SDF-1蛋白,但CXCR4蛋白均有较强程度的表达上调,其中HepG2细胞表达水平最高(图1A)。肝星状细胞SDF-1 mRNA高表达而CXCR4 mRNA几乎不表达,相反4株肝细胞癌细胞系有不同程度的CXCR4表达上调而SDF-1均不表达或微弱表达(图1B),检测结果与Western blot相符。肝细胞癌细胞系 MHCC97、SMMC7721、Hep3B、HepG2和肝星状细胞LX02中SDF-1 mRNA的相对表达量分别为1.000±0.002、2.421±0.467、1.740±0.073、2.882±0.605和30.079±2.011,4株肝癌细胞系与星状细胞系具有显著差异(P<0.05);CXCR4 mRNA的相对表达量分别为1.797±0.214、2.130±0.210、1.033 ±0.058、5.216 ±0.642 和0.080±0.026,4株肝癌细胞系与星状细胞系有显著差异(P<0.05)。
2.2 肝星状细胞LX02促进肝癌细胞的侵袭
10%胎牛血清、10%胎牛血清+基质细胞衍生因子-1和10%胎牛血清+LX02组HepG2细胞穿过Transwell小室的细胞数分别为49±16、171±22和155±13个,组间差异显著(P<0.05)。
2.3 肝星状细胞LX02诱导肝癌细胞EMT
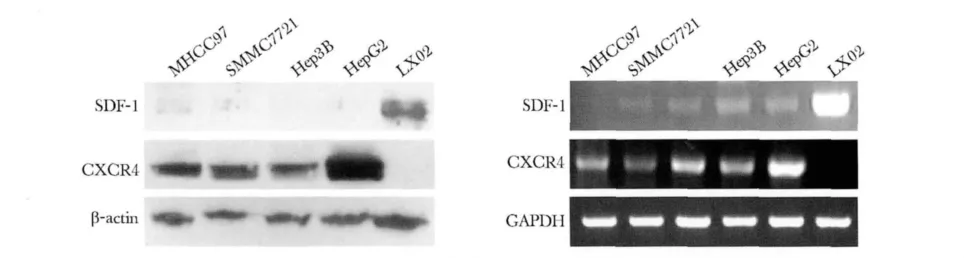
图1 SDF-1及其唯一配体CXCR4在肝星状细胞和肝癌细胞中的表达Fig 1 The expressions of SDF-1 and its receptor CXCR4 in hepatic stellate cell and hepatocellular carcinoma cells

图2 肝星状细胞LX02诱导肝癌细胞EMT并促进侵袭Fig 2 Hepatic stellate cell LX02 induces hepatocellular carcinoma cell EMT and invasion(×400)
加入外源性SDF-1干预或LX02细胞培养上清液间接共培养HepG2细胞24 h,SDF-1干预和LX02共培养组的HepG2细胞的磷酸化ERK比正常对照组显著上调(P<0.05)。较正常对照组,SDF-1干预和LX02共培养组E-cadherin蛋白明显上调(P<0.05),vimentin蛋白显著下调(P<0.05)(图2)。
2.4 RNA干扰载体靶向沉默肝癌细胞HepG2 CXCR4表达
为了进一步验证LX02诱导肝癌细胞EMT并促进其侵袭是通SDF-1/CXCR4轴进行的,构建了靶向CXCR4沉默的HepG2细胞。干扰片段正义链:5'-GATCCGTGAGAAGCATGACGGACAATTCAAGAG ATTGTCCGTCATGCTTCTCATTTTTGGAAA-3',反 义链:5'-AGCTTTTCCAAAAAATGAGAAGCATGACGGA CAATCTCTTGAATTGTCCGTCATGCTTCTCACG-3';作为对照的空载体上是负对照无关序列。经G418筛选稳定转染细胞系后,对CXCR4沉默进行验证。Western blot结果及同时进行的real-time PCR结果(图3A,B)。
2.5 肝星状细胞LX02诱导肝癌细胞EMT并促进侵袭依赖于SDF-1/CXCR4轴
在Transwell小室10%胎牛血清、10%胎牛血清+基质细胞衍生因子-1或10%胎牛血清+肝星状细胞LX02趋化作用下,HepG2-Vector穿膜细胞数差异显著(P<0.05);与此同时,HepG2-CXCR4-穿膜细胞数无显著差异(图3C,D)。提取细胞总蛋白,经Western blot检测结果与提取细胞mRNA,经RT-PCR检测结果(图3E,F)。
3 讨论
恶性肿瘤的侵袭、转移与肿瘤周围的其他细胞的组织结构、功能和代谢有关。在肿瘤微环境中,成纤维细胞是肿瘤间质的主要成分,而在肝癌组织中,成纤维细胞的主要来源是肝星状细胞。体外实验证实活化的肝星状细胞可促进肝癌细胞的增殖和转移,而肝癌细胞又能促进肝星状细胞的活化和增殖,最终加速肝癌的进程[6]。但肝癌细胞和肝星状细胞两者之间的关系,特别是体内相互作用及其机制尚需进一步研究。本研究通过Transwell细胞侵袭实验发现,星状细胞能显著增强肝癌细胞的侵袭能力。
肿瘤细胞上皮-间质转化(epithelial-mesenchymal transition,EMT)是启动恶性肿瘤侵袭转移的重要途径之一,最终导致细胞活性和侵袭性增强[7]。EMT取决于局部肿瘤微环境与信号分子的作用,趋化因子SDF-1/CXCR4轴激活所诱导的肿瘤细胞侵袭的一个重要机制可能就是诱导了细胞EMT[8-9]。本实验发现,肝星状细胞和外源性SDF-1均可导致肝癌细胞上皮标志蛋白E-cadherin的丢失和间质标志蛋白vimentin的获得,提示星状细胞通过SDF-1/CXCR4轴诱导肝癌细胞侵袭的机制可能与诱导癌细胞发生EMT有关。
Transwell实验结果说明,对于对照组细胞HepG2-Vector,在外源性SDF-1或星状细胞LX02趋化下,均能诱导其侵袭增强;而CXCR4干扰的细胞HepG2-CXCR4,无论是给予SDF-1或是星状细胞LX02趋化,其迁移穿过小孔和穿透Matrigel胶的能力没有明显的变化。因此可以认为,肝星状细胞促进肝癌细胞侵袭的过程可能依赖于趋化因子SDF-1/CXCR4轴。

图3 肝星状细胞LX02诱导肝癌细胞EMT并促进侵袭依赖于SDF-1/CXCR4轴Fig 3 Hepatic stellate cell LX02 induces hepatocellular carcinoma cell EMT and invasion independing with SDF-1/CXCR4 axis
通过Western blot和RT-PCR发现,CXCR4沉默的细胞在外源性SDF-1或星状细胞刺激下,其上皮标志蛋白E-cadherin和间质标志蛋白vimentin没有明显变化;而对照组细胞E-cadherin下调vimentin上调,显示了肝癌细胞在星状细胞刺激下发生EMT的过程。表明肝星状细胞通过SDF-1/CXCR4轴促进诱导肝癌细胞侵袭可能与诱导其EMT转化有关。
综上所述,本研究验证了肝星状细胞通过趋化因子SDF-1/CXCR4轴诱导肝癌细胞侵袭和EMT,揭示了肝星状细胞在肝癌进程中的影响,为原发性肝癌发展转移机制和治疗研究提供新依据,为原发性肝癌的预防、治疗探索新靶点。
[1]Yang JD,Nakamura I,Roberts LR.The tumor microenvironment in hepatocellular carcinoma:current status and therapeutic targets[J].Semin Cancer Biol,2011,21:35 -43.
[2]Juarez J,Bendall L,Bradstock K.Chemokines and their receptors as therapeutic targets:the role of the SDF-1/CXCR4 axis[J].Curr Pharm Des,2004,10:1245 -1259.
[3]Sun X,Cheng G,Hao M,et al.CXCL12/CXCR4/CXCR7 chemokine axis and cancer progression[J].Cancer Metastasis Rev,2010,29:709 -722.
[4]施国英,施德金,吕伟标,等.基质细胞衍化生长因子-1及其受体CXCR4在肝细胞癌和肝硬化中的表达[J].中华肝脏病杂志,2007,15:276-278.
[5]Liu H,Pan Z,Li A,et al.Roles of chemokine receptor 4(CXCR4)and chemokine ligand 12(CXCL12)in metastasis of hepatocellular carcinoma cells[J].Cell Mol Immunol,2008,5:373 -378.
[6]王伟,官阳,杨木兰,等.活化肝星状细胞与肝细胞肝癌发生及转移的相关性[J].临床与实验病理学杂志,2007,492 -494.
[7]Singh A,Settleman J.EMT,cancer stem cells and drug resistance:an emerging axis of evil in the war on cancer[J].Oncogene,2010,29:4741 -4751.
[8]Mimeault M,Batra SK.Frequent gene products and molecular pathways altered in prostate cancer-and metastasis-initiating cells and their progenies and novel promising multitargeted therapies[J].Mol Med,2011,17:949 -964.
[9]Li X,Ma Q,Xu Q,et al.SDF-1/CXCR4 signaling induces pancreatic cancer cell invasion and epithelial-mesenchymal transition in vitro through non-canonical activation of Hedgehog pathway[J].Cancer Lett,2012,322:169-176.

