环草石斛化学成分研究*
李春燕,陆 羽,陈 烨,郑嘉雯,王 军
(中山大学药学院,广东广州 510006)
兰科石斛属Dendrobium SW.植物全世界约有1 100种,我国境内有76种,其中有近40种被作为药用[1],用于治疗胃阴不足,病后虚热不退,目暗不明等症[2]。在治疗糖尿病及老年性疾病的方剂中,石斛常是主要成分[3-5]。由于石斛的药效及广泛用途,成为药用植物的研究热点,得到国内外学者的关注[6]。
环草石斛也叫小环钗石斛、美花石斛、粉花石斛,主要分布于贵州、广西、云南和广东等省,被2000版中国药典收载。因金钗石斛,铁皮石斛等价格昂贵,中医临床所使用的石斛多是环草石斛或黄草石斛。关于环草石斛的化学成分研究较少,李满飞等[7]从环草石斛的HCl(φ=1%)浸提液中分离到了有抑制大鼠肾脏微粒体活性的石斛宁生物碱;秦海林等[8]部分归属了环草石斛特征性标准提取物 (SCE)乙醚萃取部位的1H NMR指纹图谱;Ito等[9]研究了环草石斛φ=80%醇提液的化学组成,找到了具清除自由基活性及NO生成抑制活性的新结构芪类。
我们在研究中药药效成分的工作中发现,约有50%的环草石斛醇取物分配在大极性的正丁醇萃取部位,而已报道的关于环草石斛化学成分的研究大都集中在石油醚、乙酸乙酯等中小极性萃取部位。为了阐明环草石斛的药效物质基础,本研究对环草石斛甲醇提取液进行了系统的化学成分研究,利用现代色谱技术和波谱技术分离鉴定了7个化合物,分别是:石斛宁 (1),2,4,7-三羟基-9,10-二氢菲 (2),moscatin(3),loddigesiinols C(4),杓唇石斛酚 (5),石斛酚 (6),tristin(7),其结构见图1。其中化合物2和7为首次在环草石斛中分离得到,对环草石斛的药效成分进行了初步探讨。

图1 分自环草石斛的化合物分子结构Fig.1 Structures of compounds from Dendrobium loddigesii
1 材料与方法
1.1 实验试剂与仪器
实验试剂:石油醚、乙酸乙酯、甲醇、二氯甲烷、丙酮等为分析纯试剂,氘代试剂为美国CIL产品;TLC硅胶 (GF254)和柱层析硅胶 (200~300目)均为青岛海洋化工有限公司产品,Sephadex LH-20凝胶为美国GE Healthcare产品,反相硅胶ODS-A为日本Daiso公司产品。环草石斛 (茎)D.loddigesiiRolfe于2011年9月购自广州采芝林药店,该药材产自云南,广州市药材公司中药饮片厂监制,由中山大学药学院蒋林研究员鉴定。
实验仪器:日本岛津LC-20AT中压液相制备色谱,Bruker AvanceШ 400 MHz核磁共振谱仪,LCQ DECA XP型液相色谱-质谱联用仪,美国Perkin Eimer TM公司Perkin Eimer 341型比旋光测定仪。
1.2 提取与分离
环草石斛 (茎)4 kg,甲醇冷浸 (35 L ×2),减压浓缩提取液得浸膏100 g。将浸膏悬浮于水中,依次用石油醚、氯仿、乙酸乙酯及正丁醇萃取 (3 L×3),减压浓缩萃取液,分别得石油醚萃取浸膏13 g,氯仿萃取浸膏25 g,乙酸乙酯萃取浸膏10 g,正丁醇萃取浸膏47 g,水溶层浸膏16 g。
氯仿萃取浸膏经Sephadex LH-20凝胶柱层析,甲醇洗脱,脱去叶绿素后,用硅胶 (200~300目)柱色谱分离,以石油醚-乙酸乙酯 (体积比为 100∶0、90∶1 、80∶20 、70∶30 、50∶50、40∶60、10∶90和0∶100)混合溶剂梯度洗脱,得到8个馏分 (Fr.L1~8)。Fr.L5~6合并 (6 g),经中压液相色谱系统分离,固定相为ODS反相键合硅胶,水-甲醇混合溶剂梯度洗脱,分段收集,在V(水)∶V(甲醇)=50∶50段得化合物 5,V(水)∶V(甲醇)=45∶55段分别得化合物6、化合物4,V(水)∶V(甲醇)=40∶60段得化合物3,各馏份分别进一步经Sephadex LH-20凝胶柱色谱纯化,甲醇洗脱,得到相应的纯化合物。Fr.L 7与乙酸乙酯萃取部位合并,用硅胶 (200~300目)柱色谱分离,以石油醚-乙酸乙酯 (体积比为100∶0、90∶1 、80∶20,70∶30 、50∶50、30∶70、20∶80和0∶100)混合溶剂梯度洗脱,得到8个馏分 (Fr.Y1~8)。Fr.Y6~7合并(3 g),经中压液相色谱系统纯化,固定相为ODS反相键合硅胶,以水-甲醇混合溶剂梯度洗脱,收集V(水)∶V(甲醇)=70∶30段馏份,得化合物2,继续收集V(水)∶V(甲醇)=60∶40段馏份得化合物7,各段馏份分别再经Sephadex LH-20凝胶柱色谱多次纯化,甲醇洗脱,得相应的纯化合物。正丁醇萃取浸膏,经Sephadex LH-20凝胶柱色谱除糖,甲醇洗脱,再经正相硅胶柱色谱分离,V(二氯甲烷)∶V(甲醇)=25∶1混合溶剂等度洗脱,得到化合物1。
2 结构鉴定
化合物1,淡黄色油状液体,易溶于乙酸乙酯、甲醇等。ESI-MSm/z:204.3[M+H],分子式 C12H13NO2,不饱和度为 7。1H NMR(400 MHz,CDCl3)δ:7.87(1H,d,7.2 Hz),7.71(1H,t,7.2 Hz),7.57(1H,t,7.2 Hz),7.47(1H,d,7.2 Hz),3.39(1H,m),3.07(1H,m),2.46(1H,m),2.38(1H,m),2.14(2H,m),2.13(3H,s),与文献 [10]对照,鉴定化合物1为石斛宁。
化合物2,白色片状结晶,易溶于丙酮。ESI-MSm/z:227.3[M-H],分子式C14H12O3,不饱和度为 9。1H NMR(400 MHz,aceton-d6)δ:8.25(1H,d,8 Hz),6.74(1H,dd,1.2,8 Hz),6.73(1H,d,1.2 Hz),6.44(1H,d,1.2 Hz),6.34(1H,d,1.2 Hz),2.63(4H,s),与文献[11]对照,鉴定化合物2为2,4,7-三羟基-9,10-二氢菲。
化合物3,白色粉末状结晶,易溶于丙酮。ESI-MSm/z:239.2[M -H],分子式 C15H12O3,不饱和度为 10。1H NMR(400 MHz,aceton-d6)δ:7.63(1H,d,8.8 Hz),7.50(1H,d,8.8 Hz),7.44(1H,t,8.8 Hz),7.40(1H,dd,8.8,1.6 Hz),7.14(1H,dd,8.8,1.6 Hz),7.10(1H,d,1.6 Hz),7.02(1H,d,1.6 Hz),4.15(3H,s)。与文献 [12]对照,鉴定化合物3为moscatin。
化合物4,无定形白色固体,易溶于氯仿、丙酮、甲醇等。ESI-MSm/z:333.1[M-H],分子式C18H22O6,不饱和度为8。 [α]27D-0.6°(c=1.0,MeOH)。1H NMR(400 MHz,CDCl3)δ:6.78(1H,d,7.8 Hz),6.59(1H,dd,7.8,1.5 Hz),6.49(1H,d,1.5 Hz),6.41(2H,s),4.17(1H,t,6.6 Hz),3.82(6H,s),3.76(3H,s),3.20(3H,s),3.02(1H,dd,6.9,13.3 Hz),2.76(1H,dd,6,13.6 Hz)。与文献 [9]对照,鉴定化合物4为loddigesiinols C。
化合物5,白色针状结晶,易溶于氯仿、丙酮、甲醇等。ESI-MSm/z:305.1[M+H],分子式C17H20O5,不 饱 和 度 为 8。1H NMR(400 MHz,CDCl3)δ:6.81(1H,d,8 Hz),6.66(1H,dd,1.6,8 Hz),6.59(1H,dd,1.6 Hz),6.34(2H,s),3.82(6H,s),3.81(3H,s),2.79(4H,s)。与文献[8]对照,鉴定化合物5为杓唇石斛酚。
化合物6,淡黄色油状物,易溶于氯仿、丙酮、甲醇等。ESI-MSm/z:273.2[M-H],分子式 C16H18O4,不饱和度为 8。1H NMR(400 MHz,CDCl3)δ:6.81(1H,d,8 Hz),6.65(1H,dd,8,1.6 Hz),6.60(1H,d,1.6 Hz),6.29(1H,d,1.6 Hz),6.23(2H,d,1.6 Hz),3.82(3H,s),3.72(3H,s),2.78(4H,s)。与文献 [8]对照,鉴定化合物6为gigantol。
化合物7,无色针状结晶,易溶于丙酮。ESIMSm/z:259.2[M-H],分子式C15H16O4,不饱和度为 8。1H NMR(400 MHz,aceton-d6)δ:6.79(1H,d,1.6 Hz),6.70(1H,d,8 Hz),6.61(1H,dd,1.6,8 Hz),6.21(2H,d,1.6 Hz),6.19(1H,d,1.6 Hz),3.79(3H,s),2.75(4H,m)。与文献[13]对照,鉴定化合物7为tristin。
3 结果与讨论
研究对环草石斛的甲醇提取物进行了较系统的分离,单离到6个多酚和1个生物碱 (化合物结构式见图1),化合物1,2,3,4,5,6,7(w/%)分 别 为 0.062,0.010,0.001,0.001,0.025,0.001,0.003,其中化合物2和7为首次在环草石斛中发现的芪类化合物。
本研究从环草石斛的正丁醇萃取部位单离到大量的石斛宁生物碱,从4 kg药材中分到2.5 g多纯品 (纯度为99%);进一步用1H NMR技术研究环草石斛正丁醇萃取物,结果显示,低场δ 8.5~7.5有强的石斛宁及类似结构化合物的共振信号 (见图2),可推出石斛宁或类似结构的生物碱为环草石斛的主要化学成分,故环草石斛属含生物碱较多的优质石斛药材[14];环草石斛中等极性部位的化学成份主要是联苄、9,10-二氢菲、菲等多酚类物质,5在其中含量最多,其次是化合物2。
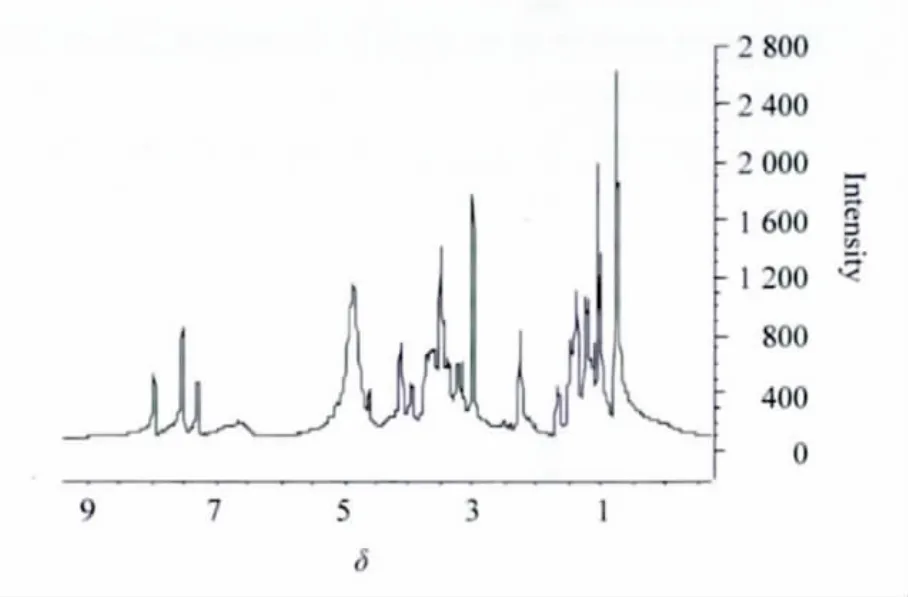
图2 环草石斛正丁醇萃取部位1H NMR谱(400 MHz,Methanol-d4)Fig.2 1H NMR spectrum of the extract from Dendrobium loddigesii with n-BuOH
石斛宁目前只在兰科植物中发现,对兰科植物的化学分类学有重要意义[15]。已有研究报道石斛宁能抑制大鼠肾脏微粒体Na-K-ATP酶[8],这一药理活性与石斛在中医临床上滋阴清热的功效是相吻合的,因此石斛宁可被认为是石斛滋阴清热的药效成分之一。芪类化合物具有广泛的抗血小板聚集、抗炎、抗肿瘤、抗畸变、抗氧化、细胞凋亡等活性[16-18],这些结构多样性的芪类化合物,与中医认为石斛具有抗衰老功效相吻合。
4 结论
本研究得出环草石斛中生物碱和芪类化合物的含量非常丰富,且有较多的结构多样性。深入研究环草石斛的活性成分,可为阐明其成份-药效的关系提供科学依据,也可为石斛所制成的中成药质量控制提供依据。
[1]武荣,栗燕.石斛资源保护研究进展[J].河南农业科学,2009,12:9 -15.
[2]国家药典委员会编.中华人民共和国药典(第一部)[M].北京:中国医药科技出版社.2010.
[3]林雅,余文珍,郑燕芳,等.石斛合剂对糖尿病大鼠模型血糖血脂代谢的影响[J].福建中医药大学,2012,22(3):22-25.
[4]李长征,余文珍,蒋艺燕,等.石斛合剂对糖尿病大鼠肾脏的保护作用[J].福建中医药大学学报,2012,22(3):18-23.
[5]黄江丽.石斛夜光丸合复方血栓通胶囊治疗中心性浆液性脉络膜视网膜病变[J].光明中医,2008,23(12):1934-1937.
[6]明兴加,伍淳操,钟国跃,等.中国石斛属植物文献计量研究[J].中国实验方剂学杂志,2010,16(14):221-226.
[7]李满飞,甘平,田羲正.粉花石斛化学成分研究[J].药学学报,1991,26(4):307 -310.
[8]秦海林,张建新,郝小江,等.环草石斛的1H-NMR指纹图谱解析[J].中国中药杂志,2002,27(12):919-924.
[9]ITO M,MATSUZAKI K,WANG J,et al.New phenanthrenes and stilbenes fromDendrobium loddigesii[J].Chem Pharm Bull,2010,58(5):628 -633.
[10]KAWANISHI K,UHARA Y,HASHIMOTO Y.Shihunine and dihydroshihunine fromBanisteriopsis caapi[J].J Nat Prod,1982,45(5):637-639.
[11]张朝凤,邵莉,黄卫华,等.兜唇石斛酚类化学成分研究[J].中国中药杂志,2008,33(24):2922-2925.
[12]李玉鹏,蒋金和,刘莹,等.金钗石斛化学成分的研究[J].时珍国医国药,2010,21(1):39 -42
[13]张婷,张朝凤,王峥涛,等.翅梗石斛的化学成分研究[J].中国天然药物,2005,3(1):28-32.
[14]魏小勇.石斛属植物生物碱研究进展[J].中国药事,2005,19(7):445 -447.
[15]BASTIDA J,SELLES M,CODINA C,et al.Alkaloids fromBehria tenuiflora[J].Planta Medica,1996,62(6):575-577.
[16]TSAI A C,PAN S L,LIAO C H,et al.Moscatilin,a bibenzyl derivative from the Indiaorchid Dendrobrium loddigesii,suppresses tumor angiogenesis and growth in vitro andin vivo[J].Cancer Letters,2010,292:163 -170.
[17]MIYAZAWA M,SHIMAMURA H,NAKAMURA S,et al.Moscatilin fromDendrobium nobile,a naturally occurring bibenzyl compound with potential antimutagenic activity[J].J Agric Food Chem,1999,47:2163 -2167.
[18]CHEN T H,PAN S L,GUH J H,et al.Moscatilin induces apoptosis in human colorectal cancer cells:A crucial role of c-Jun NH 2-terminal protein kinase activation caused by tubulin depolymerization and DNA damage[J].Clin Cancer Res,2008,14:4250 -4258.

