腹腔镜直肠癌前切除术技术难度影响因素分析
鲁信军,李俊杰,李 霄
直肠癌是世界范围内的最为常见的恶性肿瘤之一,且发病率呈逐年上升趋势[1]。主要治疗方式为外科手术切除并辅助放、化疗。随着微创技术的发展,腹腔镜手术已成为结肠癌的标准术式,但在直肠癌中的应用并不广泛且有较多争议,主要原因为腹腔镜直肠癌切除的技术要求高、手术时间长,且存在戳孔转移、切缘阳性率高、吻合口瘘等并发症发生风险高等问题[2-5];但腹腔镜手术创伤小,术后通气早、康复快、痛苦少[6-8],且并发症总体发生率与开腹手术相比差异并无统计学意义[9],因而逐渐成为普外科医师研究和探讨的热点。本文回顾性分析76例采用双吻合器技术实施腹腔镜直肠癌前切除术患者的临床资料,探讨与腹腔镜直肠癌前切除术技术难度相关的影响因素。
1 资料与方法
1.1 病例资料 入选病例均来自安康市中医院2005年1月—2011年12月收治的住院患者,共76例。男50 例(65.8%),女 26 例(34.2%);中位年龄57岁(38~76岁)。所有患者术前均经肠镜病理检查确诊为直肠腺癌。术前检查示肿瘤直径为11~75 mm,中位值38 mm;癌灶下缘距肛门距离为4.2 ~13.1 cm,中位值8.5 cm。按照肿瘤距肛门边缘的距离,将入组患者分为上段癌(距肛门10 cm以上)和中下段癌(距肛门10 cm及以下)两组。按Duke's分期方法,A期17例,B期24例,C期35例。术前出现邻近组织转移或浸润深度较深,被诊断为进展期的患者接受术前放疗。
1.2 手术方法 所有手术均由同一位医师操作完成,避免因术者的经验和习惯造成结果差异。手术过程:CO2气腹形成后,在左、右上腹部和下腹部插入4个穿刺(Trocar)口,分别插入腹腔镜、超声刀、抓钳或吸引器等设备。探察腹腔整体情况后,将左结肠推开并在乙状结肠预断处作结扎牵引。小心游离结直肠系膜,小血管以超声刀固化,较大的血管可用钛夹夹闭后再以超声刀离断,而直肠上动静脉等可用直线切割缝合器(ethicon endo-surgery,cincinnati,OH)直接夹闭切断。将结直肠系膜充分游离后,以OH在距肿瘤下缘2 cm处切断下段直肠,装入无菌塑料袋。将左下腹穿刺口扩大为5 cm,将切除肠段拉出体外并切断乙状结肠。在近端结肠断端内置入33#吻合器头座,荷包固定后放回腹腔与直肠下段吻合。重新建立气腹,并从肛门内伸入吻合器中心杆与头座连接后完成乙状结肠和直肠的吻合。
1.3 内脏脂肪面积(visceral fat area,VFA)检测采用西门子64层螺旋CT扫描仪进行检测,所有病例均由同一位专业人员负责操作。患者取仰卧位,屏气状态下在脐平面进行扫描,沿腹壁肌肉内缘及脊柱前缘画出腹腔及腹膜后脂肪兴趣区,计算机对该区衰减范围内全部像素面积进行测量并完成数据分析和报告[10]。同时计算体质指数(body mass index,BMI),BMI=体质量/身高2(kg/m2)。
1.4 骨盆宽度检测 骨盆宽度检测基本参照Akagi等[11]的方法:所有患者均接受腹部正位X线和CT检查。在X线片上测量骨盆入口横径(左右髂耻缘间的最大距离),记为A;在CT片的相应位置测量腹壁到盆腔后壁的距离,记为B。骨盆宽度定义为A×B。每位患者均重复测量3次,取均值作为最终结果。
1.5 统计学处理 应用SPSS 17.0软件进行统计学分析,计量数据均用均数±标准差(±s)表示;计数资料比较采用χ2检验或Fisher精确概率法;影响因素分析采用多因素非条件Logistic回归分析。α=0.05为检验水准。
2 结果
2.1 入组患者的临床病理资料分析 入组病例中,32例(42.1%)VFA >100 cm2,17 例(22.4%)BMI>25 kg/m2,40 例(52.6%)骨盆宽度≤190 mm;57例(75.0%)为中下段直肠癌,19例(25%)为上段直肠癌;浸润深度为T1/T2期的有35例(46.1%),T3/T4期的有41例(53.9%);术中淋巴结清扫程度为D1/D2级的有26例(34.2%),D3级为50例(65.8%);有 5例(6.6%)行回肠造瘘。2例(2.6%)因肥胖(BMI分别为32和34 kg/m2)而进入盆腔困难,中转为开腹手术。有4例(5.2%)术前接受放疗。详见表1。

表1 76例接受腹腔镜直肠癌前切除术患者的临床病理资料
2.2 手术相关资料分析 中位手术时间为310 min(270~420 min);术中失血量的中位数为85 ml(60~120 ml)。住院期间无一例死亡;并发症总体发生率为11.8%(9/76),主要包括切口感染4例(5.3%),肺部感染3例(3.9%),吻合口瘘及不完全性肠梗阻各1例(1.3%)。除吻合口瘘患者接受二次手术治疗外,其余并发症均经对症处理后治愈。
2.3 手术时间>310 min的相关因素分析 按照手术时间将76例分成两组,一组>310 min,共42例(55.3%);另一组≤310 min,共34例(44.7%)。单因素分析表明,BMI、VFA、肿瘤位置、肿瘤浸润深度、肿瘤直径和淋巴结清扫范围在两组间的差异有统计学意义(P=0.002、0.004、0.017、0.003、0.000、0.000)(表2)。多因素回归分析表明,较高的肿瘤浸润深度、较大的肿瘤直径和淋巴结清扫范围与手术时间延长有密切关系(P=0.029、0.001、0.036),且均为独立的危险因素(OR=2.164、1.516、6.240)(表3)。
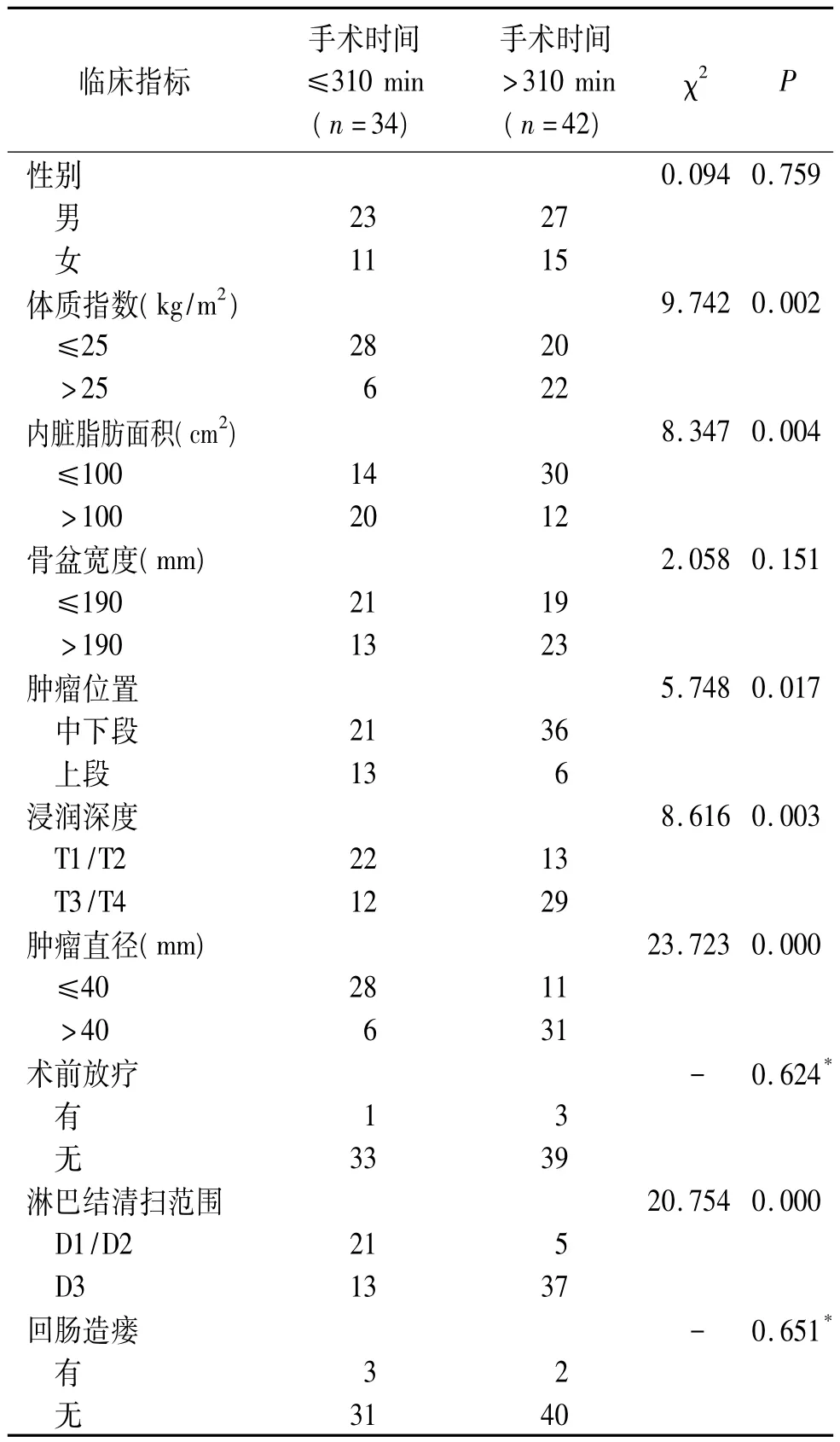
表2 76例接受腹腔镜直肠癌前切除术患者与手术时间相关的影响因素的单因素分析结果(例)
2.4 术中失血量>100 ml的相关因素分析 按照术中失血量将76例分成两组,一组>100 ml,共29例(38.2%);另一组≤100 ml,共 47 例(61.8%)。单因素分析表明,BMI、VFA和肿瘤直径在两组间的差异有统计学意义(P=0.000、0.006、0.021)(表4)。多因素回归分析表明,较高的BMI、VFA与术中失血量有密切关系(P=0.005、0.014),且均为独立的危险因素(OR=18.973、7.352)(表5)。
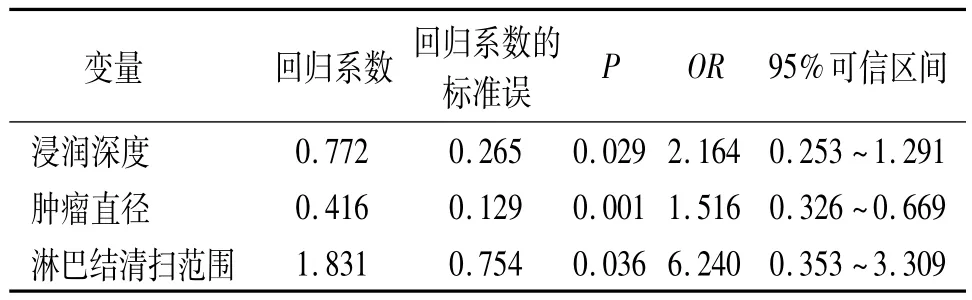
表3 76例接受腹腔镜直肠癌前切除术患者与手术时间相关的影响因素的Logistic多因素回归分析结果
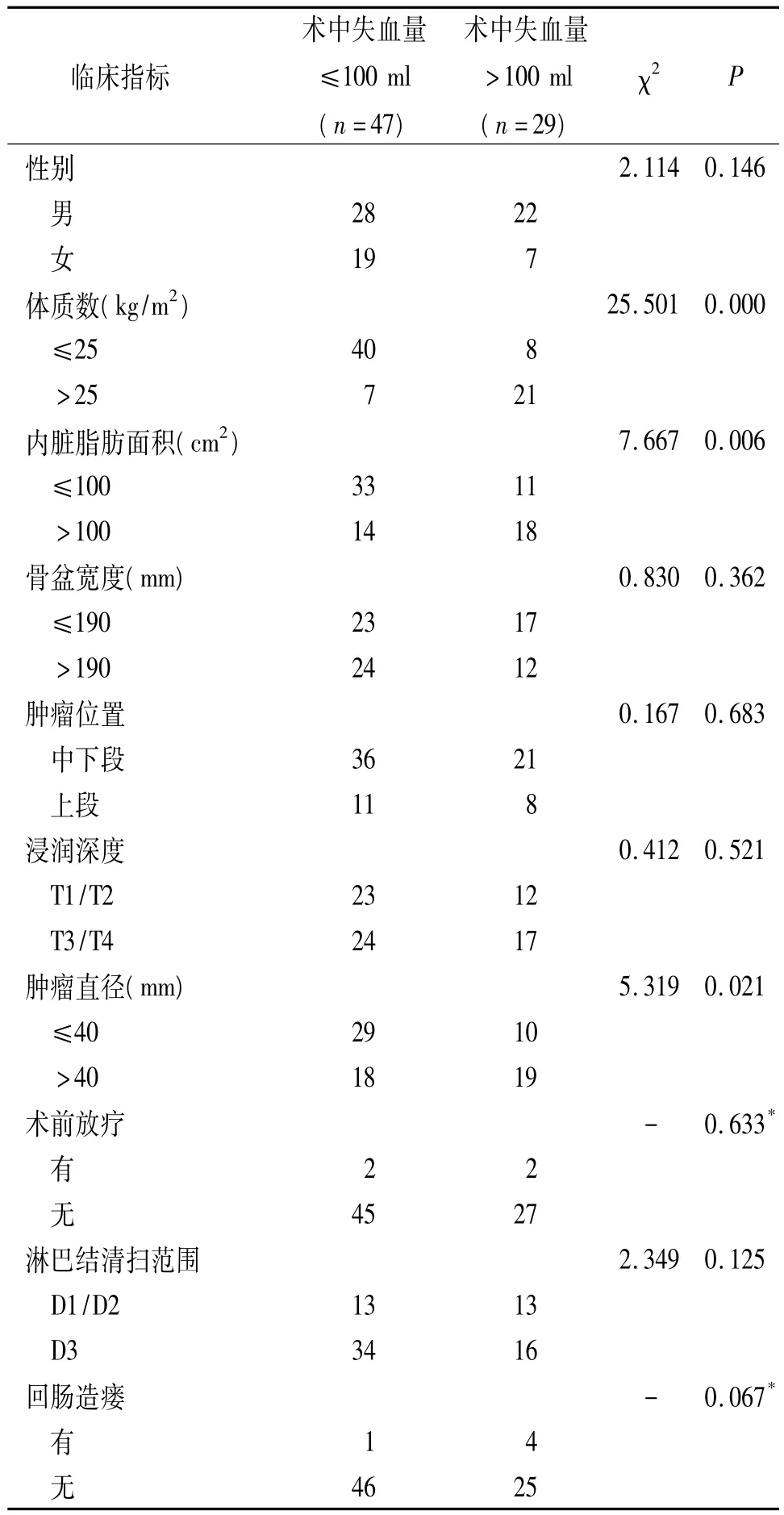
表4 76例接受腹腔镜直肠癌前切除术患者与术中失血量相关的影响因素的单因素分析结果(例)
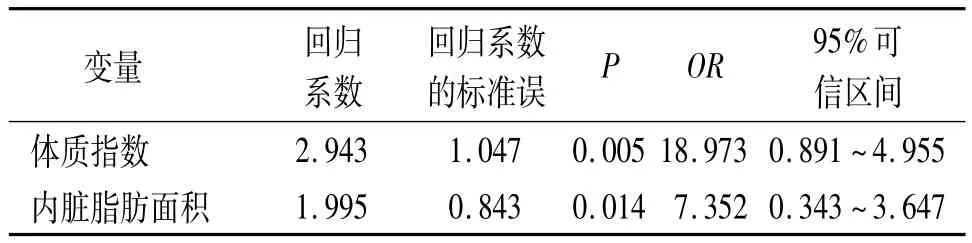
表5 76例接受腹腔镜直肠癌前切除术患者与术中失血量相关的影响因素的Logistic多因素回归分析结果
2.5 术后并发症发生率的相关因素分析 76例中9例(11.8%)出现术后并发症。单因素分析表明,BMI>25 kg/m2、VFA>100 cm2和回肠造瘘与并发症密切相关(P <0.001、0.031、0.011)(表6)。多因素回归分析未发现有统计学意义的独立危险因素。
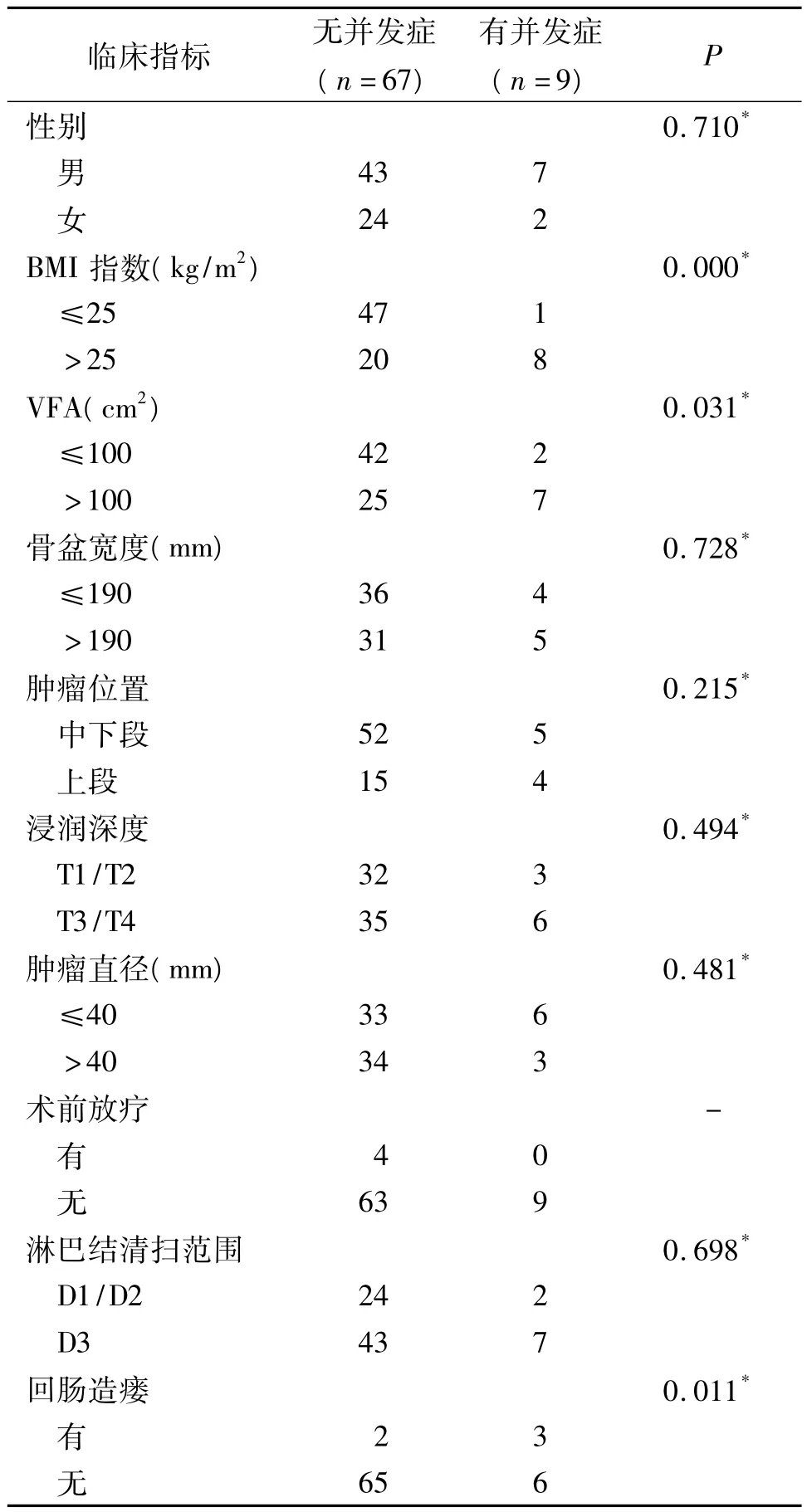
表6 76例接受腹腔镜直肠癌前切除术患者并发症发生率的影响因素的单因素分析结果(例)
3 讨论
近年来随着腔镜技术的不断进步,特别是超声刀、腔内切割闭合器等先进设备的出现,使腹腔镜结直肠手术有了更好的发展,其手术安全性、可行性、肿瘤根治性及疗效已初步得到前瞻性随机对照临床研究结果的证实[12-13]。这些研究大部分以结肠癌为研究对象,腹腔镜对直肠癌的疗效并不十分确定。此外,腹腔镜直肠癌手术操作相对复杂,且要达到开腹手术所要求的肿瘤根治的目的,所以对外科医师的手术操作技能和经验要求更高,这些因素都限制了腹腔镜技术在直肠癌外科治疗中的广泛应用。
腹腔镜直肠癌手术是否优于传统开腹手术,一直是临床争论的焦点。按照肿瘤外科治疗的标准,腹腔镜下的肿瘤切除手术应该满足完整切除癌灶、彻底清扫局部腹腔淋巴结以及切缘阴性等要求[14-15]。但直肠手术需要在一个狭小的漏斗型盆腔内进行,其操作和显露都非常困难。一般认为,直肠癌手术的质量不仅受术者经验和技术的影响,还与患者的盆腔大小有密切关系。Targarona等[16]总结60例腹腔镜直肠肿瘤切除患者的临床资料,发现骨盆较小是导致手术时间延长的一个独立影响因素。Akiyoshi等[5]分析79例中下段直肠癌腹腔镜切除手术,认为狭窄骨盆是手术时间的独立影响因素。但本研究并未发现骨盆宽度与手术时间的关系有统计学意义,而较大的肿瘤直径、较严重的肿瘤浸润深度和较宽的淋巴结清扫范围是延长手术时间的独立影响因素。说明窄骨盆并不是腹腔镜直肠癌前切除术的禁忌证。此外单因素分析还表明,BMI、VFA和肿瘤位置与手术时间也有一定的关系,但在多因素回归分析中,未发现有统计学意义。需要注意的是,尽管本研究未发现骨盆宽度与手术时间有关,但为了确保手术安全,术前还是应该测量患者的骨盆宽度以完善手术方案。
对肥胖患者实施腹腔镜手术的技术难度一直被认为高于体质量正常者[17]。BMI和VFA是腹型肥胖者较好的体质量评价标准,但对于二者在腹腔镜手术中的应用价值却有不同观点。一些学者认为BMI在预测术后短期疗效上要优于VFA[17-18],但另外一些学者持相反意见[19-20]。本研究发现,较高的BMI和VFA值均与术中失血量有密切关系,且为独立危险因素。这提示,在对肥胖患者进行手术时,一定要小心操作,注意结扎血管并及时处理创面出血。对于术后并发症的统计分析也表明,BMI、VFA和回肠造瘘与并发症的发生有密切关系,但由于样本量过小,未能确定出独立的影响因素。这些结果均提示,肥胖患者的手术难度较高,术中出血量大且并发症发生率较高。预防性回肠造瘘术是降低吻合口瘘发生的有效措施之一[2,15]。本研究共对5例实施了回肠造瘘,均未发生吻合口瘘,但却出现了切口和肺部感染的术后并发症。由于样本量太少,暂无法对影响回肠造瘘的相关危险因素进行分析,未来还需进行大样本试验来确定回肠造瘘在腹腔镜直肠癌切除术中的作用及其影响因素。
本研究结果表明,肿瘤体积大、肿瘤浸润程度深、淋巴结清扫范围大、肥胖的直肠癌患者,实施腹腔镜直肠癌前切除术的难度较大,应由经验较为丰富的普通外科或腹腔镜外科医师实施手术操作。但本研究为单中心回顾性分析且样本量较小,因而还需要大样本量的多中心前瞻随机对照研究来进一步验证该结论。相信随着微创技术的不断发展和大宗病例前瞻性研究的继续进行,腹腔镜技术必将在直肠癌的外科治疗中获得进一步的推广与应用。
[1]Kim J Y,Chung S M,Choi B O,et al.Prognostic significance of the lymph node ratio regarding recurrence and survival in rectal cancer patients treated with postoperative chemo radiotherapy[J].Gut Liver,2012,6(2):203-209.
[2]Lujan J,Valero G,Hernandez Q,et al.Randomized clinical trial comparing laparoscopic and open surgery in patients with rectal cancer[J].Br J Surg,2009,96(9):982-989.
[3]Ng K H,Ng D C,Cheung H Y,et al.Laparoscopic resection for rectal cancers:lessons learned from 579 cases[J].Ann Surg,2009,249(1):82-86.
[4]Naitoh T,Tsuchiya T,Honda H,et al.Clinical outcome of the laparoscopic surgery for stageⅡandⅢcolorectal cancer[J].Surg Endosc,2008,22(4):950-954.
[5]Akiyoshi T,Kuroyanagi H,Oya M,et al.Factors affecting the difficulty of laparoscopic total mesorectal excision with double stapling technique anastomosis for low rectal cancer[J].Surgery,2009,146(3):483-489.
[6]Kaido T.Current evidence supporting indications for laparoscopic surgery in colorectal cancer[J].Hepatogastroenterology,2008,55(82-83):438-441.
[7]Strohlein M A,Grutzner K U,Jauch K W,et al.Comparison of laparoscopic vs.open access surgery in patients with rectal cancer:a prospective analysis[J].Dis Colon Rectum,2008,51(4):385-391.
[8]Braga M,Frasson M,Vignali A,et al.Laparoscopic resection in rectal cancer patients:outcome and cost-benefit analysis[J].Dis Colon Rectum,2007,50(4):464-471.
[9]Anderson C,Uman G,Pigazzi A.Oncologic outcomes of laparoscopic surgery for rectal cancer:a systematic review and meta analysis of the literature[J].Eur J Surg Oncol,2008,34(10):1135-1142.
[10]Examination committee of criteria for obesity disease in Japan;Japan society for the study of obesity.New criteria for obesity disease in Japan[J].Circ J,2002,66(11):987-992.
[11]Akagi T,Inomata M,Etoh T,et al.Multivariate evaluation of the technical difficulties in performing laparoscopic anterior resection for rectal cancer[J].Surg Laparosc Endosc Percutan Tech ,2012,22(1):52-57.
[12]Guillou P J,Quirke P,Thorpe H,et al.Short-term endpoints of conventional versus laparoscopic-assisted surgery in patients with colorectal cancer(MRC CLASICC trial):multicentre,randomised controlled trial[J].Lancet,2005,365(9472):1718-1726.
[13]Kitano S,Inomata M,Sato A,et al.Japan Clinical Oncology Group Study.Randomized controlled trial to evaluate laparoscopic surgery for colorectal cancer:Japan Clinical Oncology Group Study JCOG 0404[J].Jpn J Clin Oncol,2005,35(8):475-477.
[14]Law W L,Poon J T,Fan J K,et al.Comparison of outcome of open and laparoscopic resection for stageⅡand stage Ⅲ rectal cancer[J].Ann Surg Oncol,2009,16(6):1488-1493.
[15]宋越.腹腔镜结肠癌根治术的临床评价[J].中华肿瘤防治杂志,2011,18(6):447-449.
[16]Targarona E M,Balague C,Pernas J C,et al.Can we predict immediate outcome after laparoscopic rectal surgery?Multivariate analysis of clinical,anatomic,and pathologic features after 3-dimensional reconstruction of the pelvic anatomy[J].Ann Surg,2008,247(4):642-649.
[17]Scheidbach H,Benedix F,Hugel O,et al.Laparoscopic approach to colorectal procedures in the obese patient:risk factor or benefit? [J].Obes Surg,2008,18(1):66-70.
[18]Bege T,Lelong B,Francon D,et al.Impact of obesity on short-term results of laparoscopic rectal cancer resection[J].Surg Endosc,2009,23(7):1460-1464.
[19]Seki Y,Ohue M,Sekimoto M,et al.Evaluation of the technical difficulty performing laparoscopic resection of a rectosigmoid carcinoma:visceral fat reflects technical difficulty more accurately than body mass index[J].Surg Endosc,2007,21(6):929-934.
[20]Tsujinaka S,Konishi F,Kawamura Y J,et al.Visceral obesity predicts surgical outcomes after laparoscopic colectomy for sigmoid colon cancer[J].Dis Colon Rectum,2008,51(12):1757-1767.

