血清脂联素、谷丙转氨酶与代谢综合征的相关性研究
韩小双,杨 静
代谢综合征(metabolic syndrome,MS)是心血管病的多种代谢危险因素(与代谢异常相关的心血管危险因素)在个体内集结的状态,是一组复杂的代谢紊乱症候群,体内多种代谢异常的聚集使心脑血管疾病的发病率和死亡率显著增加。因此,MS已成为影响人类健康的重大卫生问题,引起越来越多学者的重视。
很多研究证实,血清脂联素(APN)水平的下降与胰岛素抵抗(IR)的发展相平行[1],低 APN血症与肥胖、血脂代谢紊乱、高血压、2型糖尿病(T2DM)等心血管危险因素密切相关[2],APN作为一种重要的心血管保护性脂肪细胞因子,受到很多学者的关注。但APN的检测费用比较昂贵,在临床上尚未广泛推广,使其在临床中的应用受到限制。而谷丙转氨酶(ALT)是临床上非常经济适用的指标,现有研究显示,在非酒精性脂肪肝(NAFLD)患者中,ALT与 APN呈显著负相关[3],且国内外多把ALT作为临床监测NAFLD的指标来评价NAFLD与MS之间的关系,发现ALT与MS大部分临床特征相关[4]。那么阐明ALT与APN、MS的相关性对防治MS的发生具有非常重要的意义,且目前国内对于正常值范围内的ALT水平与MS的相关性研究较少。本文就血清APN、正常值范围内的ALT水平与MS及其组分的相关性进行分析,进一步探讨ALT在MS发生中的潜在临床价值。
1 资料与方法
1.1 研究对象 对山西某地区共822名受试者进行健康体检,排除既往有慢性肝脏病史、使用有肝损药物者、ALT>40U/L及影响代谢相关指标的疾病,如严重肝肾功能不全、甲状腺功能亢进、肿瘤和大量饮酒史(酒精摄入量:男性<40g/d,女性<20 g/d)。按标准共纳入728名,年龄(39.8±7.1)岁,其中男252名,年龄(40.3±7.2)岁;女476名,年龄(39.5±7.0)岁。
1.2 诊断标准 MS诊断标准参考2005年IDF诊断标准:具备下列条件中①以及②~⑤中的2项。①中心性肥胖:腰围(WC)男性≥90cm,女性≥80cm(参照亚洲人群腰围标准)。②三酰甘油(TG)≥1.7mmoL/L,或已接受治疗。③高密度脂蛋白胆固醇(HDL-C)<1.0mmoL/L(男),或<1.3mmoL/L(女),或已接受治疗;④血压(BP):收缩压(SBP)≥130mmHg(1mmHg=0.133kPa)或舒张压(DBP)≥85mmHg,或已接受相应治疗或此前已诊断高血压;⑤糖代谢异常:空腹血糖(FBG)≥5.6mmol/L或已接受相应治疗或此前已诊断T2DM,若FBG≥5.6mmol/L,则强烈推荐进行口服葡萄糖耐量(OGTT)试验。
1.3 方法 每位体检者测定身高、体重、WC、BP等指标,平静呼吸下用皮尺贴皮肤在脐上1cm处测量腰围。休息5min后坐位测量右上臂肱动脉血压,测2次取均值。采集空腹血,测定FBG、总胆固醇(TC)、TG、HDL-C、ALT、APN、餐后2h血糖(P2hBG)、真胰岛素(TI)等指标,其中 APN、TI采用酶联免疫吸附法(ELISA)测定。空腹行腹部彩超检查,并行OGTT。计算公式:HOMA-IR=空腹血糖(mmol/L)×空腹真胰岛素(U/L)/22.5。BMI=体重(kg)/身高(m)2。
1.4 统计学处理 数据分析用SPSS17.0软件完成。计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用t检验。相关分析采用Pearson相关及偏相关分析,风险分析采用Logstic回归分析。P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料 MS者共172例(23.6%),其中男性患病率为23.0%,女性为23.9%。中心性肥胖者363例(49.9%);低HDL-C者231例(31.7%);高TG者197例(27.1%);高血压者254例(34.9%);高FBG者204例(28.0%)。
2.2 血清APN、ALT及代谢指标与MS组分聚集的关系 按无 MS(MS0)、符合 MS一个组分者(MS1)、符合 MS两个组分者(MS2)和MS三个和三个以上组分者(MS3)进行分组,其中MS0132例,MS1196例,MS2210例,MS3190例。结果可见随着MS组分个数的聚集,除HDL-C水平逐渐下降,其余各代谢指标逐渐升高。同时ALT水平明显升高,而APN水平显著下降,差异有统计学意义。详见表1。
表1 血清APN、ALT及代谢指标与MS组分聚集的关系(±s)
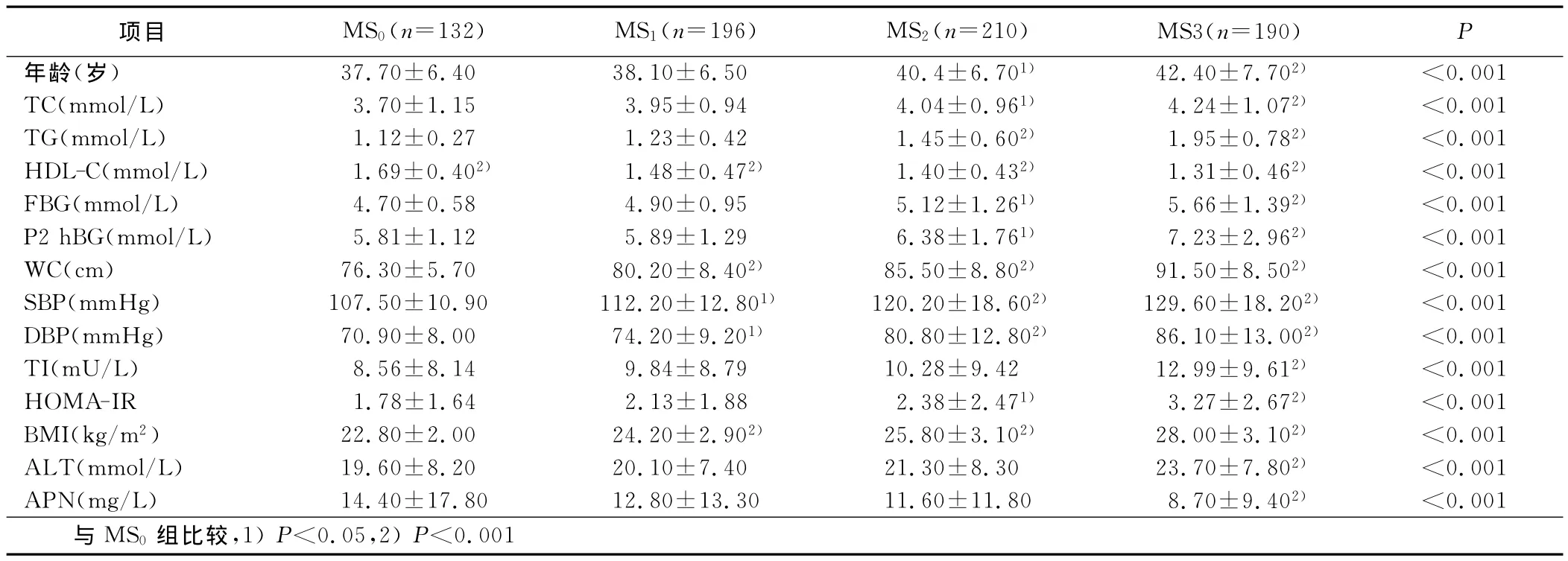
表1 血清APN、ALT及代谢指标与MS组分聚集的关系(±s)
项目 MS0(n=132) MS1(n=196) MS2(n=210) MS3(n=190)P年龄(岁) 37.70±6.40 38.10±6.50 40.4±6.701) 42.40±7.702) <0.001 TC(mmol/L) 3.70±1.15 3.95±0.94 4.04±0.961) 4.24±1.072) <0.001 TG(mmol/L) 1.12±0.27 1.23±0.42 1.45±0.602) 1.95±0.782) <0.001 HDL-C(mmol/L) 1.69±0.402) 1.48±0.472) 1.40±0.432) 1.31±0.462) <0.001 FBG(mmol/L) 4.70±0.58 4.90±0.95 5.12±1.261) 5.66±1.392) <0.001 P2hBG(mmol/L) 5.81±1.12 5.89±1.29 6.38±1.761) 7.23±2.962) <0.001 WC(cm) 76.30±5.70 80.20±8.402) 85.50±8.802) 91.50±8.502) <0.001 SBP(mmHg) 107.50±10.90 112.20±12.801) 120.20±18.602) 129.60±18.202) <0.001 DBP(mmHg) 70.90±8.00 74.20±9.201) 80.80±12.802) 86.10±13.002) <0.001 TI(mU/L) 8.56±8.14 9.84±8.79 10.28±9.42 12.99±9.612) <0.001 HOMA-IR 1.78±1.64 2.13±1.88 2.38±2.471) 3.27±2.672) <0.001 BMI(kg/m2) 22.80±2.00 24.20±2.902) 25.80±3.102) 28.00±3.102) <0.001 ALT(mmol/L) 19.60±8.20 20.10±7.40 21.30±8.30 23.70±7.802) <0.001 APN(mg/L) 14.40±17.80 12.80±13.30 11.60±11.80 8.70±9.402) <0.001与 MS0组比较,1)P<0.05,2)P<0.001
2.3 相关分析Spearson相关分析结果显示,血清APN与TG、P2hBG、WC、SBP、DBP、BMI、ALT呈负相关(P<0.05);血清 ALT与 TG、FBG、P2hBG、WC、SBP、DBP、BMI、HOMA-IR、APN呈正相关(P<0.05)。经校正性别、年龄、饮酒、吸烟及其他代谢指标后偏相关分析结果显示,APN与P2hBG、DBP的相关性消失,与其余指标仍有显著的相关性;而ALT与P2hBG、SBP、DBP的相关性消失。详见表2。
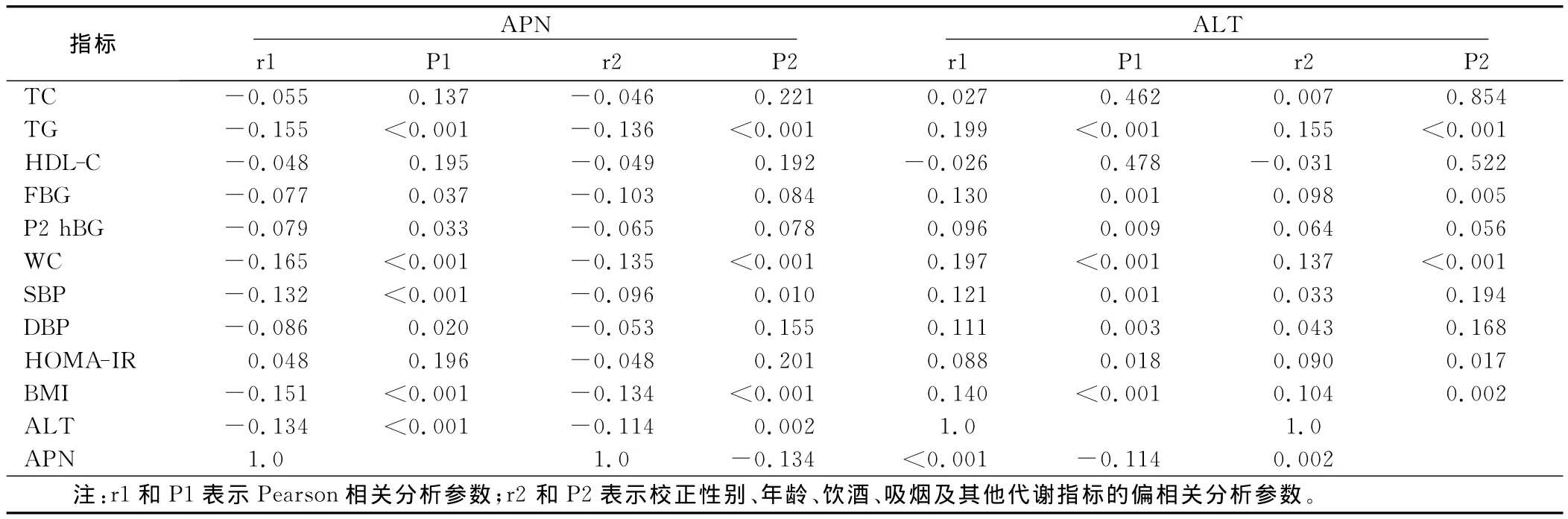
表2 血清APN、ALT与代谢相关指标的相关性分析
2.4 APN、ALT与MS风险分析 将研究对象按性别分别根据APN、ALT四分位数(quartile,Q)分组,比较MS发生的风险性。随着APN水平的增加,男女MS的患病率逐渐下降,校正年龄、吸烟、饮酒后,男性Q1组患 MS的风险是Q4组的3.61倍(95%CI=1.31~7.72),女性 Q1∶Q4为2.70倍。而随着ALT水平的升高,男女MS的患病率逐渐升高,男性Q1到Q4的患病率分别为13.3%、21.7%、27.1%、32.8%,男性的Q4组患MS的风险性是Q1组的3.24倍(95%CI=1.41~7.41);女性Q4∶Q1为2.40倍(95%CI=1.28~4.51)。在增加校正脂肪肝后,男女Q4组较Q1组仍有较高的患病风险。详见表3、表4。

表3 APN四分位数(Q)分组后OR及95%CI评价MS患病风险
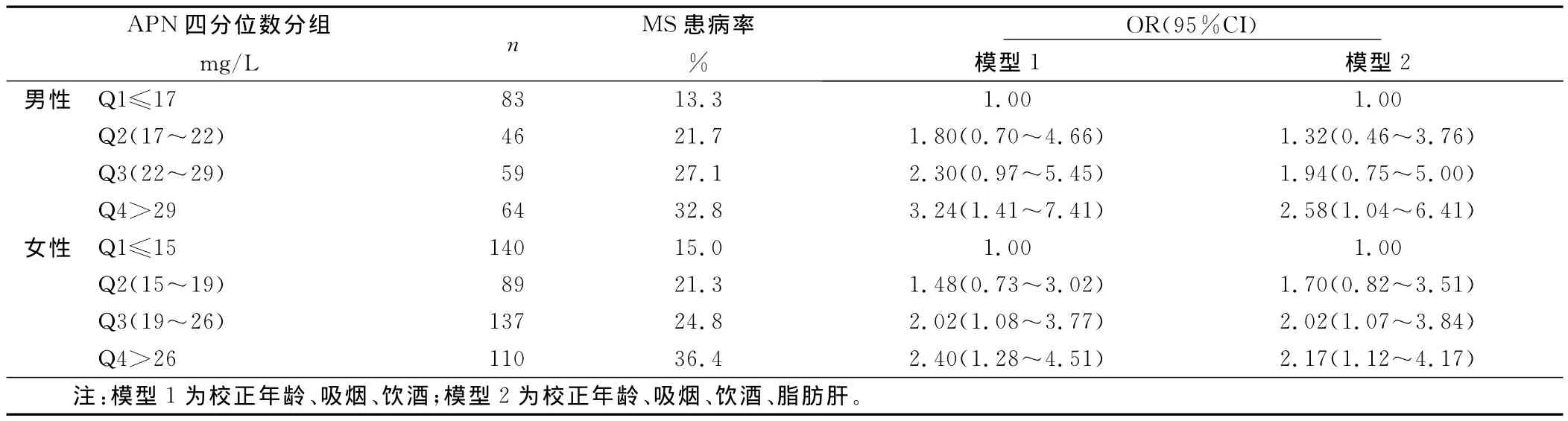
表4 ALT四分位数(Q)分组后OR及95%CI评价MS患病风险
3 讨 论
心血管疾病是世界范围内的首要死亡原因,MS使糖尿病和心血管疾病的危险性明显增加。而目前全球MS的患病率呈逐渐上升的趋势,本研究人群中 MS患病率为23.6%,Isomaa等报道患MS的个体心血管疾病的死亡率比没有MS的个体多5倍,心血管病的发病率和死亡率给社会造成严重的负担[5]。因此,MS的流行趋势值得高度重视。
APN是脂肪组织特异分泌的含量最丰富的脂肪细胞因子,其在血中的浓度为5mg/L~30mg/L,是唯一与脂肪组织体积呈负相关的脂肪细胞因子。APN作为机体的保护性细胞因子具有重要的生理效应,APN可增加胰岛素敏感性、参与糖脂代谢、抗炎、抗动脉粥样硬化等。临床研究显示[6],低APN血症与MS密切相关,Xydakist等[7]研究指出,MS相关组分出现的数量与血清APN水平逐渐降低呈平行改变,血清APN水平降低是MS的特征性标志。本研究结果也表明,随着MS组分个数的聚集,APN水平逐渐下降,同时发现各代谢指标均有逐渐恶化的趋势。按APN水平四分位数分组后发现,APN水平较低的Q1组与高的Q4组比较患有MS的风险分别是男性为2.67倍,女性为2.10倍,提示血清APN水平降低可增加 MS患病的危险度。本研究还发现,血清APN水平与MS的组分,如TG、WC、SBP、BMI呈显著负相关,与多项研究结果一致[8-10],进一步证实APN水平下降与MS的发生密切相关。
虽然低APN血症与MS的发生密切相关,但是APN的检测在临床上尚未普遍开展,在临床工作中应用APN来评价MS的进展情况仍有很大的不便。而ALT的检测却简单方便,但因其受很多因素的影响使其检测结果很不稳定。然而,本研究发现,随着MS组分数的增加,APN水平逐渐下降,而ALT水平却逐渐升高,经校正性别、年龄、吸烟、饮酒及其他代谢指标之后偏相关分析显示,ALT与APN呈显著负相关(P=0.002),与Yokoyama等[3]的研究结果相一致,提示ALT也可能成为评价MS发生、发展的可靠指标。因此,ALT作为日常健康体检的常用指标,进一步阐明血清ALT水平与MS的相关性,将会给MS的防治工作带来很大的方便。
现有研究报道[11],ALT水平升高,即使在正常值范围内较高的ALT水平也与肝脏内脂肪沉积有显著相关性。另外有研究表明[12],ALT水平与胰岛素抵抗、糖脂代谢有关,因此,有学者认为ALT可以作为预测未来代谢紊乱发生的指标。本研究结果显示,随着MS组分数的增加,ALT水平逐渐升高,MS患者ALT水平明显高于无MS组分者。根据正常值范围内ALT水平四分位数分组后发现,男性Q4组患MS的风险是Q1组的2.58倍,女性Q3组、Q4组与Q1组比较患MS的风险均明显增加。偏相关分析结果显示,ALT与 TG、FBG、WC、BMI、HOMA-IR呈显著正相关。由此可见,即使在正常范围内较高水平的ALT与MS的发生也密切相关。而目前临床上血清ALT正常值范围为0~40U/L,在临床工作中,常关注ALT超出正常值范围的人群,却忽略了正常值范围内较高水平的ALT。本研究中发现,即使在正常值范围内,也有很高的MS患病率(男性Q4组为32.8%,女性Q4组为36.4%)。Prati等[13]曾提出下调ALT正常参考值范围,男性应为0~30U/L,女性为0~19U/L,明显低于目前使用的参考值范围。因此,对于MS高危人群需正确认识位于正常参考值范围上限附近的ALT水平,将ALT水平与其他指标相结合有利于正确评价MS的进展情况。
综上所述,低APN血症与MS的发生密切相关,血清APN与ALT呈显著负相关,正常值范围内高水平的ALT与MS的发生亦高度相关,对于ALT在正常值范围内较高值的患者,应积极控制代谢指标,尽早预防MS的发生,防止因代谢紊乱促发各种心血管疾病的发生。
[1]Sheng T,Yang K.Adiponectin and its association with insulin resistance and type 2diabetes[J].J Genet Genomics,2008,35(6):321-326.
[2]Maynadier M,Basile I,Gary-Bobo M.Adiponectin normalization:A clue to the antimetabolic syndrome action of rimonabant[J].Drug Discov Today,2009,14(3-4):192-197.
[3]Yokoyama H,Hirose H,Ohgo H,Saito I.Inverse associationbetween serum adiponectin level and transaminase activities in Japanese male workers[J].J Hepatol,2004,41:19-24.
[4]Nannipieri M,Haffner SM,Ferrannini E,etal.Liver enzymes,the metabolic syndrome and incident diabetes:The mexico city Diabetes Study[J].Diabetes Care,2005,28:1757-1762.
[5]Despres JP,Lemieux I,Bergeron J,etal.Abdominal obesity and the metaboIic syndmme:contribution to global cardiometaboIic risk[J].Arterioscler Thromb Vasc Biol,2008,28(6):1039-1049.
[6]Mojgan Sanjari,Mandana Khodashahi,etal.Association of adiponectin and metabolic syndrome in women[J].Res Med Sci,2011,16(12):1532-1540.
[7]Xydakist AM,Case CC,Jones PH,etal.Adiponectin,imflammation,and the expression of the metabolic syndrome in obese individuals:The impact of rapid eight 1oss through caloric restriction[J].Journal of Clinical Endocrinology & Metabolism,2004,89:2697-2703.
[8]Oweeki M,Miezke A,Pupok-Musialik D,et al.Serum adiponectin concerntrations and their relationship with plasma lipids in obese diabetic and nondiabetic Caucasians[J].Neum Endocrinol Lett,2007,28(6):901-907.
[9]Sanjari M,Khodashahi M,Gholamhoseinian A,et al.Association of adiponectin and metabolic syndrome in women[J].J Res Med Sci,2011,16(12):1532-1540.
[10]姜玲玲,洪小飞,厉有名.血清脂联素与肥胖和非酒精性脂肪性肝病关系的研究[J].中华消化杂志,2005,25(4):238-239.
[11]Suh SY,Choi SE,Ahn HY,et al.The association between normal alanine aminotransferase levels and the metabolic syndrome:2005 Korean National Health and Nutrition Examination Survey[J].Metabolism,2009,58(12):1731-1736.
[12]Chang Y,Ryu S,Sung E,et al.Higher concentrations of alanine aminotransferase within the reference interval predict nonalcoholic fatty liver disease[J].Clin Chem,2007,53:686-692.
[13]Prati D,Taioli E,Zanella A,et al.Updated definitions of healthy ranges for serum alanine aminotransferase levels[J].Ann Intern Med,2002,137(1):1-10.

