全麻手术患者外周血单个核细胞DNA损伤及临床意义
肖 憬,詹 翔,桑圣刚
应激反应及继发的氧化损伤及炎性反应是手术及麻醉对患者全身性损害的一种形式[1-2],在手术过程中,虽然麻醉可以在一定程度减轻疼痛、牵拉等对机体的不良刺激,但是植物神经系统对创伤刺激的反应并不能完全被阻断,机体仍处于创伤应激的状态,体内耗氧量增加,氧自由基生成增多。组织器官在血流阻断、牵拉等手术过程中,不断发生组织器官局部的缺血缺氧,在恢复血液灌注后会发生非典型的缺血再灌注损伤。氧自由基大量生成,抗氧化系统活性下降,加重对机体的损伤[3]。本研究观察76例全麻手术患者外周血单个核细胞(peripheral blood mononuclear cell,PBMC)DNA的改变情况,同时测定患者血液中超氧化物歧化酶(SOD)活性和丙二醛(MDA)的含量,为手术过程中加强生命体征监测提供依据。
1 资料与方法
1.1 临床资料 选取2009年9月—2011年12月在海南医学院附属医院手术室行全麻的手术患者76例,男43例,女33例;年龄5~65岁。其中胃癌26例,直肠癌15例,肺癌27例,肝破裂3例,肠坏死5例。
1.2 仪器 电泳仪(北京市六一仪器厂DYY-7B型),荧光显微镜(日本尼康E800),低温冰箱(青岛海尔),离心机(安徽科大创新有限公司中佳分公司KDC-1042),凝胶成像系统(德国 Herolab UVT-28),彗星图像分析系统(捷克LUCIATMCOMET)。
1.3 试剂 percoll分离液(美国Ameisco公司),兔抗人Ⅷ因子相关抗原、FITC标记的羊抗兔IgG荧光抗体(美国ADI公司),正常熔点琼脂糖、低熔点琼脂糖、月桂酰肌氨酸钠、TritonX-100、Thris-HCl(美国Ameisco公司),Na2-EDTA、二甲基亚砜、溴化乙锭、胎盼蓝(西安华美公司),蛋白酶K(德国默克公司),超氧化物歧化酶(SOD)、丙二醛(MDA)试剂盒(南京建成生物工程研究所)。
1.4 方法
1.4.1 麻醉方法:术前常规肌内注射阿托品0.5 mg、苯巴比妥100 mg。开放静脉通道,乳酸林格液输注保持静脉通道通畅,给予面罩吸氧,依次静脉注射咪达唑仑 0.15 ~0.2 mg/kg、芬太尼 0.2 mg、琥珀酰胆碱2 mg/kg诱导,90 s后行气管插管。气管插管后机械通气,潮气量为10 ml/kg,呼吸频率为12/min。吸入1% ~2%异氟醚,静脉分次推注维库溴铵(0.05 mg/kg),微量泵靶控持续泵入芬太尼维持麻醉。
1.4.2 PBMC提取:采集麻醉日晨空腹、麻醉后1 h及术后 2 d空腹静脉血 10 ml,分别置于含0.109 mol/L的枸橼酸钠负压管中,立即颠倒混匀。用ficoll密度离心法分离PBMC,用RPMI 1640调细胞浓度为1×106/L,在光镜下用台盼蓝法检测活细胞率>95%,制成细胞悬液备用。
1.4.3 单细胞凝胶电泳[4]:45℃下将浓度为10 g/L的正常熔点琼脂糖150 μl涂在磨砂载玻片上,加盖玻片轻压,于4℃凝固10 min制成第一层胶;37℃下将含1000个细胞的悬液150 μl与等体积浓度为5 g/L的低熔点琼脂糖混合均匀,取150 μl滴在第一层胶上,加盖玻片轻压,于4℃凝固10 min制成第二层胶;37℃下取浓度为5 g/L的低熔点琼脂糖100 μl涂在第二层胶上并加盖玻片轻压,于4℃凝固10 min制成第三层胶。小心去掉盖玻片,将包埋了细胞的载玻片小心放入细胞裂解液中,置于4℃下1.5 h。取出载玻片,紧密排列于水平电泳槽中,加入电泳缓冲液,4℃解旋20 min。在电压32 V,电流300 mA,4℃电泳25 min。电泳后小心将载玻片浸于中和液2次,每次15 min。用浓度为20 μg/ml的溴化乙锭染色20 min,加盖玻片。在荧光显微镜(400倍)下观察,每片计数100个细胞,用彗星图像分析系统分析细胞彗星率和彗尾DNA含量。
1.4.4 SOD、MDA的检测:按试剂盒说明进行操作,应用黄嘌呤氧化酶法测定血清SOD活性,硫代巴比妥酸法测定血清MDA浓度。
1.5 统计学方法 应用SPSS 11.5软件进行数据分析,计量资料以均数±标准差(±s)表示,采用方差分析,α=0.05为检验水准。
2 结果
2.1 单细胞凝胶电泳结果 荧光显微镜下观察到血液中表现为拖尾的荧光图像的PBMC,呈“彗星”状,称彗星率。全麻手术患者麻醉1 h彗星率及彗尾DNA含量高于麻醉前,差异有统计学意义(P<0.05),术后2 d彗星率及彗尾DNA含量与麻醉前比较差异无统计学意义(P>0.05),与麻醉1 h比较差异有统计学意义(P<0.05),见表1。
表1 全麻手术患者外周血单个核细胞彗星率、彗尾DNA含量(±s,%,n=76)
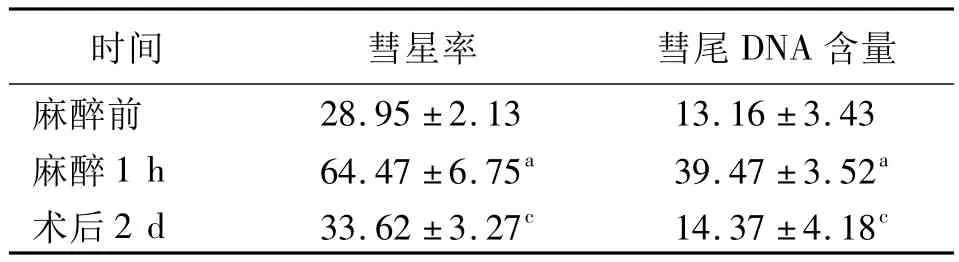
表1 全麻手术患者外周血单个核细胞彗星率、彗尾DNA含量(±s,%,n=76)
注:与麻醉前比较,aP <0.05;与麻醉1 h比较,cP <0.05
含量麻醉前时间 彗星率 彗尾DNA 28.95 ±2.13 13.16 ±3.43麻醉1 h 64.47 ±6.75a 39.47 ±3.52a术后2 d 33.62 ±3.27c 14.37 ±4.18c
2.2 SOD、MDA检测结果 全麻手术患者麻醉1 h SOD活性明显降低,MDA含量显著增高,与麻醉前比较差异均有统计学意义(P<0.05);术后2 d SOD活性升高,MDA含量降低,与麻醉前比较差异无统计学意义(P>0.05),与麻醉1 h比较差异有统计学意义(P <0.05),见表2。
表2 全麻手术患者外周血中超氧化物歧化酶和丙二醛的含量比较(±s,n=76)

表2 全麻手术患者外周血中超氧化物歧化酶和丙二醛的含量比较(±s,n=76)
注:与麻醉前比较,aP <0.05;与麻醉1 h比较,cP <0.05
时间 超氧化物歧化酶(U/L) 丙二醛(μmol/L)麻醉前105.0 ±11.2 15.2 ±5.7麻醉 1 h 45.0 ±9.3a 141.3 ±28.7a术后 2 d 98.4 ±10.7c 14.7 ±6.3c
3 讨论
全麻手术中可因呼吸、循环功能紊乱而引起机体缺氧性损伤,产生大量氧自由基[5]。氧自由基是强烈的DNA断裂剂[6],可直接攻击DNA,导致DNA单、双链断裂,并呈量-效及时-效关系[7]。
本研究应用单细胞凝胶电泳技术检测外周血PBMC DNA损伤情况,在电场力的作用下,受损PBMC细胞核中带阴电荷的DNA断片在凝胶分子筛中向阳极移动,形成“彗星”状图像,DNA链缺口越多,进入尾部的DNA越多,表现为尾长增加,未损伤细胞在电泳中DNA仍停留于核中形成圆形荧光团。计数细胞彗星率和彗尾的荧光强度可以定量反映群体细胞中DNA链断裂损伤程度[8-9]。电泳结果发现全麻手术患者麻醉1 h彗星率及彗尾DNA含量高于麻醉前,术后2 d彗星率及彗尾DNA含量低于麻醉1 h,差异有统计学意义,与麻醉前相比差异无统计学意义。提示在全麻状态下,患者存在一定程度的缺氧情况。这与Jugdutt[10]的观点一致。分析原因可能是全麻状态下一定程度的缺氧触发了氧自由基的释放,引起PBMC损伤的瀑布样反应,使一氧化氮合酶和一氧化氮含量下降,嗜中性粒细胞活化,细胞因子增多并产生更多的氧自由基,进一步加重PBMC的损伤;氧自由基大量产生,外周血抗氧化能力下降,导致氧化性DNA损伤、断裂[11]。
SOD能够清除氧阴离子自由基,保护细胞,间接反映了机体清除氧自由基的能力;MDA为氧自由基攻击生物膜中的多不饱和脂肪酸形成的脂质过氧化分解产物,其含量的变化可反映出组织细胞氧化损伤的程度[12]。这两个指标反映了体内自由基的氧化和抗自由基的水平。本研究表明,全麻手术患者麻醉1 h SOD活性明显降低,MDA的含量显著增高,与麻醉前相比差异有统计学意义;术后2 d SOD活性明显升高,MDA显著降低,与麻醉前相比差异无统计学意义,与麻醉1 h相比差异有统计学意义。与国内研究相一致[13-14]。结合PBMC DNA的损伤情况,分析原因为:全麻患者在手术过程中,除了手术本身的影响外,患者本身存在一定程度的缺氧。缺氧的程度与PBMC DNA的损伤程度、SOD的下降程度及MDA的升高水平相一致[15]。因此,在手术过程中如何纠正患者的缺氧,对减少患者手术过程氧自由基的产生至关重要。
总之,全麻患者在手术过程中存在不同程度的缺氧,极易引发患者体内氧自由基的大量蓄积,可导致其他并发症的发生,故对于全麻手术患者在手术过程中早期监测单个核细胞DNA的变化情况可能有利于预防缺氧,对提高手术质量具有指导意义。
[1]李仕明.全麻与联合硬膜外阻滞对腹腔镜手术应激反应抑制效果分析[J].当代医学,2012,18(24):94-95.
[2]钟宝琳,李优春,黄桂明.成人全麻苏醒期躁动相关因素回顾性分析[J].现代预防医学,2012,39(11):2858-2862.
[3]Pintaudi A M,Tesoriere L,D'Arpa N,et al.Oxidative stress after moderate to extensive burning in humans[J].Free Radic Res,2000,33(2):139-146.
[4]刘玉梅,张润玲,石正洪.脑梗死患者血液中DNA损伤的观察[J].第四军医大学学报,2004,25(6):535-537.
[5]侯念果,艾登斌,孙立新,等.氯胺酮对单肺通气患者围术期炎性细胞因子和自由基的影响[J].临床麻醉学杂志,2007,23(9):720-722.
[6]Isaksson C,Sturve J,Almroth B C,et al.The impact of urban environment on oxidative damage(TBARS)and antioxidant systems in lungs and liver of great tits,Parus major[J].Environ Res,2009,109(1):46-50.
[7]Hei T K,Liu S X,Waldren C.Mutagenicity of arsenic in mammalian cells:role of reactive oxygen species[J].Proc Natl Acad Sci U S A,1998,95(14):8103-8107.
[8]Migliore L,Petrozzi L,Lucetti C,et al.Oxidative damage and cytogenetic analysis in leukocytes of Parkinson's disease patients[J].Neurology,2002,58(12):1809-1815.
[9]Terris D J,Ho E Y,Ibrahim H Z,et al.Estimating DNA repair by sequential evaluation of head and neck tumor radiation sensitivity using the comet assay[J].Arch Otolaryngol Head Neck Surg,2002,128(6):698-702.
[10]Jugdutt B I.Nitric oxide and cardioprotection during ischemia-reperfusion[J].Heart Fail Rev,2002,7(4):391-405.
[11]所起凤,杜文婷,杨鸣鸣,等.过氧化氢诱导的人正常和早老细胞中DNA损伤及其修复研究[J].四川大学学报,2011,42(5):610-615.
[12]钟日胜,黄燕娟,曾建业,等.胸内手术患者单肺通气时超氧化物歧化酶的变化及意义[J].广西医学,2012,34(3):281-283.
[13]帅训军,艾登斌,张海荣,等.依达拉奉对肺叶切除术肺癌患者围术期炎性细胞因子和自由基的影响[J].山东医药,2009,49(43):56-57.
[14]张蔚,陈晓卫,孙丰南,等.全麻手术对老年患者羟自由基及SOD、GSH-PX水平的影响[J].中国医学工程,2012,20(1):38-39.
[15]张广华,李德周,高金贵.全麻复合胸段硬膜外阻滞对心内直视手术MDA、SOD水平的影响[J].河北医药,2009,31(11):1298-1300.

