转基因水稻检测用阳性质粒分子的构建及应用
李晓飞 谭小力 李俊 武玉花 曹应龙
水稻是人类的主要粮食作物之一,自从1988年,Toriyama培育了第一个转基因水稻,它就一直是现代农业生物技术领域转基因研究的热点,改良的性状涉及抗病、抗虫、抗旱、耐除草剂、营养高效及品质改良[1-3]。鉴于转基因作物在生态安全及食用安全方面存在潜在的风险,虽然在水稻的遗传改良方面已取得很大成绩,但由于水稻是人们的重要食粮,世界各国对转基因水稻的商业化都持审慎的态度。2012年,全球28个国家种植了25 种转基因作物,涉及319个转化体,种植面积达17亿hm2,产生了巨大的经济效益[4]。
目 前, 在 ISAAA数 据 库(http://www.isaaa.org/inbrief/default.asp)中只检索到7个获准商业化的水稻品种,包括日本研发的7Crp#10,中国研发的汕优63 和华恢1号/TT51-1,拜耳作物科学公司研发的LLRICE06、LLRICE601和LLRICE62,以及伊朗研发的Tarommolaii + cry1Ab。我国在转基因水稻领域的研究也非常活跃,目前已有超过100个转基因水稻品系进入田间试验[5]。其中,抗虫水稻华恢1号和汕优63两种转基因抗虫水稻已获得农业部颁发的生产应用安全证书[6]。在我国除了华恢1号/TT51-1具有良好的应用前景,其他两个抗虫水稻科丰6号和克螟稻也具有很好的应用潜力。TT51-1(转基因Bt63)是华中农业大学研发,含有由水稻Actin 1启动子和NOS终止子调控表达的Cry1Ab/Ac 融合基因,高抗螟虫及鳞翅目昆虫[7-9]。克螟稻是由浙江大学原子核农业科学研究所运用农杆菌介导法将密码子经优化的苏云金芽胞杆菌(Bacillus thurienglensis,简称Bt)杀虫晶体蛋白基因cry1Ab 导入水稻中培育而成,高抗二化螟、三化螟、稻纵卷叶螟等水稻害虫[10]。科丰6 号由中国科学院遗传与发育研究所和福建省农业科学院合作培育[11],含有Cry1Ac 基因、CpTi 基因与选择标记HPT 基因(潮霉素抗性基因),对水稻害虫二化螟和稻纵卷叶螟高抗[12,13]。随着田间试验频次的不断升高,处于试验阶段的转基因材料容易混杂到非转基因品种中,影响食物链的安全。抗虫水稻TT51-1在获准安全证书之前,曾意外混杂到米粉等食品中,并在中国、香港及欧洲等地的市场上被检出。只在美国获准商业化的耐除草剂水稻LLRICE601 也曾在欧盟进口的米制品中被检出。近几年,欧盟还通报了我国出口的多批次的进口米制品(如米粉、米果和粉条等)中疑似含有科丰6 号转基因成分(食品和饲料快速预警系统 RASFF No.2010.0336)。为此,欧盟还曾采取紧急措施,要求所有进口的稻米及制品都要经过有资质的实验室检验,确保不含有非法转基因成分。鉴于转基因作物的潜在风险,全球50多个国家已经要求对转基因食品和饲料进行标识,并对食品和动物饲料的转基因成分含量作出了相关规定。如挪威的标识阈值是2%、瑞士1%、欧盟0.9%、日本5%[14]。我国也颁发了《转基因生物安全管理条例》和《农业转基因生物标识管理办法》等法规,要求对转基因产品实施标识管理。管理法规及标识制度的落实依赖可靠的转基因检测方法及检测结果[15]。在转基因产品检测过程中,阳性对照或标准物质是必不可少的物质基础。目前,包括TT51-1、科丰6号和克螟稻在转基因水稻都未正式商业化种植,在转基因检测过程中很难获取到可靠来源的转基因水稻阳性材料作为阳性对照,影响检测工作的开展。
为了解决转基因检测标准物质匮乏的难题,检测人员着手研制不受转基因原材料限制的阳性质粒分子,作为替代性标准物质,应用于转基因检测。目前已报道的阳性质粒标准分子有GTS40-3-2[16]、MON1445、MON531[17]、MON810[18]、MON863[19]、NK603[20]、Bt11[21]和 TT51-1[22]等。本研究旨在构建一种适用于转基因水稻筛查检测及TT51-1、科丰6号和克螟稻1事件特异性检测的阳性质粒分子,解决转基因水稻安全监管工作中缺乏标准物质的难题,为转基因安全监管和执法提供技术支持。
1 材料与方法
1.1 材料
非转基因水稻珍汕97和非转基因水稻明恢63由本实验室保存,转基因水稻TT51-1、克螟稻(KMD1)、 科 丰 6号(KF-6) 和 转 基 因 油 菜MS8×RF3的种子粉末由农业部科技发展中心提供,转基因成分的含量均为1%。转基因水稻TT51-1用于克隆TT51-1的事件特异性序列;科丰6号用于克隆CaMV35S启动子、NOS终止子、HPT基因和科丰6号事件特异性序列;克螟稻用于克隆NPTⅡ基因和克螟稻事件特异性序列;转基因油菜MS8×RF3用于克隆Bar基因。
1.2 方法
1.2.1 植物基因组DNA 用QIAGEN DNeasy Plant Mini Kit(No.69104)试剂盒提取种子粉末的基因组DNA。提取的DNA用超微量分光光度计NanoDrop 2000(Thermo,USA)检测纯度和浓度。
1.2.2 基因元件克隆 在GenBank数据库中检索各元件的核苷酸序列信息,各基因元件的登录号详见表1,参阅国标中各基因元件的检测引物,并确定检测引物在基因序列中的位置。利用生物软件Primer Premier 5 在各基因元件检测引物的外侧设计克隆引物(表1)。 在 C1000TMPCR 仪(Bio-Rad)上进行PCR扩增,PCR 扩增体系50μL,含有:1×KOD Plus buffer,MgSO41mmol/L,每种dNTP0.2mmol/L,基因组DNA 1μL,高保真酶KOD Plus 1 U,上下游引物分别0.25μmol/L。扩增程序:94℃ 2min;94℃30s,68℃ 60s,35 个循环;68℃ 2min 后停止。取8μL PCR 产物在1%的琼脂糖凝胶上进行电泳检测。将扩增片段连接于pZero-AMP 克隆载体,转化大肠
杆菌Top10,挑取单克隆测序验证后提取质粒备用。

表1 转基因元件克隆引物序列信息
1.2.3 重叠延伸 PCR 及阳性质粒载体构建 应用重叠延伸PCR 技术,将克隆到的KMD1、KF-6、TT51-1、CaMV35S启动子、NOS终止子、Bar基因、HPT基因序列和NPTⅡ基因序列共8 个片段分别两两拼接,先获得4个片段。再把这4个片段两两拼接得到2 个大片段,最后将2个大片段拼接成一个重组的大分子。每一次将两个片段拼接时,需两轮PCR反应。两次使用同一PCR扩增体系,程序设为:94℃ 2min;94℃ 10s,60℃ 30s,68℃ 1min(拼接时随着PCR 产物长度增加,延伸时间也相应延长),20个循环;68℃ 2min后停止反应。但两轮PCR反应所用模板和引物均不同。例如:片段1与2拼接时,分别先进行第一轮反应,以带有各自目的片段的质粒作模板,片段1的5'端引物使用载体上的M13F(-47)/M13R(-48),3'端引物使用基因本身内部的引物;而片段2正好相反,5'端使用基因引物,3'端使用载体上的M13F(-47)/M13R(-48),扩增28个循环后,得到两段PCR产物,并且之间有一段序列相同的重叠区域。第二轮反应再以上一轮PCR产物的混合物作模板,分别加入上述产物0.25μL进行反应。两轮PCR反应使用引物不同,是为了避免第一轮反应中生成引物二聚体或非特异性扩增产物影响第二轮的扩增的效果。最后将拼接好的2 998bp大分子先用T4多核苷酸激酶磷酸化,然后通过平端连接的方式克隆至载体pBS Inter+的EcoRⅤ位点上,然后将单独克隆到的SPS基因片段通过SacⅠ酶切,也连接到同一载体上,并将构建好的阳性载体命名为 pBS Rice(图1)。
1.2.4 定性检测PCR 应用国标中的检测引物、反应体系和反应程序,用构建的阳性质粒作为对照,用转基因水稻TT51-1、KMD1、KF-6和非转基因水稻明恢63作为样品进行验证,考察阳性质粒分子在检测中的适用性。各基因元件的筛查检测引物及扩增产物大小详见表2。CaMV35S启动子和NOS终止子的反应体系和反应程序详见农业部1782号公告-3-2012,NPTⅡ和HPT基因的反应体系和反应程序详见农业部1782号公告-2-2012,Bar基因的反应体系和反应程序详见农业部1782号公告-6-2012,TT51-1、KMD1和KF-6的反应体系和反应程序参阅农业部1193号公告-3-2009。

图1 阳性质粒分子pBS Rice的载体结构图谱
2 结果
2.1 确定转基因水稻的检测靶标
检索美国ISAAA数据库,目前获准商业化的转基因水稻品种有7个,但是ISAAA数据库并没有提供这7个转基因品种的详细遗传转化信息。其中汕优63和TT51-1均为我国的华中农业大学培育,而且汕优63是以华恢1号作为亲本培育的杂交种,因此实际上汕优63和TT51-1含有相同的转化事件。检索加拿大AGBIOS公司转基因作物数据库(http://www.agbios.com/dbase.php), 只 检 索 到拜耳作物科学公司培育的耐除草剂水稻LLRICE06、LLRICE62、LLRICE601。LLRICE06和 LLRICE62中是通过基因枪法转入了相同的载体,含有Bar基因、CaMV35S启动子和CaMV35S终止子;LLRICE601中是通过农杆菌介导法转入了Bar基因、CaMV35S启动子和NOS终止子。统计获取到遗传转化信息的转基因水稻品种,根据各基因元件的使用频率(表3),结合水稻基因工程研究中常用的标记基因,选择CaMV35S启动子、NOS终止子、Bar基因、HPT基因和NPTⅡ基因作为转基因水稻筛查检测的靶标。同时聚合构建TT51-1、KMD1和KF-6的事件特异性序列,便于对转基因水稻进行身份鉴定。利用这些检测靶标对目前已知遗传转化信息的转基因水稻的筛查覆盖率是100%,同时CaMV35S启动子、NOS终止子、Bar基因、HPT基因和NPTⅡ基因是基因工程研究中最常用的调控元件和标记基因,通过检测这些元件,对处于田间试验阶段的转基因水稻材料也具有良好的筛查效果。

表2 用于转基因水稻筛查检测的引物
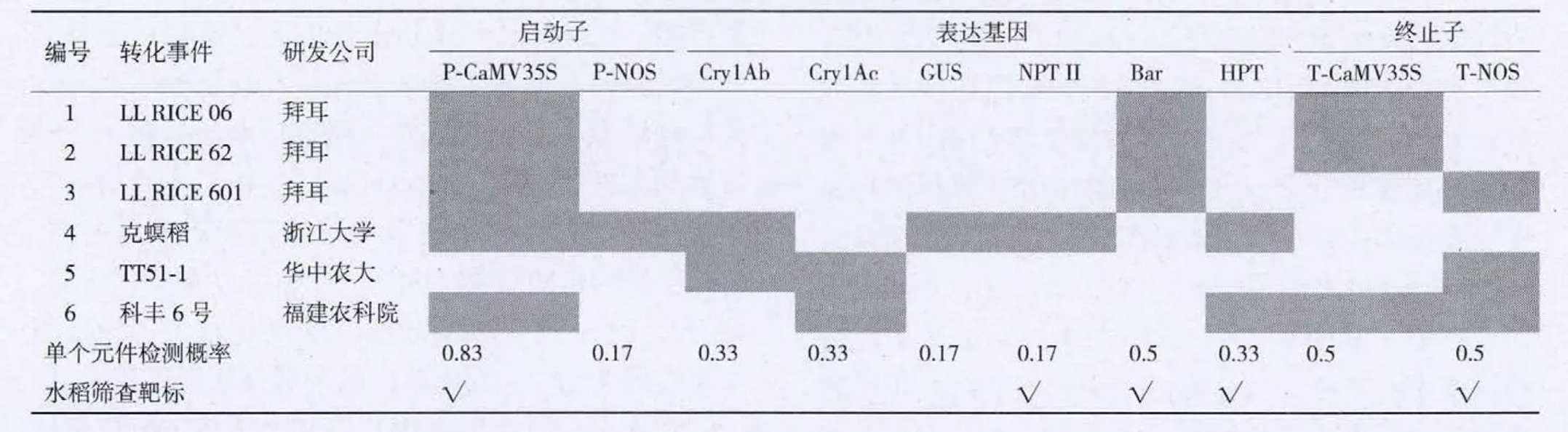
表3 转化事件的基因元件信息矩阵
2.2 阳性质粒分子的构建
用表1中的引物分别扩增各检测靶标。以TT51-1基因组DNA为模板扩增出了337bp的TT51-1事件特异性序列、295bp的SPS基因序列(图2-E);以KF-6的基因组DNA为模板扩增出了282bp的CaMV35S启动子、570bp的HPT基因、256bp NOS终止子、378bp的KF-6事件特异性序列;以KMD1基因组DNA为模板,扩增出380bp的NPTⅡ基因、440bp的KMD1事件特异性序列;以MS8×RF3的基因组DNA为模板,扩增出了355bp的Bar基因(图2-A)。测序后将克隆序列与GenBank数据库中的序列进行比对,选择无错配碱基的克隆用于下一步试验。同时将各基因元件的扩增序列与国标中的检测序列进行比对,发现各基因元件的扩增序列均包含了国标中的检测片段。
采用重叠延伸PCR技术,先分别将克隆到的KMD1事件特异性序列和KF-6事件特异性序列、TT51-1事件特异性序列和CaMV35S启动子、NOS终止子和Bar基因、HPT基因和NPTⅡ基因序列分别两两拼接,得到4个拼接片段,长度约在600-1000bp(图2-B);再将这4个片段两两连接,形成2个较大片段,约1500bp(图2-C);最后将2个较大片段连成一个完整的长度为2998bp 的大分子序列(图2-D)。将该片段通过平端连接的方式连接到pBS Inter+载体上。然后将克隆的水稻内标基因SPS(图2-E)通过用SacⅠ单酶切的方式插入到pBS Inter+载体中,构建成水稻转基因检测用的阳性质粒分子,并命名为pBS Rice(图1)。以pBS Rice质粒为模板,分别用引物组合KMD1-F/NPTⅡ-R和SPS-F/SPS-R进行PCR扩增,并测序验证后发现扩增序列与预期大小的片段一致。结果表明构建的转基因水稻检测用质粒分子包含了水稻SPS内标基因及正确的8个检测靶标。
2.3 阳性质粒分子的应用

图2 基因扩增和重组PCR拼接过程
使用表2中各基因元件的筛查检测引物,以本研究构建的阳性质粒分子pBS Rice作为阳性对照,以非转基因水稻珍汕97做阴性对照,分别以转基因水稻TT51-1、KF-6、KMD1、非转基因水稻明恢63作为样品,进行PCR扩增,考察转基因水稻检测用阳性质粒分子pBS Rice在实际检测工作中的适用性。定性PCR结果(图3)显示,SPS基因在阳性质粒分子和所有水稻样品中均有预期扩增产物;8对检测引物在质粒分子pBS Rice和含有相应靶标的样品中均有预期扩增产物。如CaMV35S启动子在质粒分子、KF-6和KMD1中均有预期扩增产物,在阴性对照、TT51-1和明恢63中没有扩增;Bar基因只在质粒分子中有扩增,其他样品中无扩增;TT51-1特征序列只在质粒分子和TT51-1样品中有扩增,其他样品中没有扩增。 扩增结果表明,本研究构建的质粒分子pBS Rice在转基因水稻检测中可以代替转基因水稻原材料作为阳性对照,适用于转基因水稻的筛查检测和TT51-1、KF-6、KMD1的事件特异性检测,具有良好的适用性和可替代性。
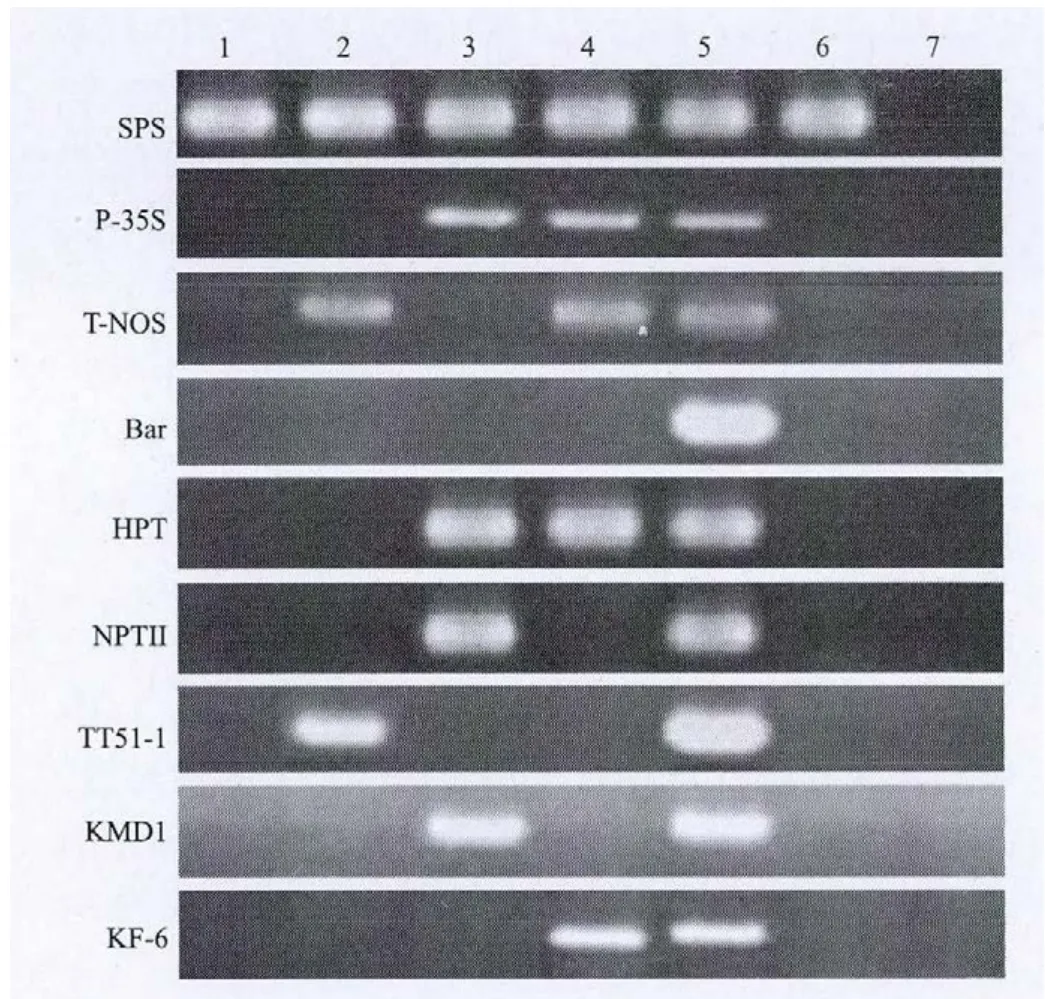
图3 阳性质粒作为对照筛查转基因作物检测图谱
3 讨论
由于生物技术产业迅速发展,转基因作物田间试验的频次也在不断攀升,至2009年,我国有记录的田间试验达4000多次,其中水稻有480余次。我国的水稻基础研究及转基因研究都位居世界的前列,水稻又是我国的主粮,其安全与国家的粮食安全息息相关,因此对转基因水稻的安全监管形势尤其严峻。近年来,我国也不断完善转基因植物及其产品检测标准体系,包括事件特异性检测标准和筛查检测标准。但检测机构在执行标准的过程中,经常遇到无适合的标准物质可用的难题,尤其是进行筛查检测时,通常用混合的转基因材料作为对照,有时会影响检测结果的判定。从实际检测需求出发,我们统计分析了目前能获知遗传转化信息的转基因水稻中调控元件和功能基因的种类及使用频率。
在水稻的抗虫改良中,经常会用苏云金芽孢杆菌晶体蛋白(Bt)基因,Bt基因种类很多,目前已在转基因作物中应用的Bt基因有Cry1Aa、Cry1Ab、Cry1Ac、Cry1A105、Cry1F、Cry2Ab、Cry3A、Cry3Bb1、Cry34Ab1、Cry35Ab1和Cry9c等,基因间的序列差异很大。在实际应用中,为了增强晶体蛋白的杀虫性,经常会对Bt基因的密码子进行修饰,如KMD1中的Cry1Ab基因。在转基因检测中,无法设计出通用引物检测所有Bt基因,因此本研究没有将Bt基因作为转基因水稻筛查检测的靶标。根据转基因水稻中基因元件的使用频率,结合水稻基因工程研究中标记基因的实际应用情况,确定将CaMV35S启动子、NOS终止子、Bar基因、HPT基因和NPTⅡ基因作为转基因水稻筛查检测的靶标。
将水稻内标基因SPS、筛选靶标(CaMV35S启动子、NOS终止子、Bar基因、HPT基因和NPTⅡ基因)、事件特异性检测靶标(TT51-1、KF-6、KMD1)聚合克隆到质粒载体上,构建质粒分子pBS Rice。利用质粒分子pBS Rice作为阳性对照,可以对转基因水稻进行筛查检测。若检测结果为阳性,可进一步利用质粒分子pBS Rice作为阳性对照,对阳性样品进行身份鉴定。若阳性样品的身份不是TT51-1、KF-6或KMD1,则可判定处于研发阶段的转基因水稻非法流散到了市场上。应用结果表明,阳性质粒分子pBS Rice既适用于转基因水稻的筛查检测,也适用于抗虫水稻TT51-1、KF-6和KMD1的事件特异性检测,本研究提供了一种不依赖于转基因水稻阳性原材料供应的安全监管转基因水稻检测用阳性对照。
4 结论
通过分析国内外转基因水稻材料的分子特性及转化元件,构建了一个适于转基因水稻筛查检测和身份鉴定的阳性质粒分子,该质粒分子不需依赖于转基因水稻原材料的供应,解决了转基因水稻安全监管工作中缺乏阳性对照的难题。
[1] Toriyama K, Arimotoa Y, Uchimiyaa H, et al.Transgenic rice plants after direct gene transfer into protoplasts [J].Nature Biotechnology,1988, 6:1072-1074.
[2] Zhang HM, Yang H, Rech EL, et al.Transgenic rice plants produced by electroporation-mediated plasmid uptake into protoplasts [J].Plant Cell Reports, 1988, 7:379-384.
[3] Zhang W, Wu R.Efficient regeneration of transgenic plants from rice protoplasts and correctly regulated expression of the foreign gene in the plants [J].Theor Appl Genet, 1988, 76:835-840.
[4] James C.Global Status of Commercia-lized Biotech/GM Crops [M].Ibercaja, Spain:The International Service for the Acquisition of Agribiotech Applications, 2012.
[5] Shu QY, Ye GY, Cui HR, et al.Transgenic rice plants with a synthetic cry1Ab gene from Bacillus thuringiensis werehighly resistant to eight lepidopteran rice pest species [J].Molecular Breeding, 2000, 6:433-439.
[6] Lu CM.The first approved transgenic rice in China [J].Genetically Modified Crops, 2010, 1:113-115.
[7] Tu J, Datta K, Alam MF, et al.Expression and function of ahybrid Bt toxin gene in transgenic rice conferring resistance to insect pests [J].Plant Biotechnology, 1998, 15(4):195-203.
[8] Tu J, Zhang GA, Datta K, et al.Field performance of transgenic elite commercialhybrid rice expressing Bacillus thuringiensis dendotoxin[J].Nature Biotechnology, 2000, 18:1101-1104.
[9] Tu J, Datta K, Oliva N, et al.Site-independently integrated transgenes in the elite restorer rice line Minghui 63 allow removal of a selectablemarker from the gene of interest by self-segregation [J].Plant Biotechnology Journal, 2003, 1:155-165.
[10] 舒庆尧, 叶恭银, 崔海瑞, 等.转基因水稻”克螟稻”选育[J].浙江农业大学学报, 1998, 24(6):579-580.
[11] Rong J, Song ZP, Su J, et al.Low frequencies of transgene flow between Bt/CpTI rice and their nontransgenic counterparts under alternating cultivation [J].Biodivers Sci, 2006, 14:309-314.
[12] 李冬虎, 傅强, 王锋, 等.转sck/cry1Ac双基因抗虫水稻对二化螟和稻纵卷叶螟的抗虫效果[J].中国水稻科学, 2004, 18(1):43-47.
[13] 赵红盈, 张永军, 吴孔明, 等.转cryAc/CpTI双价抗虫水稻cry1Ac杀虫蛋白的表达特性及其对二化螟的毒杀效果[J].农业生物技术学报, 2004, 12:76-79.
[14] Marta H, Adolfo R, Teresa E, et al.A rapeseed-specific gene,acetyl-CoA carboxylase, can be used as a reference for qualitative and Real-Time quantitative PCR detection of transgenes frommixed food samples [J].Journal of Agricultural and Food Chemistry,2001, 49(8):3622-3627.
[15] 李飞武, 李葱葱, 邢珍娟, 等.抗草甘膦系事件特异性定量PCR检测方法的建立[J].大豆科学, 2009, 28(2):296-300.
[16] Lievens A, Bellocchi G, De BD, et al.Use of pJANUS02-001 as a calibrator plasmid for Roundup Ready soybean event GTS40-3-2detection:an interlaboratory trial assessment [J].Analytical and Bioanalytical Chemistry, 2010, 396(6):2165-2173.
[17] Yang LT, Pan AH, Zhang KW, et al.Qualitative and quantitative PCRmethods for event-specific detection of geneticallymodified cotton Mon1445 and Mon531 [J].Transgenic Research, 2005, 14(6):817-831.
[18] Hernandez M, Pla M, Esteve T, et al.A specific real-time quantitative PCR detection system for event MON810 inmaize Yield Gard based on the 3¢ -transgene integration sequence [J].Transgenic Research, 2003, 12(2):179-189.
[19] Lee SH, Min DM, Kim JK.Qualitative and quantitative polymerase chain reaction analysis for geneticallymodifiedmaize MON863 [J].Journal of Agricultural and Food Chemistry, 2006, 54:1124-1129.
[20] Nielsen CR, Berdal KG, Holst-Jensen A.Characterization of the 5 integration site and development of an event-specific real-time PCR assay for NK603maize from a low starting copy number [J].European Food Research and Technology, 2004, 219:421-427.
[21] Made D, Degner C, Grohmann L.Detection of geneticallymodified rice:a construct-specific real-time PCRmethod based on DNA sequences from transgenic Bt rice [J].European food Research and Technology, 2006, 224:271-278.
[22] Wu G, Wu YH, Nie SJ, et al.Real-time PCRmethod for detection of the transgenic rice event TT51-1 [J].Food Chemistry, 2010,119(1):417-422.

