苹果轮纹病菌的多基因联合鉴定
贾广成 周增强 侯珲 王丽 朱建兰
苹果轮纹病是苹果生产中一种重要病害,主要危害苹果枝干和果实,因其防治难、危害重,是目前我国苹果生产的重要制约因素之一[1]。ITS基因,EF-1α基因和β-tubulin基因的 cDNA 序列已经从多种真菌中分离并对其生物学功能进行了初步研究[2]。GUADET等将分子系统学方法引入镰孢菌属种鉴定,主要通过ITS-rDNA、EF-1α、β-tubulin 等手段对镰孢菌进行系统学研究。微管是真核生物中普遍存在的结构,与微丝和中间纤维一起组成细胞质中三维网络结构的骨架系统。微管的组成为微管蛋白,主要的两种微管蛋白为A和B微管蛋白,A微管蛋白和B微管蛋白形成微管装配的基本单位-微管蛋白异二聚体。1963年,Ledbetter和Porter最先报道在植物细胞中存在微管结构。在植物病菌中,报道了若干 ITS基因,EF-1α基因和β-tubulin基因[3,4]的相关序列,但对其生物学功能还未进行深入研究[5]。微管蛋白和转录因子是真菌基因组主要的基因,在病菌的侵染过程中具有非常重要的作用。开展微管蛋白和转录因子的研究将为阐明苹果轮纹病菌在侵染过程中的致病机理提供理论依据[6]。为了鉴定苹果轮纹病菌并明确其主要致病基因的存在状况,从有代表性的苹果种植区采集并分离10个苹果轮纹病菌菌株,对引起苹果轮纹病的病原进行鉴定,并对病原的主要致病基因的存在状况进行初步研究,旨在达到联合鉴定苹果轮纹病菌的目的。
1 材料与方法
1.1 材料
从河南、辽宁和山东苹果种植区选择10株菌株。这些菌株采集于发病的枝干和果实,后经单孢或单菌丝分离得到,由中国农业科学院郑州果树研究所保存。
1.2 方法
1.2.1 致病力测定 接种材料为富士苹果一年生枝条,接种地点为中国农业科学院郑州果树研究所南园。用 70%乙醇对接种区域表皮进行消毒,待乙醇挥发后取菌饼接于树皮光滑部位,接后用沾有无菌水的脱脂棉浸缚在菌饼上,随后立即缠上塑料条保湿。致病力测定试验设3个小区,每个小区内每个菌株接种1棵苹果苗,每棵苗接种3个枝,每个枝上接3个点,整个试验重复两次。致病力测定的接种时间为2012年6月20日,调查时间为2012年11月10日,调查每个接种点的瘤状凸起的发生情况,并记录发病等级,最后计算病情指数。
分级标准如下表1所示。

表1 病情指数分级标准
1.2.2 菌体准备 将菌种接种于PSA斜面培养基上,26℃培养3d,挑菌于100mL液体培养基中,在220r/min的摇床上于26℃培养3-4d,离心收集菌体,用无菌蒸馏水洗涤菌丝3次,保存于-20℃冰箱。
1.2.3 DNA提取 用无菌竹签挑取菌丝体1g加入研钵中,并加入预先准备好的液氮,研磨至菌落分散至单个细胞,即无成团菌丝体存在。将研磨液吸入1.5mL的灭菌EP管中,加入100μL预热至35℃的裂解液,并且震荡摇匀5s,加入400μL的65℃预热的抽提液,倒置震荡5s。加入600μL的Tris饱和酚氯仿抽提液,混匀5s,12000r/min离心5min。取离心后的上清液入另一只灭过菌的EP管中,加入等体积的异丙醇离心沉淀。用70%的乙醇再洗涤一次,离心后倒出乙醇,风干EP管,至无酒精气味后,加入30μL TE溶液(pH8.0)溶解,各菌种DNA样品取出2μL用于0.8%的琼脂糖凝胶电泳,用120 V电压电泳30min后,在320nm紫外灯下观测。最后存于-20℃的冰箱中备用。
1.2.4 基因扩增[7]采用引物ITS1和ITS4扩增rDNA ITS1+5.8+ITS2片段。采用引物728F和986R扩增EF-1α基因片段。采用引物Bt2a和Bt2b扩增β-tubulin基因片段。
引物 ITS1:5'-TCCGTAGGTGAACCTGCG-3',ITS4:5'-TCCTCCGCTTATTGATAT-3'。
引物 728F:5'-CATCGAGAAGTTCGAGAAGG-3',986R:5'-ACTTG-AAGGAACCCTTACC-3'。
引物 Bt2a:5'-GGTAACCAAATCGGTGCTGCTTTC-3',Bt2b:5'-ACCCTCCAGTGTAGTGACCCTTGGC-3'。
PCR 反应体系为50μL:ddH2O 33.5μL,10×PCR buffer 5μL,dNTP(2.5mmol/L)5μL,Taq 酶(5U/μL)0.5μL,引物11μL,引物21μL,模板4μL(50ng/μL)。反应条件为:94℃预变性 2min;94℃变性 30s,55℃退火30s,72℃延伸 40s,共35个循环;最后 72℃延伸 8min。扩增产物经1%的琼脂糖电泳检测后,由上海生工进行双向测序,拼接好的序列用于序列分析。
1.2.5 序列比对和系统发育树的构建 测得序列用Sequencing Analysis 5.2(Applied Biosystems)软件反复进行校对,去除两端不确定的序列后,在 GenBank中进行 BLASTn比较搜索,下载同源性序列;同时下载 GenBank 中Botryosphaeria 的ITS基因、EF-1α基因和β-tubulin基因序列进行分析。运用 MEGA5分别计算不同种及亚种之间的遗传距离(p-distance)和碱基差异数目,并构建系统发育树[2]。
2 结果
2.1 苹果轮纹病菌株情况苹果轮纹病菌株情况如表2所示。
2.2 序列相似度比较
将PCR 产物电泳后于紫外透射下观察,分别在约540bp、440bp与250bp出现一条清晰的cDNA条带。DNAMAN软件分析将所测得的ITS基因、β-tubulin基因和EF-1α基因序列通过查询NCBI网站,对序列进行比对。
病原菌的rDNA-ITS序列测定结果菌株经过测序后获得约540bp的DNA序列,GenBank 检索结果(表3)表明,HX11,PY19和ZZ42菌株ITS序列与Botryosphaeria dothidea的同源性达到100%,其它菌株同源性均为99%。
病原菌的β-tubulin基因序列经过测序后获得约450bp的DNA片段,GenBank 检索结果(表4)表明,全部菌株β-tubulin基因序列与Botryosphaeria dothidea的同源性达到99%。
病原菌的EF-1α基因序列测定结果菌株经过测序后获得约250bp的DNA序列,GenBank 检索结果(表5)表明,HL1、PY19、YC5、YT1和ZZ42菌株EF-1α基因序列与Botryosphaeria dothidea的同源性达到100%,HX11和YC6菌株菌株 EF-1α基因序列与Botryosphaeria dothidea的同源性达到99%,其它菌株同源性均为98%。

表2 苹果轮纹病菌株在田间的病情指数

表3 苹果轮纹病菌株ITS基因序列与GenBank中ITS基因序列相似度比较

表4 苹果轮纹病菌株β-tubulin基因序列与GenBank中β-tubulin基因序列相似度比较
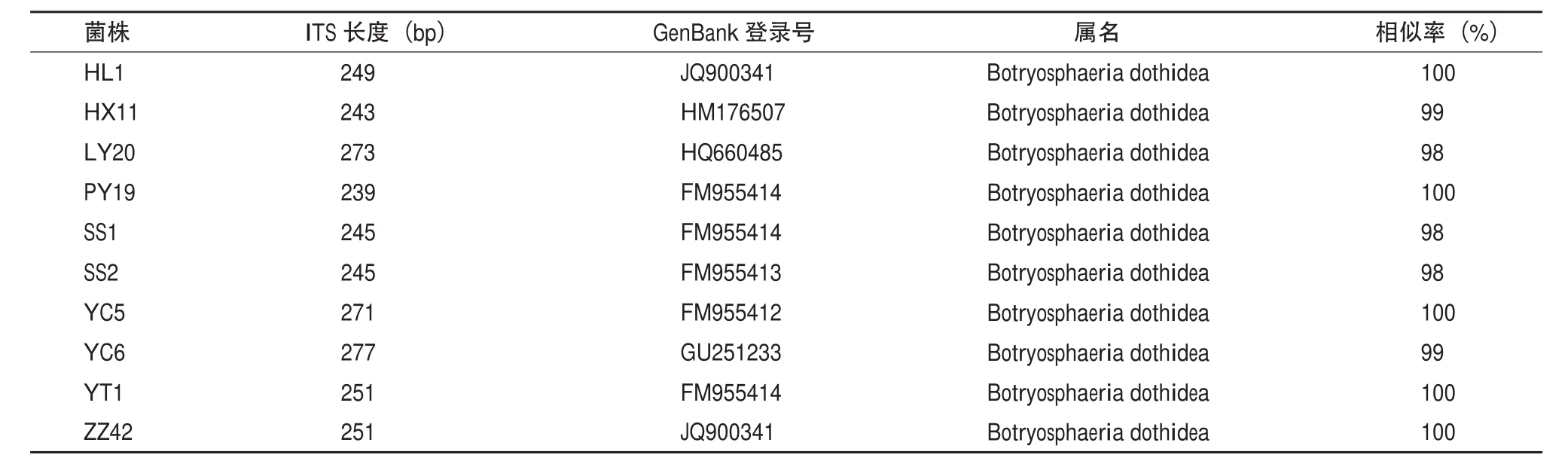
表5 苹果轮纹病菌株EF-1α基因序列与GenBank中EF-1α基因序列相似度比较
2.3 菌种的的系统进化分析[8]
各菌种ITS基因、EF-1α基因和β-tubulin基因序列间的遗传相似性极大,构建分子系统树,系统树上各分枝上的数值为经1000次Bootstrap后的置信度。初步探讨了各菌种间的遗传关系。
根据10个供试苹果轮纹病菌的ITS基因序列和从NCBI上下载的4个其它菌株,利用DNAMAN软件比对后经MEGA5.0软件分析构建上述物种的系统进化树。由系统进化树(图1)可以看出,比对为Botryosphaeria dothidea的10个供试苹果轮纹病菌与同属的 Botryosphaeria corticis、Botryosphaeria sp、Botryosphaeriamamane和Botryosphaeria iberica可以明显的区分。系统进化树与NCBI中比对的结果一致,表明了试验结果的可信性,可以确定苹果轮纹病菌的病原菌为Botryosphaeria dothidea。
10个供试苹果轮纹病菌的β-tubulin基因序列和从NCBI上下载的3个其它菌株,利用DNAMAN软件比对后经MEGA5.0软件分析构建上述物种的系统进化树。由系统树(图2)可见,所有菌株可分成两大支,其中一支为HL1、YC6、SS2、LY20、PY19、YC5、ZZ42, 另 一 支 为 SS1、YT1、HX11、JN607129、JQ659299,DQ008335, 这 两 支之间的亲缘关系也很近。但在SS1、YT1、HX11、JN607129、JQ659299,DQ008335 这支中 SS1、YT1、HX11 和 Botryosphaeria rhodina、Botryosphaeria sp,Botryosphaeria corticis也是有发育上的分化。

图1 苹果轮纹病菌ITS基因碱基序列构建的系统发育树

图2 苹果轮纹病菌β-tubulin基因碱基序列构建的系统发育树
根据10个供试苹果轮纹病菌的EF-1α基因序列和从NCBI上下载的3个其它菌株,利用DNAMAN软件比对后经MEGA5.0软件分析构建上述物种的系统进化树。由系统进化树(图3)可以看出,比对为Botryosphaeria dothidea的10个供试苹果轮纹病菌与同属的 Botryosphaeria corticis、Botryosphaeria sp、Botryosphaeriamamane和Botryosphaeria iberica无法区 分。SS1、SS2和 HX11与 Botryosphaeriamamane的亲缘关系更近。
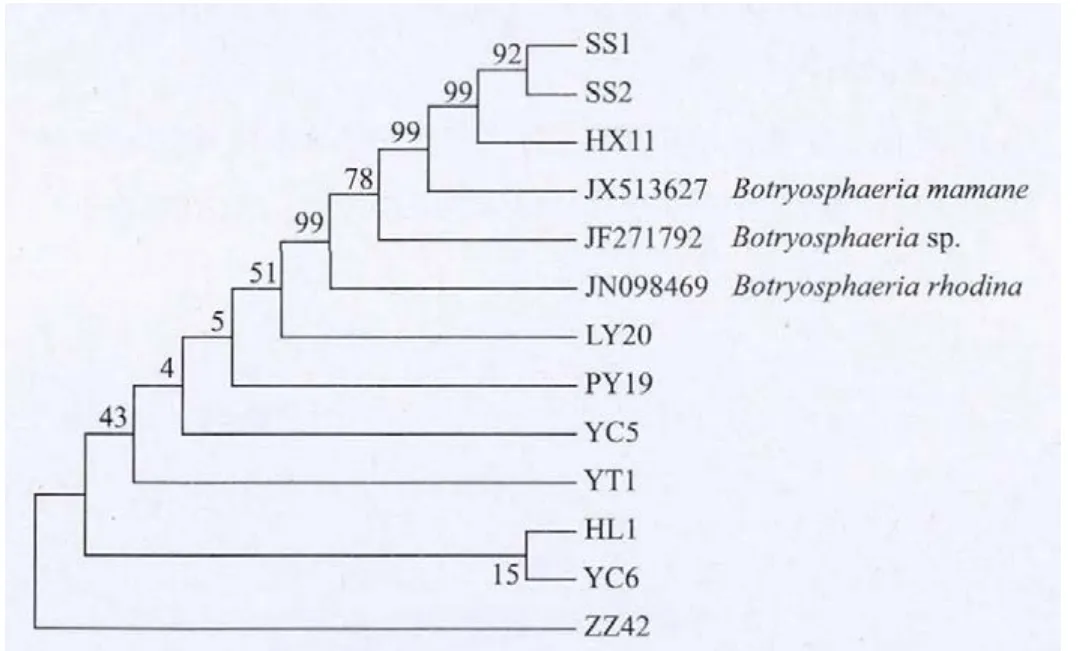
图3 苹果轮纹病菌EF-1α基因碱基序列构建的系统发育树
3 讨论
PCR技术是模拟自然界DNA复制过程,从而快速准确得到更多DNA样本[9]。基因检测是用于DNA序列的测定,基因表达谱鉴定和基因突变体的检测和分析[10]。本研究中使用了DNAMAN和MEGA两种软件对苹果轮纹病菌的遗传关系进行分析,并且得到了相似的结果,说明以上两种软件均可使用。
随着微管的发现,其诸多重要的生物学功能也被发现[11]。研究表明,微管与维持细胞形态、细胞的有丝分裂、细胞内物质运输、细胞壁构建等植物重要的生理活动有着密切的联系[12]。随着分子生物学技术的发展,多种真核生物中的微管蛋白基因被扩增出来,微管已经成为生物学领域研究的热点。微管蛋白基因核酸及氨基酸序列的比较分析研究表明,微管蛋白是生物进化中最为保守的蛋白质之一。植物中的微管蛋白高度保守。在植物细胞中引入不同植物物种的微管蛋白,外源微管蛋白可以被组合进入植物微管列阵,却不影响其功能[13]。本研究克隆得到的10条β-tubulin基因序列和Botryosphaeria dothidea中的高相似性,同样证明了苹果轮纹病菌中B微管蛋白的高度保守性。目前,基于β-tubulin基因在真核生物中广泛存在的特点,以及β-tubulin基因的植物系统发育学研究已取得的成绩,β-tubulin基因将在苹果轮纹病菌的系统发育和亲缘关系研究中具有十分重要的意义。在进行有关核酸序列分析的时候,最好同时用不同的软件进行分析,可以做到相互印证所分析的结果。
延伸因子EF-1α基因是一种编码蛋白质的单拷贝核基因,在t RNA转运到核糖体的过程中发挥作用,在研究系统发育方面具有重要作用,同时,EF-1α基因中也存在一些进化速度比较快的内元,因此它也可以分析低级阶元的系统发育,许多学者对其在分子系统学上的应用已经做了大量的尝试。Caterino等(2000)主张将 EF-1α基因作为分子系统学研究中的标准分子标记[14]。
4 结论
苹果轮纹病菌的ITS基因序列相似性很高,苹果轮纹病的病原菌是Botryosphaeria dothidea。证明了EF-1α基因和β-tubulin基因分化趋势,这与测得的苹果轮纹病菌田间致病力的分化相对应。EF-1α基因和β-tubulin基因与菌株的致病力有相关性,但EF-1α基因和β-tubulin基因复杂的分子作用机制还需进一步的深入研究。
[1] 苏平, 周增强, 侯珲, 王丽, 朱建兰.苹果轮纹病菌对戊唑醇的敏感性检测.果树学报, 2010, 27(1):69-76.
[2] Yli-Mattilat T, Mach RL, Alekhinaia IA.Phylogenetic relationship of Fusarium langsethiae to Fusarium poae and Fusarium sporotrichioidesas and inferred by IGS, ITS, β-tubulin sequences and UP-PCRhybridization analysis[J].International Journal of Food Microbiology, 2004, 95:267-285.
[3] 戴芳澜.中国真菌总汇[M].北京:科学出版社, 1979:1-1527.
[4] 黄胜雄, 胡尚连, 孙霞, 蒋瑶.慈竹B-tubulin 基因片段的克隆及序列分析[J].福建林业科技, 2009, 36(1):8-10.
[5] 李洪杰, 王晓鸣, 宋凤景, 等.中国小麦品种对白粉病的抗性反应与抗病基因检测[J].作物学报, 2011, 37(6):943-954.
[6] 董金皋, 农业植物病理学[M].北京:中国农业出版社, 2001,297.
[7] 王敏.基于PCR技术的基因检测技术研究[J].生命科学仪器,2008, 6(3):34-36.
[8] 张琪, 薛慧良, 徐金会, 等.黑线仓鼠CRH 基因的编码序列及系统进化分析[J].生物技术通报, 2012(10):88-94.
[9] 邹志文, 陈芬, 余丽萍, 夏斌.几种常见桔园螨类Wolbachia基因检测与序列分析[J].生态学杂志, 2011, 30(3):547-551.
[10] 张羽, 王胜宝, 冯志峰, 张彦清.陕西省水稻种质资源的香味基因检测[J].西北农林科技大学学报:自然科学版, 2011,39(4):55-59.
[11] 杜予州, 王莉萍, 陆亚娟, 等.美洲斑潜蝇不同寄主种群及地理种群间的β-tubulin 基因序列分析[J].中国农业科学,2008, 41(5):1542-1547.
[12] Snustad DP, Haas NA, Kopczak SD.The small genome of Arabidopsis contains at least nine expressed B-tubulin genes[J].Plant Cell, 1992, 4:549- 5561
[13] Villemur R, Haas NA, Joyce CM.Characterization of four new B-tubulin genes and their expression duringmale flower development inmaize(Zeamays L)[J].Plant Mol1Biol, 1994,24:295-315.
[14] 陈璐, 高增贵, 庄敬华, 等.玉米顶腐镰孢菌rDNA-ITS和EF-1a基因序列及UP-PCR遗传多样性分析[J].沈阳农业大学学报, 2011, 42(1):31-36.
——水芹主要害虫识别与为害症状

