5-HT6受体在血管性痴呆大鼠海马中的表达变化
陈小东 李 园园 刘 雁 (广州医科大学研究生院,广东 广 州 5 082)
脑血管病,尤其是脑卒中后慢性脑缺血被认为是血管性痴呆(VD)的最常见病因,其病理生理机制涉及缺血后继发的脑能量代谢障碍、炎症因子的瀑布效应、氧化应激损伤、兴奋性氨基酸毒性作用、胆碱能神经元功能缺失等〔1〕。5-羟色胺(5-HT)受体家族在中枢神经系统认知、情感、摄食、昼夜周期等生理活动中具有调节作用〔2〕,其中,5-HT6受体几乎仅分布在中枢神经系统,尤其以纹状体、皮层、边缘系统等脑区的分布密度高,已被证实参与大脑学习、记忆、情感等高级智能和精神活动〔3〕。本文采用大鼠永久性双侧颈总动脉阻断模型,观察脑缺血后海马病理变化及CA1区5-HT6表达的改变,探讨该受体与VD发病的相关性。
1 材料与方法
1.1 材料
1.1.1 实验动物 健康SPF级Wistar大鼠80只,购自南方医科大学动物实验中心,体重200~250 g,雌雄比例为1∶1,所有实验大鼠饲养于广州军区广州总医院动物中心,饲养房内温度(22 ±3)℃,湿度60%,5 只/笼,光/暗周期为12 h/12 h,实验期间自由获取水及标准颗粒饲料。
1.1.2 主要试剂 兔抗鼠5-HT6受体多克隆抗体购自Abcam公司,Envision二步法检测试剂盒购自Dako公司,二氨基联苯胺(DAB)试剂购自福州迈新生物公司,其余化学试剂均为分析纯级。
1.1.3 主要仪器 Morris大鼠水迷宫,SuperMaze动物行为学视频分析系统(上海欣软信息科技),日本Olympus BX-51显微镜,ImagePro plus病理图文分析系统。
1.2 方法
1.2.1 动物分组及模型制作 所有大鼠适应性饲养1 w后随机分成两组,VD组50只,假手术组(SO组)30只。动物术前禁食、禁水4 h,称重后以10%水合氯醛按350 mg/kg体重腹腔注射麻醉,将大鼠仰卧位固定后常规消毒颈部手术区域,在颈前正中作一长约1 cm的纵形切口,钝性分离皮下软组织、颈前肌群,在气管的侧后方找到颈动脉鞘,分离颈总动脉与迷走神经,以1号丝线永久性结扎颈总动脉,同法结扎另一侧颈总动脉,局部消毒后恢复组织层次并缝合皮肤。SO组大鼠除不结扎双侧颈总动脉外,其余操作与VD组大鼠一致。术后动物另放于干净鼠笼饲养,自由获取水源及饲料。
1.2.2 动物行为学观察(Morris水迷宫实验) 大鼠Morris水迷宫为一内径160 cm、高50 cm的圆形水池,水池内壁被漆成黑色,池壁上黏贴不同形状的空间标记物,一个直径为12 cm的逃生平台固定于水池中的某一象限(即目标象限),进水后水面高出平台约1 cm,水池上方横架安装连接计算机显示系统的摄像仪。
SO组和VD组大鼠分别在双侧颈总动脉阻断术后4、8 w进行 Morris水迷宫实验,第 1 ~4 天(即 trial 1、trial 2、trial 3、trial 4)将大鼠从四个不同象限面向水池壁放入水中,大鼠找到逃生平台后终止信息采集,最长采集时间为120 s,若超过120 s大鼠仍未能找到平台,则将其引导至逃生平台并在平台上站立20 s以使其形成对空间参照物的记忆,每只大鼠如此训练4次/d,每次训练之间有15 s间歇以便休息,连续训练4 d,记录大鼠找到平台的逃避潜伏期评估其空间学习能力;第5天将逃生平台从水池中撤去,将大鼠从四个不同象限投入水中,记录60 s内大鼠在目标象限搜寻的时间,以此评估大鼠的空间记忆能力。每天固定在8:00~17:00进行水迷宫实验,实验过程中保持房间内光照恒定并且无光线直射于水面,水温控制在26℃左右,迷宫外参照物保持不变。
1.2.3 组织标本固定、制片、染色 每组各取5~6只大鼠分别在术后的相应观察终点麻醉动物,以4℃预冷4%多聚甲醛溶液经心脏灌注固定,断头取脑后从视交叉后2~3 mm处冠状位切取厚度约3 mm的脑组织,放入10%中性甲醛溶液中固定24 h。在自动脱水机中梯度酒精脱水、透明、浸蜡后包埋,蜡块组织作连续冠状切片,厚度2~3 μm。石蜡切片脱蜡、水化后分别进行苏木素-伊红(HE)染色和Nissl染色,在光学显微镜高倍镜(×400)下观察海马CA1区锥体细胞计数及形态。
1.2.4 免疫组化显色分析海马CA1区5-HT6受体的分布与表达 石蜡切片经脱蜡、水化,置于pH6.0的柠檬酸盐中高压修复;0.01 mol/L PBS冲洗5 min×3次,3%过氧化氢溶液避光孵育10 min以阻断内源性过氧化物酶,0.01 mol/L PBS冲洗5 min×3次,切片滴加兔抗鼠5-HT6受体多克隆抗体(1∶1 000稀释),置于湿盒内 4℃冰箱中过夜孵育;次晨取出切片0.01 mol/L PBS冲洗5 min×3次,滴加葡聚糖复合物(二抗),室温下孵育40 min,0.01 mol/L PBS冲洗5 min×3次,滴加DAB显色,显微镜下观察显色合适后流水冲洗终止反应,梯度酒精脱水、TO生物透明剂透明,中性树胶封片后镜检观察。
1.3 统计学方法 应用SPSS13.0软件进行分析,计量资料采用±s表示,两组独立样本均数比较采用t检验,多个样本均数比较进行Levene方差齐性检验,方差齐采用单向方差分析,方差不齐采用Brown-Forsythe法;平均逃避潜伏期和平均游泳速度在满足Mauchly球对称检验时采用单个重复测量因素的方差分析,不满足Mauchly球对称检验经Huynh-Feldt系数校正自由度。
2 结果
2.1 大鼠Morris水迷宫结果 术后4、8 w,SO组和VD组大鼠在定位航行试验中的平均游泳速度均无明显统计学差异(P>0.05)。术后4 w和8 w,VD组大鼠与同时间点SO组大鼠平均逃避潜伏期比较均明显延长(P<0.001),提示VD组大鼠在术后无明显运动功能障碍,但存在空间学习能力减退,而且学习能力下降随脑缺血时间延长加重。术后4 w空间探索试验中,SO组和VD组大鼠目标象限的平均搜寻时间比较具有统计学差异(P<0.001),提示VD组大鼠空间记忆能力下降。见表 1,表 2,图 1。
表1 假手术组和血管性痴呆组大鼠在术后4 w和8 w定位航行试验的平均游泳速度比较(±s ,mm/s)
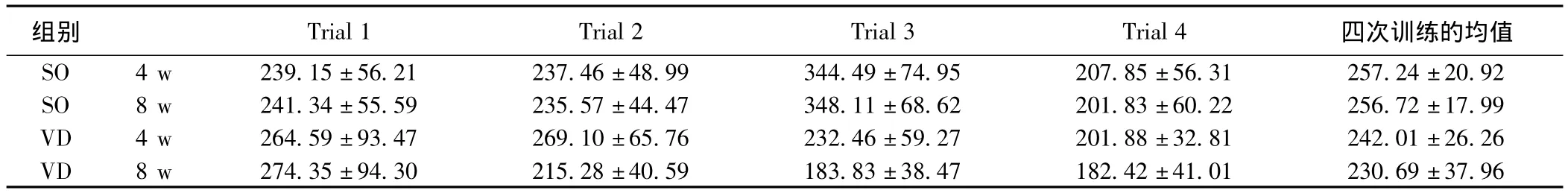
表1 假手术组和血管性痴呆组大鼠在术后4 w和8 w定位航行试验的平均游泳速度比较(±s ,mm/s)
组别 Trial 1 Trial 2 Trial 3 Trial 4四次训练的均值SO 4 w 239.15±56.21 237.46±48.99 344.49±74.95207.85±56.31 257.24±20.92 SO 8 w 241.34±55.59 235.57±44.47 348.11±68.62 201.83±60.22 256.72±17.99 VD 4 w 264.59±93.47 269.10±65.76 232.46±59.27 201.88±32.81 242.01±26.26 VD 8 w 274.35±94.30 215.28±40.59 183.83±38.47182.42±41.01 230.69±37.96
表2 假手术组和血管性痴呆组大鼠在术后4 w和8 w定位航行试验的平均逃避潜伏期比较(±s,s)
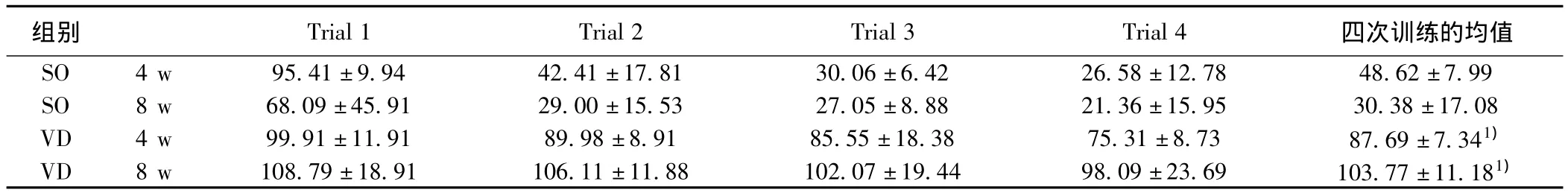
表2 假手术组和血管性痴呆组大鼠在术后4 w和8 w定位航行试验的平均逃避潜伏期比较(±s,s)
与SO组同时间点比较:1)P<0.05
组别 Trial 1 Trial 2 Trial 3 Trial 4四次训练的均值SO 4 w 95.41±9.94 42.41±17.81 30.06±6.42 26.58±12.78 48.62±7.99 SO 8 w 68.09±45.91 29.00±15.53 27.05±8.88 21.36±15.95 30.38±17.08 VD 4 w 99.91±11.91 89.98±8.91 85.55±18.38 75.31±8.73 87.69±7.341)VD 8 w 108.79±18.91 106.11±11.88 102.07±19.44 98.09±23.69 103.77±11.181)
2.2 VD大鼠海马CA1区组织病理学改变 HE染色后在高倍镜(×400)下,假手术组大鼠海马CA1区神经元排列整齐、紧密,胞膜完整,胞核清楚;术后2 d VD组海马CA1区未见明显的病理变化,锥体细胞数量略减少;术后1 w VD组海马CA1区神经元排列基本正常,但锥体神经元数量减少;术后4 w VD组CA1区神经元排列稀疏、紊乱,锥体细胞变性坏死、数量明显减少,胞核固缩,胞浆嗜酸性;术后8 w VaD组海马病理改变进一步加重,神经元细胞空泡化,锥体细胞基本消失。见图2。
尼氏染色后在高倍镜(×400)下,假手术组大鼠海马CA1区锥体神经元胞质中尼氏体丰富呈斑片状;术后2 d VD组大鼠海马CA1区锥体神经元形态结构基本正常,神经元尼氏体未见减少;术后1 w VD组海马CA1区锥体神经元空泡化改变,胞浆内尼氏体减少;术后4 w,VaD组海马CA1区锥体神经元固缩,细胞数明显减少;术后8 w,VD组海马CA1区锥体神经元排列稀疏、紊乱,胞浆中尼氏体显著减少。见图3,图4。
2.3 免疫组化分析海马CA1区神经元5-HT6受体表达变化与假手术组大鼠比较,VD组大鼠海马CA1区神经元5-HT6受体在术后2 d无明显变化,术后1 w表达略减少,在术后4~8 w亚组中表达明显减少(P<0.001)。见图5,表3。
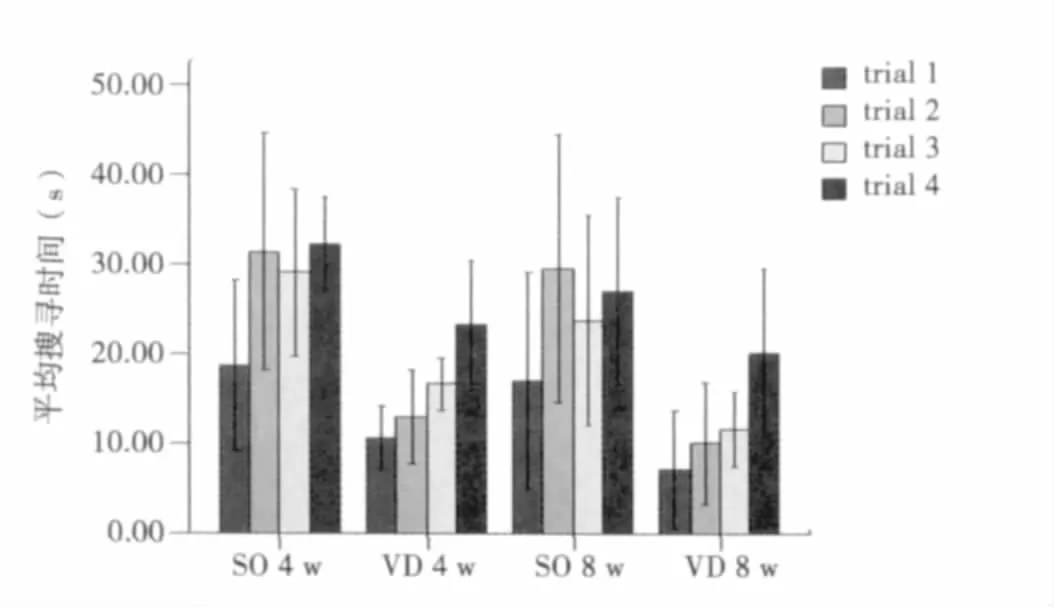
图1 两组大鼠在目标象限的平均搜寻时间比较
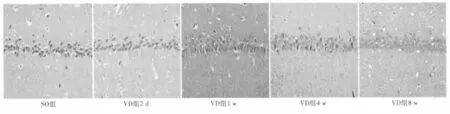
图2 海马CA1区HE染色(×400)
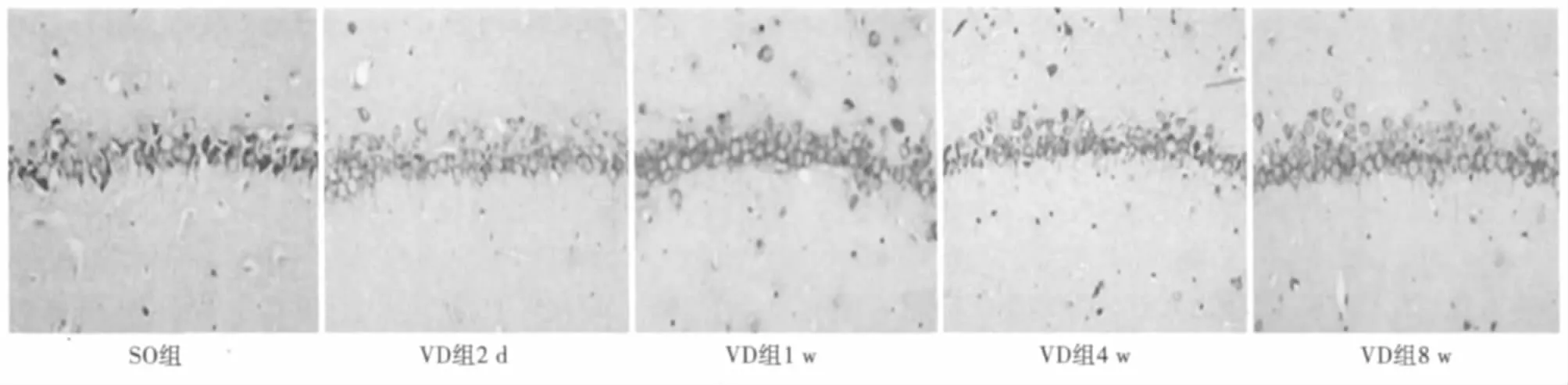
图3 海马CA1区尼氏染色(×400)
表3 两组大鼠海马CA1区神经元免疫组化5-HT6受体平均光密度分析(±s)

表3 两组大鼠海马CA1区神经元免疫组化5-HT6受体平均光密度分析(±s)
与术后同时间SO组比较:1)P<0.001
组别 SO组 VD组术后2 d 246.14±38.90 240.87±76.09术后1 w 234.59±47.31 220.53±96.34术后4 w 244.61±32.91 122.96±11.911)术后8 w 243.82±31.45 83.97±7.121)
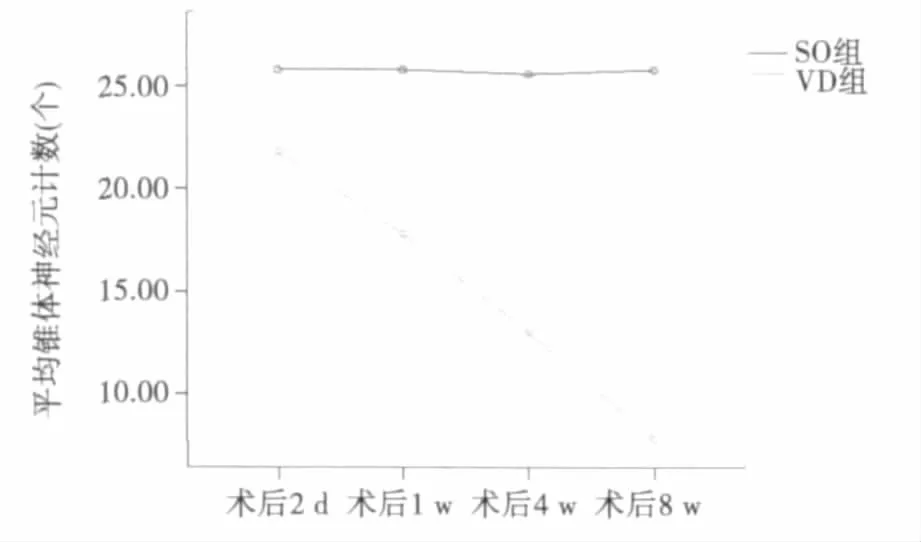
图4 两组大鼠海马CA1区锥体神经元计数
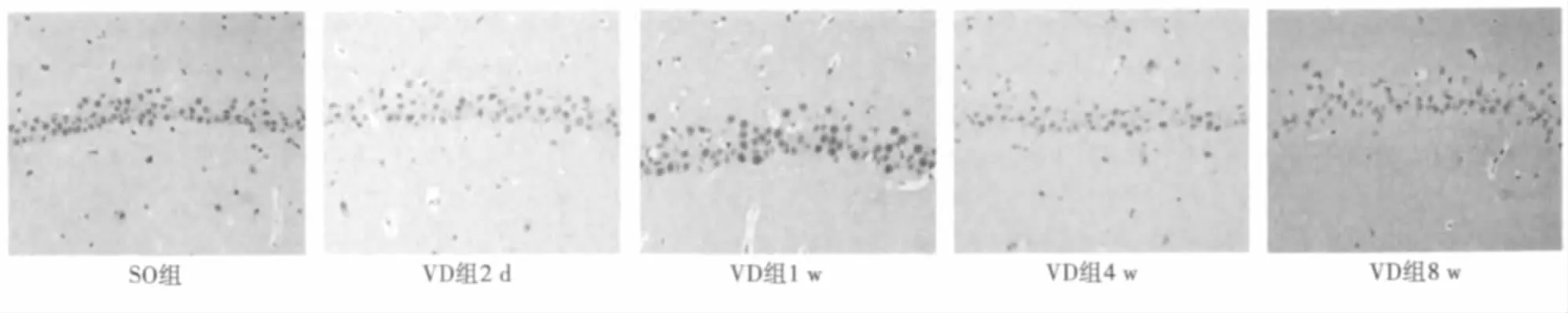
图5 免疫组化检测海马CA1区神经元5-HT6受体平均光密度
3 讨论
VD是各种脑血管因素相关病因所致脑血流循环障碍并引起与认知相关脑区神经元退行性改变、全脑功能退化的神经退行性疾病。本文采用大鼠双侧颈总动脉阻断模型模拟人类因慢性脑缺血、全脑低灌注所致的VD,该模型引起典型的皮层缺血性改变和皮层下白质病变,包括白质疏松化、脱髓鞘、胶质增生等,与人类老龄化或脑卒中后痴呆的神经病理改变相似,是VD的经典动物模型〔4〕。Farkas等〔5〕指出大鼠永久性双侧颈总动脉阻断模型术后脑血流的减少是有选择性的,以皮层和白质脑血流下降最为明显,仅为正常大鼠的35% ~45%,海马脑血流下降到正常大鼠的60%左右,术后1 w脑血流开始恢复,但4 w以后脑血流仍明显低于正常对照的动物,术后8~12 w脑血流基本恢复到正常水平。本实验观察发现缺血急性期海马损伤并不十分明显,术后1~2 w可以在海马观察到CA1区锥体神经元丢失、胶质细胞激活,并且这种缺血性损害随着脑缺血状态的持续而进行性加重,术后4 w海马CA1区锥体神经元明显减少,神经元空泡样变性,术后8 w海马病变呈毁灭性,锥体细胞显著减少,这与文献报道的结果一致〔6〕。虽然慢性缺血过程中脑血流通过侧支循环重建等各种代偿机制使全脑血流在8~12 w后逐渐恢复到正常水平,但低灌注对海马造成的缺血性损害是不可逆的。实验中术后8 w VD组大鼠在定位航行试验中逃避潜伏期较假手术对照组明显延长,空间探索试验中在目标象限的搜寻时间亦较假手术组减少,均提示海马缺血性损伤对VD大鼠造成的空间学习、记忆能力减退的影响。一方面,海马作为脑内参与学习、记忆等高级智能活动的重要脑区,因其特殊的供血结构而对缺血极为敏感,另一方面,锥体神经元长时程增强(LTP)是记忆形成的重要神经生理基础,推测海马慢性缺血性损伤、锥体神经元丢失参与了VD的发病机制。
目前,已发现5-HT受体家族包括七种分型(5-HT1~7R),5-HT1A、5-HT4和5-HT6受体是在多项动物实验研究中被发现与中枢神经系统认知、学习、记忆等思维活动密切相关的受体亚型〔7〕,其中,5-HT6受体几乎仅分布于中枢神经系统,而且其所分布的脑区均与人类的认知、学习、记忆、情感等功能相关,在脑内与乙酰胆碱、谷氨酸、γ-氨基丁酸、肾上腺素、去甲肾上腺素等多种参与学习、记忆、情感、认知过程的神经递质均有相互作用〔3〕。在与学习、记忆密切相关的海马,5-HT6受体主要分布在CA1区神经元突触后膜上。基于双侧颈总动脉阻断后脑血流的动态改变及海马缺血性损伤的时间特点,实验中选择了术后2 d、1 w、4 w、8 w作为5-HT6受体表达水平的观察时间点。行为学观察结果证实VD大鼠存在明显空间学习、记忆能力缺失,且这种学习、记忆能力的减退随脑缺血时间延长加重。结合免疫组化结果分析,VD大鼠海马CA1区神经元上5-HT6受体的表达在脑缺血术后1 w开始下降,以术后4~8 w受体表达下调最为显著,5-HT6受体表达的下调与动物学习、记忆功能下降的时间基本一致。基于Morris水迷宫是海马依赖性的行为学检测方法,因此推测VD大鼠空间学习、记忆能力减退与神经元5-HT6受体表达改变相关。一方面,考虑到慢性缺血对海马所造成的组织病理学改变,尤其是锥体神经元的变性坏死、丢失,可能导致受体蛋白表达、合成减少;另一方面,国外研究证实拮抗5-HT6受体可以促进脑内乙酰胆碱释放〔8,9〕,后者是记忆形成与维持的重要神经递质,而且动物行为学研究发现5-HT6受体拮抗剂能提高学习、记忆、改善认知功能〔10〕并可以逆转由抗胆碱能药物(如东莨菪碱)所致的记忆缺损,因此,可以推测慢性脑缺血后期5-HT6受体表达下调可能是中枢神经对抗缺血性损伤的一种保护机制,通过受体表达下调重新调节神经信息网络中其他神经递质,如乙酰胆碱、谷氨酸等的水平,从而提高中枢神经对缺血性脑损伤后认知功能障碍的耐受性。
综上所述,海马是高等动物学习、记忆过程中重要的信息整合中枢,5-HT6受体表达于海马CA1区神经元,拮抗该受体可以提高海马中乙酰胆碱的水平,在发生慢性脑缺血后上述区域该受体表达随缺血进展而减少可能是中枢神经信息网络重构的一种代偿机制。
1 Ae YLA.Vascular dementia〔J〕.Chonnam Med J,2011;47(2):66-71.
2 Filip M,Bader M.Overview on 5-HT receptors and their role in physiology and pathology of the central nervous system〔J〕.Pharmacol Rep,2009;61(5):761-77.
3 Woolley ML,Marsden CA,Fone KC.5-HT6receptors〔J〕.Curr Drug Targets CNS Neurol Disord,2004;3(1):59-79.
4 Jiwa NS,Garrard P,Hainsworth AH.Experimental models of vascular dementia and vascular cognitive impairment:a systematic review〔J〕.J Neurochem,2010;115(4):814-28.
5 Farkas E,Luitenb PG,Bari F.Permanent,bilateral common carotid artery occlusion in the rat:A model for chronic cerebral hypoperfusion-related neurodegenerative diseases〔J〕.Brain Res Rev,2007;54(1):162-80.
6 Woolley ML,Bentley JC,Sleight AJ,et al.A role for 5-HT(6)receptors in retention of spatial learning in the Morris water maze〔J〕.Neuropharmacology,2001;41(2):210-9.
7 King MV,Marsden CA,Fone KC.A role for the 5-HT1A,5-HT4 and 5-HT6receptors in learning and memory〔J〕.Trends Pharmacol Sci,2008;29(9):482-92.
8 Riemer C,Borroni E,Levet-Trafit B,et al.Influence of the 5-HT6receptoron acetylcholine release in the cortex:pharmacological characterization of 4-(2-bromo-6-pyrrolidin-1-ylpyridine-4-sulfonyl)phenylamine,a potent and selective 5-HT6receptor antagonist〔J〕.J Med Chem,2003;46:1273-6.
9 Foley AG,Murphy KG,Hirst WD.The 5-HT6receptor antagonist SB-271046 reverses scopolamine-disrupted consolidation of a passive avoidance task and ameliorates spatial task deficits in aged rats〔J〕.Neuropsychopharmacology,2004;29(1):93-100.
10 Mitchell ES,Neumaier JF.5-HT6receptors:a novel target for cognitive enhancement〔J〕.Pharmacol Ther,2005;108(3):320-3.

