淫羊藿苷对小鼠力竭游泳时间及力竭恢复小鼠血清生化指标的影响
臧 洁,李宝茹,吴 涛,刘明娟,杨建雄
陕西师范大学生命科学学院,西安 710062
在力竭运动中,机体耗氧增加,导致机体产生大量自由基,从而会造成脏器损伤,对细胞膜的损伤尤为严重。过多的自由基可以攻击细胞膜上的不饱和脂肪酸,引发脂质过氧化作用,从而破坏细胞膜的完整性,使膜流动性降低,通透性增加,离子泵功能下降,细胞代谢紊乱,并导致运动能力下降,诱发运动性疲劳[1]。我们前期的研究表明,淫羊藿苷能够抑制肾阳虚小鼠血清睾酮含量的下降[2],体外抗氧化活性研究表明,淫羊藿苷能够清除DPPH·、和OH·,抑制脂质过氧化,提高总抗氧化能力和总还原力[3],提示淫羊藿苷可能有抗疲劳作用。纵艳芳等[4]采用游泳训练模型研究了淫羊藿苷对大鼠的抗运动疲劳作用,但对运动恢复的作用未见研究报道。本文研究淫羊藿苷对小鼠力竭游泳时间及力竭恢复后血清生化指标的影响,探讨其抗疲劳和促恢复作用,为淫羊藿苷进一步的开发和利用提供参考。
1 材料与方法
1.1 实验动物与材料
昆明系雄性小鼠,购于西安交通大学医学院动物实验中心,体重(20±2)g。淫羊藿苷由陕西慧科植物开发有限公司提供,黄棕色粉末,纯度93.4%,用0.5%的羧甲基纤维素钠溶解。化学试剂均为国产分析纯。
1.2 动物分组与处理
实验动物适应性喂养2 d后,随机分为4组,每组8只,分别为对照组,ICA低剂量组,ICA中剂量组,ICA高剂量组。每天上午分别给低、中、高剂量组以30、90、270 mg/kg ICA,对照组小鼠用等体积的羧甲基纤维素钠灌胃,连续灌胃12 d。末次给药后禁食两小时,然后将小鼠置于21±1℃的水中进行一次性游泳至力竭,记录游泳时间。力竭的判断标准:小鼠沉入水中超过10 s,且放在平面无法完成翻正反射[5]。将小鼠置于干燥鼠笼中,恢复24 h后摘眼球采血备用。
1.3 血清生化指标的测定方法
将所采血液常规分离血清,4℃,3000 rpm离心5 min,取上清待测。ALT/AST的活性测定采用2,4-二硝基苯肼法,MDA含量的测定采用TBA(硫代巴比妥酸)比色法,BUN含量的测定采用Fearon反应,SG含量的测定采用葡萄糖氧化酶法。试剂盒均购自南京建成生物工程技术公司。所有指标测定均采用美国BioTek的Epoch超微量微孔板分光光度计完成。
1.4 LDH同工酶电泳及分析
采用不连续聚丙烯酰胺凝胶电泳分离LDH同工酶,用底物显色剂染色以显示同工酶位置。显色后采用FluorChem(5500)System凝胶图像分析系统分析。
1.5 数据处理
各组之间数据比较采用方差分析,用SPSS10.0统计软件包进行统计学处理,以¯X±SD表示结果。
2 结果和分析
2.1 ICA对小鼠力竭游泳时间的影响
由表1可知,ICA低、中剂量组游泳至力竭的时间显著长于对照组(P<0.05),而ICA高剂量组则与对照组无明显差异(P>0.05)。

表1 各组小鼠力竭游泳时间的比较(n=8)Table 1 Swimming time of all groups(n=8)
2.2 ICA对力竭游泳恢复小鼠血清生化指标的影响
由表2可以看出,ICA中剂量组ALT活性较对照组低(P<0.01),ICA低、高剂量则无显著差异(P>0.05);ICA低、中、高剂量组AST活性均较对照组低(P<0.05);ICA低、中剂量组MDA含量显著低于对照组(P<0.05),而ICA高剂量组则无显著差异(P>0.05);ICA低剂量组BUN含量显著低于对照组(P<0.05),ICA中剂量组BUN含量与对照组有极显著差异(P<0.01);各给药组SG含量与对照组相比无显著性差异(P>0.05)。

表2 各组小鼠血清生化指标的比较Table 2 Serum biochemical indicators of all groups
2.3 ICA对力竭游泳恢复小鼠血清LDH同工酶的影响
由图1和表3可见,ICA低、中剂量组LDH总活力较对照组低(P<0.01),ICA高剂量组则无显著差异(P>0.05);ICA低、中剂量组LDH4-5显著低于对照组(P<0.05);ICA中剂量组LDH1-2较对照组高(P <0.05)。
3 讨论
3.1 ICA对小鼠力竭游泳时间的影响
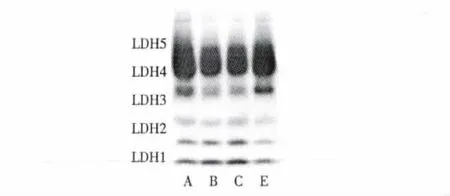
图1 ICA对力竭运动恢复小鼠血清LDH同工酶的影响Fig.1 The effect of ICA on the activity of LDH isozymes in serum after exhausted swimming and 24 h recovering
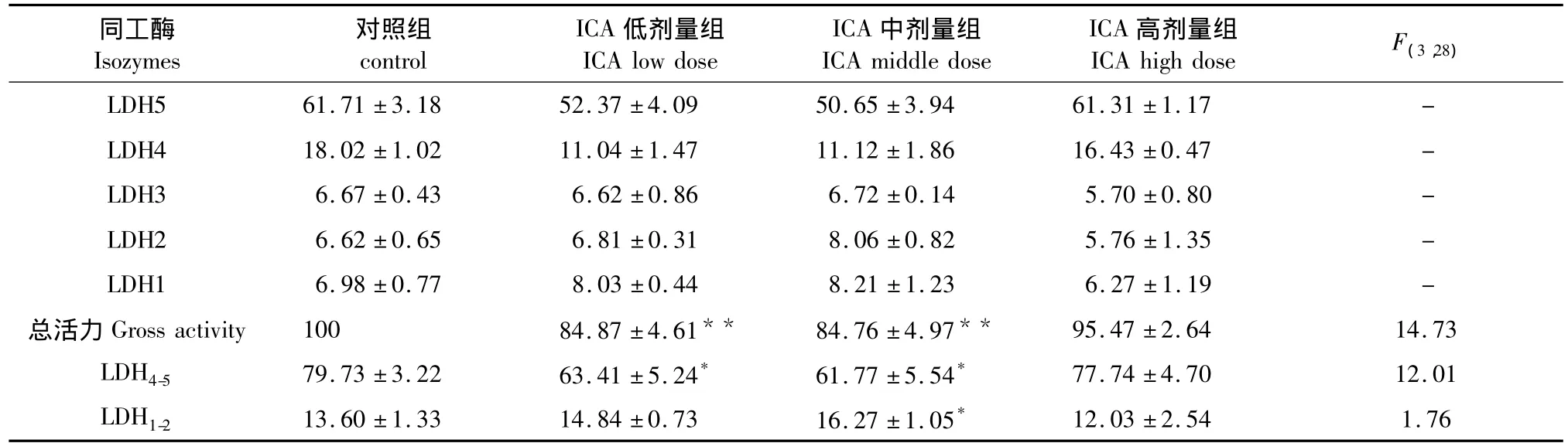
表3 各组小鼠血清LDH同工酶活力的比较Table 3 The activity of LDH isozymes in serum of all groups
游泳至力竭的时间是体能的综合表现,其不仅反映机体抗疲劳的能力,也反映机体的抗应激能力及对不良环境的适应能力[6]。实验结果表明,ICA可以延长小鼠游泳至力竭的时间,其中以低、中剂量组最为明显,显著长于对照组。纵艳芳等研究结果表明,淫羊藿苷显著地延长了训练大鼠游泳至力竭的时间,这与本实验结果相符,提示ICA可以延缓疲劳的发生。有研究表明,包括黄酮类在内的多酚,在合适剂量时,有抗氧化作用,但剂量过高时,反而有促氧化作用[7]。药物的抗疲劳作用,一般与其抗氧化作用相关。ICA高剂量组小鼠游泳至力竭的时间明显低于低、中剂量组,与对照组无明显差异,可能与高剂量ICA有一定的促氧化作用有关。
3.2 ICA对力竭游泳恢复小鼠血清生化指标的影响
ALT主要存在于肝细胞内,其次是肾脏、心脏和肌肉,血清中此酶活性较低。当肝细胞严重损伤或者坏死时,细胞内的该酶即释放出来进入血液,血清中的ALT活力就会升高,因此,ALT是临床上进行肝功能测试的一个标准。此外,剧烈的力竭运动,可使骨骼肌细胞膜的通透性发生改变,血清ALT活力也升高。正常情况下,AST存在于组织细胞中,其中心肌细胞中含量最高,其次为肝脏,血清中含量极少,一般测定血清中AST活性来诊断心肌梗塞、肝病及一些肌肉疾病[8]。本实验结果显示,ICA中剂量组ALT和AST都极显著低于对照组,说明一定剂量的ICA对力竭恢复小鼠的肝脏、心脏、骨骼肌均有一定的保护作用,能加快力竭运动后机体的恢复。
力竭运动可导致机体自由基和脂质过氧化水平增加,各种氧自由基能攻击生物膜中的多不饱和脂肪酸,引发脂质过氧化作用,MDA是脂质过氧化的终产物,既可反映机体内发生脂质过氧化的程度,也可反映生物膜的受损程度[9]。本实验结果显示,ICA低、中剂量组MDA显著低于对照组,说明ICA低、中剂量组可以消除自由基的攻击,降低力竭恢复状态下MDA生成,保护机体,对延缓运动性疲劳的发生有积极的作用。
BUN是体内蛋白质和氨基酸等物代谢的终产物,在运动时,BUN可以评定运动负荷量的大小,负荷量越大,BUN的增加就越明显。本实验低、中剂量给药组小鼠游泳至力竭的时间比对照组和高剂量给药组长,即运动负荷量相对较大,一般会使BUN的含量显著增加。经24 h恢复,低、中剂量给药组的BUN反而比对照组和高剂量组低,提示低、中剂量ICA可以促进BUN的清除,促进疲劳小鼠的恢复。
正常情况下,SG的来源和去路维持一个动态平衡,使得SG浓度保持相对稳定。而在长时间力竭运动中,若无外界糖源的补充,可能会造成低血糖,产生疲劳。但正常情况下,SG恢复较快。本研究的结果说明经过24 h的恢复后,各组小鼠的血糖浓度基本恢复,水平已趋于一致。
3.3 ICA对力竭游泳恢复小鼠血清LDH同工酶的影响
越来越多的实验证明,LDH同工酶活力与运动性疲劳有关[10]。LDH1、LDH2主要催化乳酸脱氢转变成丙酮酸的反应,而LDH4和LDH5主要催化丙酮酸还原为乳酸的反应。在力竭运动中,机体供氧量不足,储存的糖原分解为血糖后,主要是通过无氧酵解产生乳酸的反应为机体提供能量。本研究结果显示,小鼠力竭游泳恢复24 h后,ICA低、中剂量组LDH总活性和LDH4-5显著低于对照组,提示一定剂量的ICA可以修复受损伤的组织,使释放到血液中的LDH减少,另一种可能的机制是ICA可以减少乳酸的堆积,LDH的活性可能适应性降低。而ICA中剂量组LDH1-2显著高于对照组和其他给药组,说明中剂量ICA可以加快乳酸的清除。由此可推知,中剂量ICA组通过减少乳酸的生成和加快乳酸的清除来缓解运动性疲劳,这与ICA中剂量组显著延长小鼠游泳至力竭的时间相一致。
纵艳芳等采用游泳训练模型,对大鼠力竭后即刻进行实验取样,测定血清中的生化指标以及心肌组织的SOD、MDA和脂褐素的含量。结果表明,淫羊藿苷增加了运动大鼠的乳酸脱氢酶活性,加快血乳酸和尿素氮的清除,显示出了积极的抗运动性疲劳作用,并显著增强了运动大鼠心肌SOD活性,加快MDA的清除,减少了脂褐素在心肌组织中的积累,具有保护细胞的作用及增强机体适应运动负荷的能力。大鼠力竭即刻采样指标和本实验的恢复后小鼠血清指标结果提示,ICA可以抗运动性疲劳和促进运动后疲劳的恢复。
本研究结果表明,ICA通过多方面作用对机体进行保护,缓解运动性疲劳。ICA低、中剂量组都能显著延长小鼠游泳至力竭时间,但综合血清中的生化指标,ICA中剂量组对于推迟疲劳的发生以及促进运动后疲劳的恢复有更好的作用。ICA对人体是否有抗疲劳作用,是否可提高人体的运动能力,值得进一步研究。
1 Cao HX(曹海信),Zhao QQ(赵启权),Li SM(李世明).Study progress in free radical and sport fatigue.Sichuan Sports Sci(四川体育科学),2006,(4):33-35.
2 Bao Y(包宇),Yang JX(杨建雄),Sun RG(孙润广).Icariin rescues the downregulated testosterone and testicle androgen receptor expression in kidney yang deficient mice.Chin J Biochem Mol Biol(中国生物化学与分子生物学报),2011,27:174-179.
3 Bao Y(包宇),Yang JX(杨建雄),Sun RG(孙润广).Antioxidant effects of icariin and icarisideⅡ in vitro.J Jilin Univ(吉林大学学报),2012,38:423-428.
4 Zong YF(纵艳芳),Jiao XC(焦贤春),Shang ML(尚茂林).The experimental study on anti-exercise-induced fatigue of rat of the Icariin.J Jilin Inst Physical Education(吉林体育学院学报),2010,26(2):90-92.
5 Thomas DP,Marshall KI.Effect of repeated exhaustive exercise on myocardial subcellular membrane structure.Int J Sports Med,1988,9:257-260.
6 Hou GX(侯改霞),Yang JX(杨建雄).Effects of extract from Forsythia suspensa leaves tea on antioxidant enzymes and isozymes of LDH in cardiac muscle of mice at exhaustion and recovery.Chin J Sport Med(中国运动医学杂志),2006,25:90-92.
7 Gong JY(龚金炎),Hong H(洪辉),Wu XQ(吴晓琴),et al.Advances in study on prooxidation and cytotoxicity of flavonoids.Chin Tradit Herb Drugs(中草药),2008,39:1905-1909.
8 Peng L(彭莉),Wang QR(王启荣),Bi QY(毕秋芸).The effects of soy active peptide supplement on serum LDH、ALT、AST Level in rats after incremental exercise.J Beijing Sport Univ(北京体育大学学报),2008,31:199-201.
9 Flohr L,Fuzinatto CF,Melegari SP,et al.Effects of exposure to soluble fraction of industrial solid waste on lipid peroxidation and DNA methylation in erythrocytes of Oreochromis niloticus,as assessed by quantification of MDA and m5dC rates.Ecotoxicol Environ Saf,2012,76:63-70.
10 Zhou JL(周君来),Wang J(王健).Impacts of FDP on enzymes and free radical metabolism of both myocardium and serum in exercise-induced fatigue rats.J Beijing Sport Univ(北京体育大学学报),2005,28:1082-1085.

