不同提取方法对软枣猕猴桃多糖单糖组成及抗氧化活性的影响
宣 丽,刘长江
沈阳农业大学食品学院,沈阳 110866
软枣猕猴桃[Actinidia arguta(Sieb.et Zucc.)Planch.ex Miq.]别名软枣子、猕猴梨、藤梨,是猕猴桃科、猕猴桃属多年生落叶藤本植物。在我国分布于东北、华北、山东、西北及长江流域,其中,东北南部山区较多见[1]。软枣猕猴桃以其耐寒性而著称,果实很小,如枣般大,表皮光滑无毛,可直接食用,甜酸比适中,风味极佳[2]。它富含多种营养成分,如高VC含量(200~400 mg/100 g)、高活性的蛋白酶、种类齐全的微量元素[3]、丰富的不饱和脂肪酸含量[4]等。其果实、种子及根茎均可入药[5],是理想的绿色食品和食疗食品。多糖是软枣猕猴桃中主要成分之一,对其进行深入研究对于软枣猕猴桃的开发利用有重要意义。本文以软枣猕猴桃鲜果为原料,采用高温、低温和微波三种不同方法提取多糖,然后对其单糖组成及抗氧化活性进行研究,以期为软枣猕猴桃多糖的构效分析提供一定的试验依据和理论基础。
1 材料与仪器
软枣猕猴桃鲜果,采自辽宁省抚顺山区;1-苯基-3-甲基-5-吡唑啉酮(PMP)、1,1-二苯基-2-三硝基苯肼(DPPH)购自Sigma公司;单糖标准品:鼠李糖(Rha)、阿拉伯糖(Ara)、甘露糖(Man)、葡萄糖(Glc)、半乳糖(Gal)、葡萄糖醛酸(GlcA)及半乳糖醛酸(GalA)购自国药集团化学试剂有限公司;乙腈、甲醇为色谱纯;其余试剂为国产分析纯。
U-2910型紫外可见分光光度计(日立先端科技股份有限公司);Heto-LL3000冻干机(赛默飞世尔科技公司);TSQ-280摇床(上海精宏仪器有限公司);HC23B-AV型微波炉(上海新仪微波化学科技有限公司);HH-4数显恒温水浴锅(金坛市杰瑞尔电器有限公司);5805型高速冷冻离心机(德国艾本德公司);RE-52AA旋转蒸发器(上海亚荣生化仪器厂);Waters高效液相色谱仪(美国Waters公司);C18色谱柱(赛默飞世尔科技公司)。
2 实验方法
2.1 软枣猕猴桃多糖的制备
准确称取300 g软枣猕猴桃鲜果,洗净破碎后,采用确定的乙醇除杂工艺:乙醇浓度80%,浸泡时间60 min,料液比 1∶2(g∶mL),去除软枣猕猴桃果中大量的色素类杂质及还原糖,抽滤,弃去上清液,沉淀部分称重后平均分成3份,一份采用高温水提工艺:水浴温度100℃、料液比1∶9(g∶mL)、水浴时间2 h;一份采用低温水提工艺:摇床温度40℃、料液比 1∶9(g∶mL)、振摇时间 2 h、转速 180 rpm;一份采用微波辅助提取工艺:料液比1∶9(g∶mL)、微波功率500 W、微波处理时间10 min,提取结束后,离心获得的上清液分别进行减压浓缩,然后用4倍体积的无水乙醇沉淀,4℃冷藏过夜,沉淀离心后依次用石油醚、丙酮、无水乙醇浸泡洗涤,抽滤后冷冻干燥,分别得高温提取的软枣猕猴桃多糖AAP-1、低温提取的软枣猕猴桃多糖AAP-2、微波提取的软枣猕猴桃多糖AAP-3,根据公式:多糖得率/%=多糖质量/鲜果质量×100,分别计算三种方法提取的软枣猕猴桃多糖的得率。
2.2 不同方法提取的软枣猕猴桃多糖理化性质的比较
精确称取 AAP-1、AAP-2、AAP-3 各 0.5 g,用 80 mL蒸馏水复溶,溶液用布氏漏斗抽滤,滤液转移至100 mL容量瓶中,加水稀释至刻度,摇匀后得质量浓度为5 mg/mL的多糖溶液。通过碘-碘化钾试剂检测软枣猕猴桃多糖中是否含有淀粉;三氯化铁试剂检测是否含有酚羟基;斐林试剂检测是否含有还原糖;咔唑-硫酸试剂检测是否含有糖醛酸;紫外吸收280 nm检测是否含有蛋白质[6]。
2.3 不同方法提取的软枣猕猴桃多糖的单糖组成分析
2.3.1 软枣猕猴桃多糖水解
精确称取不同方法提取的软枣猕猴桃多糖样品40 mg于具塞试管中,分别加入2 mol/L的H2SO4溶液4 mL,于100℃水浴锅中水解2 h,冷却至室温,反应混合物3000 rpm离心5 min,取上清液2 mL用6 mol/L的NaOH溶液中和到pH约为7,溶液用于PMP衍生化。
2.3.2 单糖衍生物的制备[7]
精密吸取浓度为4 mmol/L的单糖对照品、单糖混合液及软枣猕猴桃多糖水解液各250 μL,于具塞试管中,依次加入0.5 mol/L PMP甲醇溶液250 μL和0.3 mol/L 的氢氧化钠溶液 250 μL,混匀,置于70℃水浴反应30 min,取出,冷却至室温,加入0.3 mol/L的盐酸250 μL进行中和,加入1 mL氯仿萃取,充分震荡后,小心用注射器吸弃下层有机相,重复3次,上层为水相,加入去离子水400 μL稀释混匀,然后经 0.45 μm 微孔滤膜滤过,20 μL 进样分析。
2.3.3 HPLC 分析方法
采用Waters色谱系统。检测波长为250 nm;柱温为室温;流速1.0 mL/min;流动相:溶剂 A:0.05 mol/L磷酸缓冲液(KH2PO4-NaOH,pH6.9);溶剂B:乙腈;梯度洗脱模式:0→5→10→15 min对应:17%→20%→23%→26%(B);进样体积20 μL。
2.4 不同方法提取的软枣猕猴桃多糖体外抗氧化活性的测定
2.4.1 总还原力的测定
实验方法参考文献[8]。精确量取 0.0、0.1、0.2、0.4、0.6、0.8 mL 软枣猕猴桃多糖溶液(5 mg/mL)于6支具塞试管中,再分别加入蒸馏水至总体积为1 mL,摇匀后依次加入 2.5 mL 0.2 mol/L pH值6.6磷酸缓冲溶液和2.5 mL 1%铁氰化钾溶液,于50℃水浴中保温20 min后快速冷却,再加入2.5 mL 10%三氯醋酸溶液,以4000 rpm离心10 min,取上清液加入0.5 mL 0.1%的三氯化铁溶液,振荡摇匀,静置10 min后在700 nm处测其吸光值,以空白管调零点,比较不同样品的总还原力。
2.4.2 DPPH自由基清除能力的测定
实验方法参考文献[8]。精确量取 0.0、0.1、0.2、0.4、0.6、0.8 mL 软枣猕猴桃多糖溶液(5 mg/mL)于6支具塞试管中,再分别加入蒸馏水至总体积为1 mL,摇匀后分别加入0.2 mmol/L的DPPH乙醇溶液3 mL,混匀后置暗处,室温反应30 min后,以蒸馏水调零点,在517 nm处测定空白管的吸光值Ac、样品管的吸光值As,Vc为阳性对照。半抑制浓度IC50,根据浓度-清除率二维曲线上读取的清除率为50%时对应的浓度值计算,按公式:清除率/%=(Ac-As)/Ac×100,计算DPPH自由基的清除率。
2.4.3 羟基自由基(·OH)清除能力的测定
实验方法参考文献[8]。精确量取 0.0、0.2、0.4、0.6、0.8、1.0 mL 软枣猕猴桃多糖溶液(5 mg/mL)于6支具塞试管中,再分别加入蒸馏水至总体积为1 mL,摇匀后分别加入10 mmol/L的FeSO41 mL,10 mmol/L 水杨酸-乙醇溶液1mL,最后加入8.8 mmol/L的H2O21 mL启动反应,37℃反应30 min,在510 nm下测定空白管的吸光值Ac、样品管的吸光值As,Vc为阳性对照。半抑制浓度IC50,根据浓度-清除率二维曲线上读取的清除率为50%时对应的浓度值计算,按公式:清除率/%=(Ac-As)/Ac×100,计算羟基自由基的清除率。
2.4.4 超氧阴离子自由基(O2-·)清除能力的测定
实验方法参考文献[8]。精确量取 0.0、0.2、0.4、0.6、0.8、1.0 mL 软枣猕猴桃多糖溶液(5 mg/mL)于6支具塞试管中,再分别加入蒸馏水至总体积为1 mL,摇匀后分别加入4.5 mL 50 mmol/L pH=8.2的Tris-HC1缓冲液,混匀,于25℃恒温水浴中保温20 min,取出后立即加入25 mmol/L邻苯三酚溶液0.3 mL,迅速摇匀后于25℃恒温水浴中反应5 min,加入8 mmol/L HCl 1 mL,终止反应,于320 nm处测定空白管的吸光值Ac、样品管的吸光值As,Vc为阳性对照,按公式:清除率/%=(Ac-As)/Ac×100,计算超氧阴离子自由基的清除率。
3 结果与讨论
3.1 不同方法提取的软枣猕猴桃多糖的得率及理化性质的比较
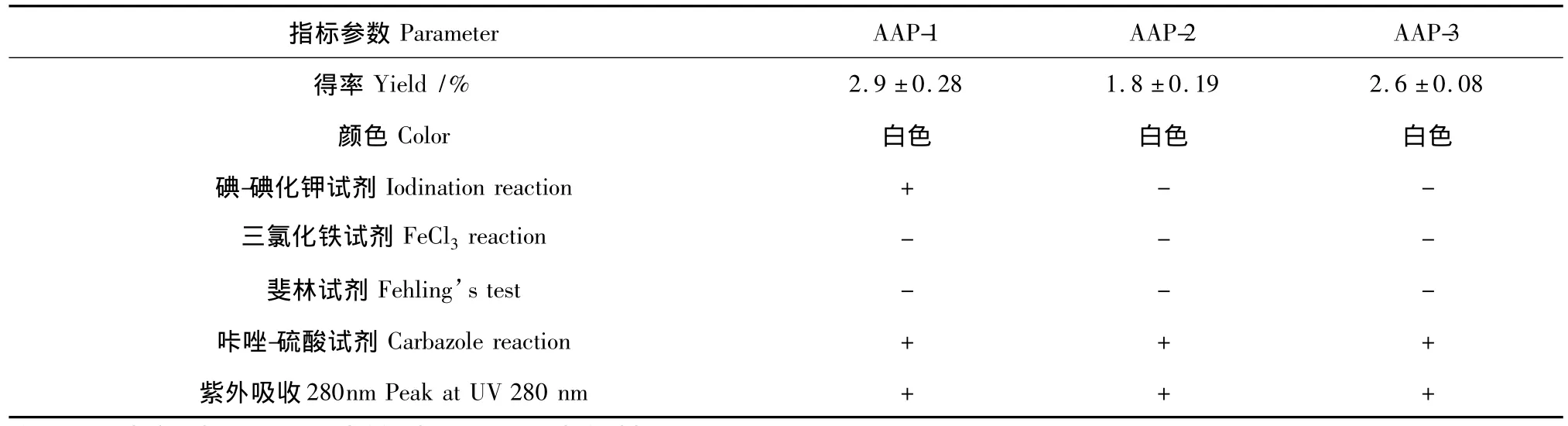
表1 AAP-1、AAP-2及AAP-3的得率及理化性质比较Table 1 Yield,physical and chemical characteristics of AAP-1,AAP-2 and AAP-3
由表1可知,三种方法提取的软枣猕猴桃多糖均为白色,表明其中的色素类杂质在乙醇除杂、乙醇沉淀、不同极性溶剂的洗涤过程中已全部除去;三种多糖中均未检测到酚羟基和还原糖,但都含有一定数量的糖醛酸和蛋白质。AAP-1的得率最高,但其中检测到淀粉;AAP-2得率最低,其中未检测到淀粉;AAP-3的得率略低于AAP-1,但该法的提取时间为10 min,远低于高温提取的2 h,并且其中未检测到淀粉。综上所述,低温处理不利于软枣猕猴桃中多糖的溶出,该法得率最低;高温长时处理可以使软枣猕猴桃中的淀粉溶出;微波辅助提取法可以使软枣猕猴桃多糖在短时间内大量溶出,而且其中不含淀粉,提取效率最高。
3.2 不同方法提取的软枣猕猴桃多糖的单糖组成
图1分别给出了混标、AAP-1、AAP-2及AAP-3的PMP衍生物的高效液相色谱图。各峰的出峰时间和所代表的化合物如表2所示。

图1 混标、AAP-1、AAP-2、AAP-3水解衍生物的色谱图Fig.1 HPLC chromatogram of the PMP derivatives of monosaccharide standard,AAP-1,AAP-2 and AAP-3
由图1、表2可知,通过硫酸水解、PMP柱前衍生测定软枣猕猴桃多糖的单糖组成,结果表明不同方法提取的软枣猕猴桃多糖均由甘露糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖7种单糖组成,但各单糖的含量有显著差异,其中差异最为显著的是葡萄糖和半乳糖醛酸,用面积归一法计算[9],各单糖的摩尔百分含量如表3所示。

表2 标准单糖及AAP-1、AAP-2、AAP-3水解衍生物的保留时间(min)Table 2 Retention time of standard monosaccharide and AAP-1,AAP-2,AAP-3 hydrolysate derivatives(min)
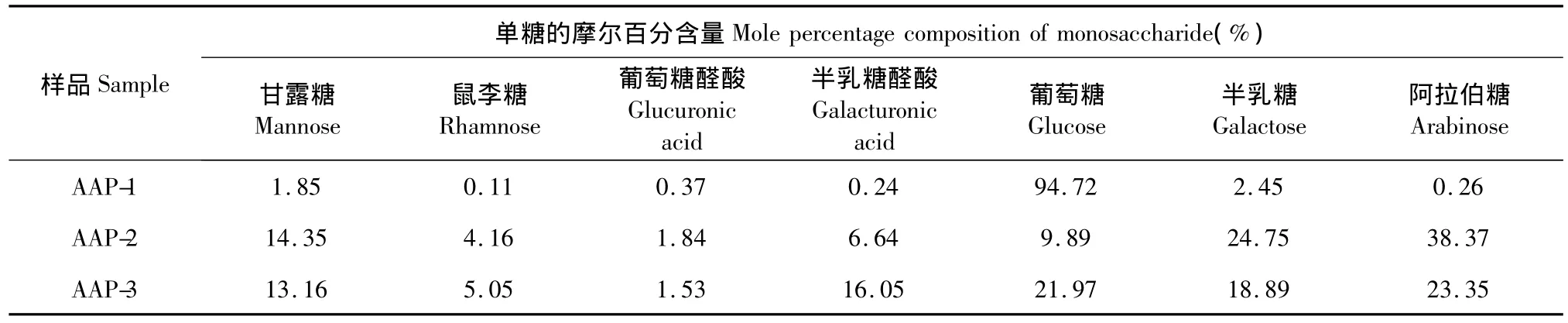
表3 AAP-1、AAP-2、AAP-3单糖组成的差异Table 3 The difference of monosaccharide composition ratio of AAP-1,AAP-2 and AAP-3
由表3可知,AAP-1、AAP-2、AAP-3三种多糖中葡萄糖的摩尔百分含量差异显著,半乳糖醛酸的摩尔百分含量依次升高。AAP-1葡萄糖的摩尔百分含量最高,可达到94.72%,这可能是AAP-1中含有淀粉的缘故;AAP-2葡萄糖的摩尔百分含量显著降低,仅为9.89%,半乳糖和阿拉伯糖的摩尔百分含量显著升高,半乳糖醛酸和甘露糖的摩尔百分含量也有所上升,表明AAP-2中含有果胶多糖;AAP-3葡萄糖的摩尔百分含量较AAP-2有所上升,但远低于AAP-1,为21.97%,半乳糖醛酸的摩尔百分含量继续升高,达到16.05%,阿拉伯糖的摩尔百分含量较AAP-2下降明显,其余四种单糖的摩尔百分含量与AAP-2相差不大,表明AAP-3中含有大量的果胶多糖。
3.3 不同方法提取的软枣猕猴桃多糖抗氧化活性的测定
3.3.1 总还原力的测定

图2 AAP-1、AAP-2、AAP-3 的总还原力Fig.2 Reducing power of AAP-1,AAP-2 and AAP-3
据报道,抗氧化活性与总还原力之间存在极大的相关关系[8]。由图 2 可以看出,AAP-1、AAP-2、AAP-3均具有一定的还原力,并且呈现出明显的剂量依赖性关系。其中AAP-3的总还原力最强,AAP-2次之,AAP-1的总还原力最弱。
3.3.2 DPPH自由基清除能力的测定

图3 AAP-1、AAP-2、AAP-3对DPPH自由基清除能力的测定Fig.3 DPPH·-scavenging rate of AAP-1,AAP-2 and AAP-3
由图3可知,AAP-1、AAP-2、AAP-3都对 DPPH·有一定的清除作用,而且在0.5~4mg/mL浓度范围内随着浓度的升高清除率逐渐增大,呈现量-效关系。经计算,AAP-1、AAP-2、AAP-3的 IC50分别为:3.7、3.2、1.2 mg/mL,表明 AAP-3 清除 DPPH·的效果明显高于 AAP-1和 AAP-2,当 AAP-3浓度为4 mg/mL时,对DPPH·的清除率可以达到94%,但Vc的IC50仅为0.03 mg/mL,AAP-3与其相比还有很大差距。
3.3.3 羟基自由基(·OH)清除能力的测定
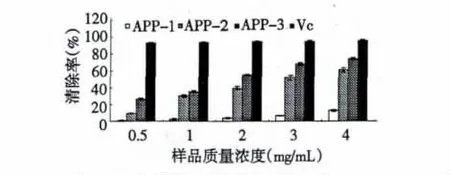
图4 AAP-1、AAP-2、AAP-3对羟基自由基清除能力的测定Fig.4 ·OH scavenging rate of AAP-1,AAP-2 and AAP-3
由图4可知,随着软枣猕猴桃多糖浓度的升高,其对羟基自由基的清除率逐渐增大,呈现量-效关系。但AAP-1清除羟基自由基的能力明显弱于AAP-2和AAP-3,当 AAP-1浓度为5 mg/mL时,对羟基自由基的清除率仅为12.8%。AAP-2、AAP-3的 IC50分别为:3.8、2.7 mg/mL,表明 AAP-3 的清除效果优于 AAP-2,Vc的 IC50为0.2 mg/mL,AAP-3 与其相比也存在较大差距。
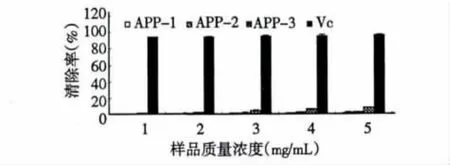
图5 AAP-1、AAP-2、AAP-3对超氧阴离子自由基清除能力的测定Fig.5 O2-·scavenging rate of AAP-1,AAP-2 and AAP-3
由图5可知,软枣猕猴桃多糖对超氧阴离子自由基的清除能力很弱,AAP-3的清除能力相对较强,但当多糖浓度达到5 mg/mL时,清除率也只有8.2%。
综上所述,软枣猕猴桃多糖具有较强清除DPPH自由基和羟基自由基的能力,但清除超氧阴离子自由基的能力很弱。结合理化性质和单糖组成的实验结果可以发现:三种多糖的最大差别在于糖醛酸的含量,并且推测这一差别可能直接导致三种多糖在抗氧化活性方面的差异,因为有研究表明糖醛酸的含量对果胶多糖的功能特性起着决定性的作用[10],因此后续实验需对微波辅助提取的软枣猕猴桃多糖进行深入研究,以确定其活性组分及相关结构特征。
4 结论
采用高温水提工艺、低温水提工艺和微波辅助提取工艺得到的三种软枣猕猴桃多糖均为白色,都不含酚羟基和还原糖,但都含有一定数量的糖醛酸和蛋白质。AAP-1含有淀粉;AAP-2、AAP-3不含淀粉;三种多糖均由甘露糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖7种单糖组成,AAP-1因含有淀粉,葡萄糖的摩尔百分含量最高,AAP-2和AAP-3为果胶多糖,含有较多的甘露糖、半乳糖醛酸、半乳糖和阿拉伯糖;AAP-3的抗氧化活性最强,AAP-2次之,AAP-1最弱。本文对软枣猕猴桃多糖的单糖组成分析及抗氧化活性测定为软枣猕猴桃在食品、医药和保健方面的开发应用提供可靠的科学依据。
1 Sun NN(孙宁宁).Component analyzes and refreshing study on Actinidia arguta in Changbaishan.Jilin:Jilin Agricultural University(吉林农业大学),MSc.2007.
2 Kim JG,Takami Y,Mizugami T,et al.CPPU application on size and quality of hardy kiwifruit.Sci Hortic,2006,110:219-222.
3 Kim JG,Beppu K,Kataoka I.Varietal differences in phenolic content and astringency in skin and flesh of hardy kiwifruit resources in Japan.Sci Hortic,2009,120:551-554.
4 Jiang AL(姜爱丽),Shen X(申新),Hu WZ(胡文忠),et al.Supercritical CO2fluid extraction and fatty acid composition analysis of kiwi seed oil.China Oils Fats(中国油脂),2008,33(9):77-79.
5 Xu YX(徐一新),Xiang ZB(项昭保),Chen HS(陈海生).The research progress of chemical composition and biological activity of actinidia plants.Pharm J Chin PLA(解放军药学学报),2011,27:164-169.
6 Wu WL,Zhu YT,Zhang L,et al.Extraction,preliminary structural characterization,and antioxidant activities of polysaccharidesfrom Salvia miltiorrhiza Bunge.Carbohydr Polym,2012,87:1348-1353.
7 Yang XB(杨兴斌),Zhao Y(赵燕),Zhou SY(周四元),et al..Analysis of monosaccharide composition in Angelica polysaccharides by precolumn derivatization high performance liquid chromatography.Chin J Anal Chem(分析化学),2005,33:1287-1290.
8 Wang F(王菲).Extraction and purification and biological activities of flavonoids from fruit of Actinidia auguta.Shenyang:Shenyang Agricultural University(沈阳农业大学),PhD.2011.
9 Wang ZF(汪正范).Chromatography Qualitative and Quantitative(色谱定性与定量).Beijing:Chemical Industry Publishing House,2000:163-169.
10 Sun YL(孙元琳).Preparation,structural features and radioprotective effect of polysaccharides from Angelica sinensis(Oliv.)Diels.Wuxi:Jiangnan University(江 南 大 学),PhD.2006.

