他罗利姆对癫痫大鼠海马氧化应激、凋亡诱导因子及神经元凋亡的影响
刘金之 薛 萍 张 涛 李晓林 杨倩倩 林 艳 王爱华
(山东大学附属千佛山医院保健神经内科,山东 济南 250014)
癫痫发作能引起明显的神经元损伤,其机制与癫痫后大量自由基形成及激活细胞死亡相关的蛋白酶有关〔1〕。凋亡诱导因子(AIF)是线粒体中的一个重要蛋白,可介导非天冬氨酸特异性半胱氨酸蛋白酶依赖性的细胞程序性死亡。最近有报道〔2〕,免疫抑制剂他罗利姆(FK506)在脑损伤和脑缺血模型中具有神经保护作用,同时可抑制癫痫发作,提高大鼠生存率,但其作用机制尚待进一步研究。本研究采用氯化锂-匹鲁卡品制作癫痫大鼠模型,观察癫痫发作后海马组织中线粒体及AIF水平的变化,以及FK506对其的影响,进一步阐明FK506抗癫痫及脑保护作用的机制。
1 材料与方法
1.1 材料 健康雄性Wistar大鼠126只,体重250~280 g,由山东大学医学院动物中心提供;氯化锂、匹鲁卡品均购自Sigma公司;一氧化氮(NO)定量、一氧化氮合酶(NOS)活性、丙二醛(MDA)定量检测试剂盒均购自南京建成生物工程研究所;罗丹明123购自碧云天公司生物技术研究所;AIF单克隆抗体购自Cell Signal Technology公司;COX-Ⅳ多克隆抗体购自Biovision公司;组蛋白Histone单克隆抗体购自Santa Cruz公司;神经元型一氧化氮合酶(nNOS)抗体、诱导型一氧化氮合酶(iNOS)抗体均购自Chemicon公司。
1.2 方法
1.2.1 动物分组 ①随机将健康雄性Wistar大鼠126只分为癫痫组(A组)、Fk506干预组(B组)、对照组(C组)各42只。A组与B组大鼠分别取6只于癫痫持续状态(SE)后6 h进行心脏灌注,免疫组化检测;6只SE后24 h分离新鲜海马组织,行线粒体相关测定;6只SE后7 d进行心脏灌注,免疫组化及尼氏染色。其余24只分为4组,分别于SE后2 h、6 h、24 h、7 d处死,分离新鲜海马组织,-80℃保存。C组大鼠不建立癫痫模型,分别于对应时间点处死,标本处理同A、B组。②24只Wistar大鼠随机分为癫痫组、FK506干预组、生理盐水干预组、对照组,每组6只,FK506干预组在注射匹鲁卡品之前24、1 h 2次腹腔注射FK506,生理盐水干预组注射等体积生理盐水;于癫痫发作24 h后处死,Western印迹检测大鼠海马线粒体和细胞核AIF的水平。
1.2.2 模型制作 A组和B组给予氯化锂3 mol·L-1·kg-1腹腔注射,18~20 h后给予新配置的匹鲁卡品30 mg/kg腹腔注射。B组于注射匹鲁卡品之前24 h、1 h共2次给予FK506腹腔注射0.5 mg/kg。大鼠癫痫发作症状采用Racine(1972)分级标准。0级:无任何反应;Ⅰ级:面部阵挛:包括眨眼,动须,节奏性咀嚼等;Ⅱ级:Ⅰ级加节律性点头;Ⅲ级:Ⅱ级加前肢肌阵挛,但无后肢直立位;Ⅳ级:Ⅲ级加后肢直立位;Ⅴ级:全面性强直-阵挛发作,并失去体位控制。出现急性SE 1 h后,给予水合氯醛200 mg/kg腹腔注射解除抽搐以降低死亡率,出现RacineⅣ级以上症状并存活者进入实验组。
1.2.3 NO、MDA含量、NOS活性检测 各组大鼠分别于2 h、6 h、24 h、7 d处死。将大鼠快速断头,取出脑组织,冷生理盐水冲洗。根据大鼠立体定位图谱,取双侧海马,称重后,以冷生理盐水做匀浆介质,研磨成10%组织匀浆,2 000 r/min,离心10 min,取上清液-80℃保存待测。NO、NOS、MDA检测严格按照试剂盒说明书进行。
1.2.4 线粒体膜检测 MMP及线粒体大小的检测采用新鲜海马组织,用线粒体提取试剂盒提取线粒体,再用浓度为10 μmol/L的罗丹明123染液0.5 ml,室温染色30 min。300目尼龙网过滤,上流式细胞仪,用Cell Quest软件分析。
1.2.5 免疫组化检测 各组大鼠于造模成功后6 h、7 d行灌注取材,大鼠水合氯醛350 mg/kg麻醉后,剪开胸腹腔,暴露心脏和肝脏,灌注针通过左心室心尖部穿刺至主动脉口,切开右心耳,快速灌注肝素化生理盐水200 ml后,继续4%多聚甲醛200 ml灌注,至大鼠四肢强直,肝脏变白后停止灌注,拔出穿刺针。开颅取全脑,放入4%多聚甲醛后固定12 h,移入20%、30%蔗糖分别过夜。冰冻冠切已沉糖的脑组织,层厚10 μm。用ABC法进行免疫组化染色。用PBS取代一抗做阴性对照。
1.2.6 海马AIF水平检测 Western印迹法检测海马AIF的变化:各实验组大鼠快速断头取脑,分离海马,加入细胞裂解液,冰上孵育,离心后弃上清液;沉淀中加入细胞核裂解液或线粒体分离介质,冰上孵育后离心,上清液为核蛋白提取液,沉淀物为线粒体蛋白,加入蛋白上样液,沸水煮后备用。40 g蛋白质样品在恒压下行聚丙烯酰胺凝胶电泳;置于转模槽中恒流电转2 h;将硝酸纤维素膜放入溶于脱脂牛奶中,室温振荡1~2 h;洗涤后,将硝酸纤维素膜放入稀释后的一抗溶液中4℃过夜;洗涤后,将硝酸纤维素膜放入合理稀释后的二抗溶液中室温振荡1 h;洗涤后,将化学发光液试剂均匀涂于硝酸纤维素膜,曝光、显影、定影,应用数字凝胶成像系统拍照;计算目的条带与内参条带的灰度值比值,表示相对含量。
1.2.7 形态学观察 各组大鼠于造模成功后7 d行灌注取材,尼氏染色观察海马神经元形态变化。
1.3 图像与统计学处理 图像采用HPIAS-1000高清晰彩色病理图像分析系统对切片进行图像分析。所有切片分析在同一强度,同一放大倍数下进行。每只大鼠随机取相同部位的4张切片,分别对阳性细胞进行测定。采用SPSS13.0统计软件进行分析,计量数据以±s表示,采用χ2检验及方差分析。
2 结果
2.1 各组大鼠行为学观察 A、B两组大鼠在注射匹鲁卡品后均出现SE,但是潜伏期和发作强度有所不同。B组大鼠的潜伏期延长(P<0.01),且发作强度级别降低(P<0.05)。见表1。
表1 大鼠癫痫发作至Ⅳ级潜伏期及发作程度分级(±s)

表1 大鼠癫痫发作至Ⅳ级潜伏期及发作程度分级(±s)
与A组比较:1)P<0.05,2)P<0.01
组别 n 癫痫发作至Ⅳ级潜伏期(s)Ⅴ级发作百分比A组Ⅳ级发作百分比42 46.4±9.1 47.62% 52.38%B组 42 69.3±9.72) 78.57%1) 21.43%1)
2.2 海马NO含量与NOS活性测定结果 A组大鼠在SE后海马组织中NO的含量升高,6 h出现第1个高峰,在7 d时再次升高。结构型一氧化氮合酶(cNOS)的活性同样在SE后升高,6 h达高峰,但随后下降。而诱导型一氧化氮合酶(iNOS)的活性则是缓慢升高,在7 d时达到高峰。比较A、B、C各组6 h时NO、cNOS活性和7 d时NO、iNOS活性的不同,同一时间点的差异有统计学意义(P<0.01)。见表1,表2。
2.3 海马MDA含量测定结果 SE后A组大鼠海马组织中MDA的含量升高,一直持续到SE后7 d。与A组相比,7 d时B组大鼠MDA的含量明显降低(P<0.01)。见表1,表2。
2.4 线粒体相关检测
2.4.1 MMP检测 MMP为早期反映细胞凋亡的一个指标,MMP降低,凋亡相关因子释放,引起凋亡的发生。用相对荧光强度来反映MMP的状态,与A组相比(128.87±6.43),B组大鼠神经元细胞MMP明显升高(163.35±4.86,P<0.05)。C组最高(75.64±8.7)。
2.4.2 线粒体大小 凋亡发生时,线粒体膜通透性转运孔(MPTP)开放使介质进入线粒体,导致线粒体膨胀,线粒体肿大。流式细胞仪可以通过检测线粒体前向光散射(FSC)增大,来反映MPTP的开放。与C组(98±4.57)和B组(139±3.82)比较,A组神经元细胞线粒体肿大(116±4.34,P<0.05)。
2.5 免疫组化检测结果 nNOS、iNOS表达阳性细胞胞质及突起呈棕色或棕褐色着色。正常大鼠海马区可见少量的nNOS、iNOS表达,SE后6 h时A组大鼠海马nNOS阳性细胞数较C组明显增多(P<0.05),B组nNOS阳性细胞数较A组明显降低(P<0.05);SE后7 d时A组大鼠海马iNOS阳性细胞数较C组明显增多(P<0.05),而B组较A组明显降低(P<0.05)。见图1,表1,表2。
2.6 海马AIF水平检测 Western印迹结果提示:与癫痫组比较,FK506干预组大鼠海马组织线粒体AIF水平显著增高,而细胞核AIF水平显著降低,差异均有统计学意义(均 P<0.05)。见图2,表3。
表1 不同时间点NO、cNOS、iNOS、MDA含量的变化(±s,n=6)

表1 不同时间点NO、cNOS、iNOS、MDA含量的变化(±s,n=6)
与C组比较:1)P<0.05,2)P<0.01
组别 NO(μmol/gprot) cNOS活性(U/mgprot) iNOS活性(U/mgprot) MDA含量(nmol/gprot)C组 0.24±0.022 1.12±0.079 0.26±0.081 2.36±0.211 A组2 h 0.45±0.0261) 1.92±0.0631) 0.29±0.063 3.18±0.098 A组6 h 0.52±0.0162) 2.85±0.0662) 0.30±0.061 3.29±0.1331)A组24 h 0.31±0.0251) 1.89±0.1021) 0.66±0.0891) 5.57±0.2581)A组7 d 0.52±0.0212) 1.51±0.1391) 1.40±0.1402) 9.33±0.6002)
表2 各组不同时间点NO、iNOS活性、MDA含量变化(±s,n=6)

表2 各组不同时间点NO、iNOS活性、MDA含量变化(±s,n=6)
与C组比较:1)P<0.01,2)P<0.05;与A组比较:3)P<0.05
组别 6 h NO(μmol/gprot) 7 d NO(μmol/gprot) 7 d iNOS(U/mgprot) 6 h cNOS(U/mgprot) MDA 含量(nmol/gprot)2.25±0.211 A组 0.52±0.0261) 0.53±0.0241) 1.40±0.1401) 2.85±0.0661) 9.33±0.6001)B组 0.41±0.0162)3) 0.35±0.022 1.13±0.1042)3) 2.25±0.0772)3) 5.65±0.2912)3)C组 0.23±0.022 0.23±0.011 0.26±0.080 1.12±0.079
表3 SE后24 h各组大鼠细胞核及线粒体AIF的表达(±s,n=6)

表3 SE后24 h各组大鼠细胞核及线粒体AIF的表达(±s,n=6)
与对照组比较:1)P<0.05;与FK506干预组比较:2)P<0.05
组别 细胞核 线粒体对照组3.87±0.68 1.24±0.24 1.21±0.66 1.52±0.21癫痫组 5.93±0.831)2) 0.77±0.231)2)生理盐水干预组 6.12±0.791)2) 0.73±0.191)2)FK506干预组
2.7 海马形态学观察 对照组海马形态学结构正常,有大量致密锥体细胞,排列规则,胞核完整,胞质里可见深染的尼氏小体;癫痫组海马可见神经元缺失、变性、坏死,尼氏小体数量较少,甚至出现尼氏小体的溶解、消失,存活神经元数目显著少于对照组和FK506干预组;FK506干预组海马存活神经元数量较癫痫组明显增加。见图3。
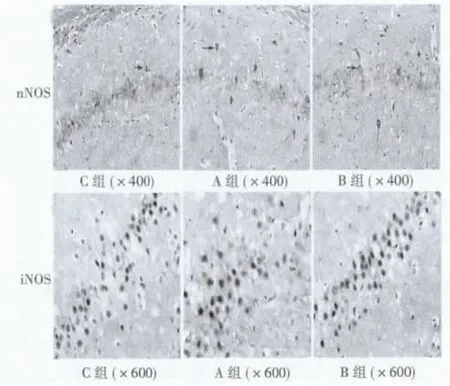
图1 免疫组化示癫痫持续状态后nNOS和iNOS的表达

图2 SE后24 h各组大鼠细胞核及线粒体AIF的表达

图3 SE后7 d海马CA3区神经元变化(尼氏染色,×400)
3 讨论
癫痫发作可导致NO大量释放,引起氧化应激反应,在癫痫发作和癫痫诱导的细胞损伤中发挥重要作用〔3~5〕。NOS包括nNOS,内皮型(eNOS)和iNOS,前两种合称为结构型 NOS,即cNOS,由于无法直接检测nNOS的活性,国外实验〔6〕通过免疫印迹法证实癫痫时nNOS是cNOS活性增加的主要因素,因此本研究通过检测cNOS的活性来间接反映nNOS的活性。MDA为脂质过氧化物降解的产物,具有很强的生物毒性,对脑组织有直接损害作用〔7〕。本研究结果提示NO早期的升高可能是由于cNOS的活性及表达升高,而nNOS是cNOS活性增加的主要因素,因此早期的升高可能是由于nNOS的活性及表达升高,而晚期则是由iNOS产生大量NO。同时SE后6 h海马组织MDA显著升高,含量随着时间及癫痫的加重而升高,与以往报道一致〔8〕,说明NO的增多可通过脂质过氧化的增强发挥其致痫性和细胞毒性作用。在FK506处理的大鼠,SE后MDA的增加受到抑制,进一步证明FK506可抑制NO诱发的氧化应激反应,抑制脂质过氧化反应,使MDA生成减少。免疫组化证实FK506可使SE后nNOS、iNOS的表达降低,提示FK506可抑制nNOS及iNOS的表达,进而抑制氧化应激反应。
线粒体对维持细胞能量代谢和正常功能起重要作用。大多数细胞发生凋亡时均伴随线粒体功能与结构改变〔9〕,而MMP的改变在细胞凋亡中发挥重要作用〔10〕。由于线粒体膜上各种生物泵的作用,使膜内外维持着不同梯度的离子浓度,进而产生MMP。细胞发生凋亡时首先表现为MMP迅速下降,一旦线粒体跨膜电位(Δψm)耗散,细胞将进入不可逆的死亡过程,而导致线粒体跨膜电位耗散的主要原因是线粒体MPTP通道开放。目前认为线粒体MPTP通道开放是诱发细胞凋亡与坏死的共同通路〔11〕。氧化应激可导致线粒体去极化及MPTP通道开放,引起线粒体内细胞色素C、AIF、Smac等释放,从而启动凋亡蛋白酶依赖及非凋亡蛋白依赖的细胞凋亡途径。因此,PTP开放是凋亡开始的一个关键环节。由于线粒体存在内负外正电位,特异性正电性荧光染料罗丹明123可进入线粒体,且只与线粒体内膜特异性结合。PTP开放时,膜电位消失,荧光强度下降。罗丹明123荧光强度降低,反映线粒体数量减少和功能降低。同时,线粒体膨胀后,其颗粒性状改变。因此,流式细胞仪可通过同时检测线粒体前向光散射(FSC)增大和线粒体90°侧向光散射(SSC)改变反映线粒体PTP的开放。
AIF是第一个被鉴定出可以不依赖于半胱氨酸天冬酶信号通路而直接介导细胞发生凋亡的分子。AIF为一种位于线粒体膜间隙的黄素蛋白,既具有细胞凋亡活性又具有氧化还原酶活性,但二者的作用是解偶联的。细胞受到凋亡刺激后,AIF从线粒体易位到胞质中,再易位到核,在核中与染色体结合,使染色体凝集,并断裂成约50 kb的大片段,从而引起细胞凋亡〔12〕。免疫组化、Western印迹及病理结果进一步证实癫痫组大鼠在SE后AIF从线粒体易位到细胞核,神经元变性坏死,数目减少,排列散乱,FK506可减轻神经元损伤。
1 Chuang YC.Mitochondrial dysfunction and oxidative stress in seizure-induced neuronal cell death〔J〕.Acta Neurol Taiwan,2010;19(1):3-15.
2 Chwiej J,Janeczko K,Marciszko M,et al.Neuroprotective action of FK-506(tacrolimus)after seizures induced with pilocarpine:quantitative and topographic elemental analysis of brain tissue〔J〕.J Biol Inorg Chem,2010;15(2):283-9.
3 Swamy M,Yusof WR,Sirajudeen KN.Decreased glutamine synthetase,increased citrulline-nitric oxide cycle activities,and oxidative stress in different regions of brain in epilepsy rat model〔J〕.J Physiol Biochem,2011;67(1):105-13.
4 Barbiro-Michaely E,Mendelman A,Mayevsky A.The evaluation of nitric oxide involvement in metrazol induced status epilepticus using multiparametric monitoring〔J〕.Brain Res,2011;1377(4):50-9.
5 Shafaroodi H,Baradaran N,Moezi L,et al.Morphine sensitization in the pentylenetetrazole-induced clonic seizure threshold in mice:role of nitric oxide and μ receptors〔J〕.Epilepsy Behav,2011;20(4):602-6.
6 Liu ZW,Zhang T,Yang Z.Involvement of nitric oxide in spatial memory deficits in status epilepticus rats〔J〕.Neurochem Res,2007;32(11):1875-83.
7 Arhan E,Serdaroglu A,Ozturk B,et al.Effects of epilepsy and antiepileptic drugs on nitric oxide,lipid peroxidation and xanthine oxidase system in children with idiopathic epilepsy〔J〕.Seizure,2011;20(2):138-42.
8 Shin EJ,Ko KH,Kim WK,et al.Role of glutathione peroxidase in the ontogeny of hippocampal oxidative stress and kainate seizure sensitivity in the genetically epilepsy-prone rats〔J〕.Neurochem Int,2008;52(6):1134-47.
9 Shawgo ME,Shelton SN,Robertson JD.Caspase-mediated Bak activation and cytochrome c release during intrinsic apoptotic cell death in Jurkat cells〔J〕.J Biol Chem,2008;283(51):35532-8.
10 Ahn HJ,Kim KI,Kim G,et al.Atmospheric-pressure plasma jet induces apoptosis involving mitochondria via generation of free radicals〔J〕.PLoS One,2011;6(11):e28154.
11 Green DR,Kroemer G.The pathophysiology of mitochondrial cell death〔J〕.Science,2004;305(5684):626-9.
12 Favreau DJ,Meessen-Pinard M,Desforges M,et al.Human coronavirusinduced neuronal programmed cell death is cyclophilin d dependent and potentially caspase dispensable〔J〕.J Virol,2012;86(1):81-93.

