青年SD 大鼠营养性肥胖模型的建立
曹翠玲,许之屏,伍 光,马 恋
(湖南师范大学体育学院,体适能与运动康复湖南省重点实验室,湖南 长沙 410012)
肥胖是一种典型的环境因素与遗传因素互相作用而导致能量摄入与消耗失去平衡所造成的慢性疾病,已成为危害人类健康的公共卫生问题。因此,建立适合实验所需的肥胖模型是进行肥胖研究的基础。目前,肥胖症动物模型有营养性肥胖、遗传性肥胖、下丘脑损伤性肥胖、双侧卵巢切除性肥胖、转基因性肥胖[1]。目前,青少年肥胖越来越多,多数人产生的肥胖是由食物所诱导的营养性肥胖,因此建立青年SD 大鼠营养性肥胖模型有重要意义。以往建立SD 大鼠营养性肥胖模型的方法是每天给予大鼠足量的高脂饲料,但是许多学者发现其增肥效果并不显著,甚至模型组大鼠不如吃普通饲料的对照组大鼠长的肥壮。为了解决这一问题,本实验采用改良的高脂饲料配方、迎合SD 大鼠磨牙习性和混合喂养方式来诱导青年SD 大鼠营养性肥胖,以观察致肥效果。
1 材料与方法
1.1 实验动物
实验采用雄性4 周龄SD 大鼠,动物等级SPF,体重70±5g,购自长沙天勤生物技术有限公司(许可证号SCXK 湘2009-0012)。
1.2 动物饲料
SD 大鼠食用的普通饲料和高脂饲料均由湖南斯莱克景达实验动物有限公司提供(许可证号为SCXK 湘2009-0009)。高脂饲料配方为:普通饲料60%、猪油8%、蔗糖5%、全脂奶粉5%、花生8%、鸡蛋10%、食盐2%、胆固醇2%。
1.3 实验仪器和试剂
实验仪器:TGL-16 台式高速离心机(湖南星科科学仪器有限公司)、紫外分光光度计(UV-9200、北京瑞利分析仪器公司)、恒温水浴箱(天津艾维欧科技发展有限公司)。
实验试剂:总胆固醇(TC)试剂盒、甘油三酯(TG)试剂盒、低密度脂蛋白(LDL-C)试剂盒均购自北京北化康泰临床试剂有限公司。
1.4 实验设计
将4 周龄的40 只SD 大鼠放置于室温23±3°C,相对湿度在50%~70%,通风良好的环境。每笼5 只,照明时间12 h。适应性普通饲料喂养3天后,将其随机分为2组。对照组20 只,普通饲料足量喂养;模型组20 只,改良高脂饲料足量喂养,全天自由饮食饮水。二组大鼠经上述喂养8 周(第12 周龄)后,按照空腹条件下模型组体重超过对照组SD 大鼠平均体重20%作为肥胖SD 大鼠造模成功的标准[2],同时参照血脂指标,本实验造模成功率达到83%。
1.5 观察指标
1.5.1 一般情况
每日观察大鼠精神状态、食量、饮水量、活动、毛色光泽及大便情况,并详细记录。
1.5.2 体重、体长、Lee's 指数的测定
每两周测量一次SD 大鼠体重和身长。体重用电子秤称量,体长用直尺测量(从鼻尖至肛门的长度),Lee's 指 数 按 公 式:Lee's=(体 重)1/3×103/体 长(cm)计算。
1.5.3 血脂测定
每两周断尾取血一次。将所取血液用TGL-16台式高速离心机离心,提取血清放入-80℃冰箱保存,用紫外分光光度计检测总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白(LDL-C)。
1.6 统计方法
数据处理分析采用SPSS19.0 统计软件,结果以均值和标准差表示,统计分析采用t 检验,P<0.05有统计学意义。
2 结果
2.1 一般情况
造模期间,观察二组大鼠精神状态、食量、饮水量、活动、毛色光泽及大便情况。造模初期模型组大鼠饮水偏多,大便较软,臭味重。随实验进行,模型组除大便臭味仍重外,余观察指标渐如对照组,但毛色偏黄,光泽度差。
2.2 SD 分组饲养后SD 大鼠平均体重的变化情况
如图1 所示:分组饲养2 周后,模型组大鼠平均体重低于对照组,且有显著性差异(P<0.05);分组饲养4 周后,模型组大鼠平均体重仍低于对照组,但无显著性差异(P>0.05)。显示此时模型组体重增长量已经高于对照组,但平均体重仍然低于对照组;分组饲养6 周后,模型组大鼠平均体重开始高于对照组,但无显著性差异(P>0.05);分组饲养8 周后,模型组大鼠平均体重明显高于对照组,且有显著性差异(P<0.05)。

图1 对照组与模型组大鼠平均体重变化情况模型组与对照组比较,★P<0.05
2.3 分组饲养后SD 大鼠Lee's 指数的变化情况
如图2 所示:分组饲养2 周后,模型组大鼠Lee's 指数低于对照组,但无显著性差异(P>0.05);分组饲养4 周后,模型组大鼠Lee's 指数开始高于对照组,但无显著性差异(P>0.05);分组饲养6 周后,模型组大鼠Lee's 指数明显高于对照组,但无显著性差异(P>0.05);分组饲养8 周后,模型组大鼠Lee's 指数明显高于对照组,且有显著性差异(P<0.05)。

图2 对照组与模型组大鼠Lee's 指数变化情况
2.4 分组饲养后SD 大鼠血脂指标TC、TG、LDLC的变化情况
如表1和图3 所示,分组饲养8 周后模型组大鼠总胆固醇(TC)、甘油三酯(TG)水平明显高于对照组,具有高度显著性差异(P<0.01);低密度脂蛋白(LDL-C) 明显高于对照组,具有显著性差异(P<0.05)。

表1 分组饲养8 周后对照组与模型组TC、TG、LDL-C 值的比较(mmol/L)
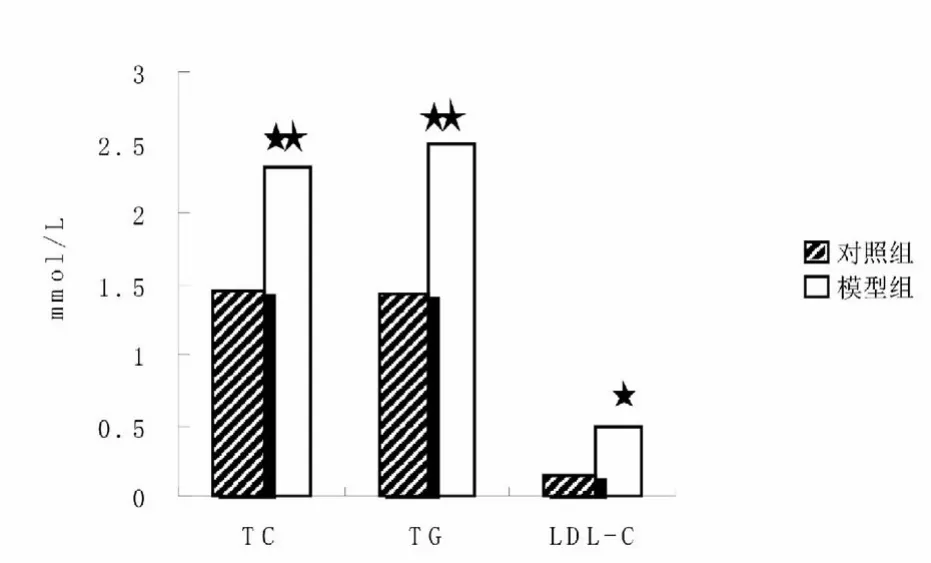
图3 对照组与模型组TC、TG、LDL-C 变化情况
3 讨论
3.1 改良高脂饲料配方对青年SD 大鼠造模的影响
构建营养性肥胖大鼠模型的关键在于高脂饲料的配方,国外多采用Research Diets、Harlan Teklad 等公司的纯化饲料[3],但由于其造价较高未被国内市场广泛接受。目前,国内动物致肥主要以高脂饲料为主。高脂饲料配方中猪油的含量一直是研究者关心的问题,以往有研究者使用15%或12%的猪油配制高脂饲料显示造模成功[4-6]。本实验模型组使用的是含15%猪油的高脂饲料,发现含油量过高、质地较软,大鼠不爱啃食,导致大鼠实际摄食量很少,增肥效果不明显。本实验将猪油比例调整,发现经改良的高脂饲料有利于造模成功。其过程如下:最先使用15%猪油的高脂饲料喂养模型组大鼠,在第2 周与对照组比较模型组大鼠就出现体重偏低生长缓慢的现象,而第3 周这种生长缓慢有进一步扩大的趋势。为了解决这一问题,本实验采用的办法是立刻停止喂食含15%猪油的高脂饲料,将猪油含量减少为10%,试行1 周仍感觉效果不好,最后将猪油含量减至8%。结果发现8%的高脂饲料含油量和硬度适中,模型组大鼠摄食量有明显增加,平均体重在第6 周开始高于对照组。因此,高脂饲料的配方要严格控制猪油比例,以8%为宜。本文发现胆固醇也有增肥的作用,但以2%比例为宜,比例过高影响饲料味道也增加饲料的成本。还有,普通饲料的比例以60%~70%为宜,这样即保证了高脂饲料的硬度,又利于大鼠磨牙。另外建议高脂饲料要放在冰箱内保存,防止变质。
3.2 混合喂养方式对青年SD 大鼠造模的影响
传统的建立SD 大鼠营养性肥胖模型的喂养方式是每天给予大鼠足量的高脂饲料,增肥效果不显著,许多研究者也发现了这一现象。本实验模型组前四周有一大半大鼠平均体重低于对照组。分析产生这一现象的原因,发现与人每天吃大鱼大肉的高脂饮食导致食欲不振是一样的道理。那么间隔喂食高脂饲料能否改善这一现象呢?本实验经过细致观察发现,混合喂养方式有助于建立大鼠营养性肥胖模型。方法是将模型组大鼠高脂饲料由原来的每天给予,改为3天一个循环的喂养方式。即第1天喂以普通饲料,第2、第3天喂以高脂饲料,以此喂养方式循环进行。该喂养方式采用的是普通饲料与高脂饲料混合喂养,避免了大鼠因每天食用富含高油脂、高胆固醇的饲料而引起的食欲减退。本实验SD 大鼠经混合喂养8 周后,模型组大鼠的平均体重、Lee's 指数、血脂指标明显高于对照组大鼠,具有显著性差异,肥胖造模成功率达到83%,显示造模成功。
3.3 掌握SD 大鼠的磨牙习性对青年SD 大鼠造模的影响
SD 大鼠是啮齿目动物,有磨牙的习性。SD 大鼠在幼年时期牙齿长得过快、过长,会影响进食,因此它经常用坚硬的物品磨牙,例如喜欢啃食坚硬的饲料和木头等。本文模型组大鼠前四周体重低于对照组的原因除了与高脂饲料过于油腻外,另外一个原因就是高脂饲料含油量高、质地太软达不到磨牙的效果。大鼠把饲料啃的很碎,实际摄入很少,也造成了高脂饲料大量浪费。相反,对照组大鼠喂食的是普通饲料,由于含油量少比高脂饲料坚硬得多,大鼠喜欢进食,实际摄食量大大多于模型组,对照组大鼠体重偏高也就不奇怪了。另外,本文针对大鼠喜欢磨牙的现象,采取将木筷子放置于模型组鼠笼中,让大鼠在木筷上啃咬,这样既满足了大鼠磨牙的习性,浪费饲料的现象也随之减少。
3.4 合理选择高脂饲料喂养时间对青年SD 大鼠造模的影响
SD 大鼠性成熟时间为生后第6~9 周龄[7]。本实验的造模时间为SD 大鼠出生后第4 周~12 周龄,经历了SD 大鼠的幼年期和青年期。一般来说,从幼年大鼠开始致肥,致肥率较低,时间较长。有研究者采用先从幼年喂普通饲料,到青年期再喂高脂饲料,这样致肥时间短,也节省了高脂饲料。本文认为从幼年期喂高脂饲料致肥大鼠也是可行的,只要采用改良高脂饲料的配方、混合喂养方式和满足大鼠磨牙的习性,青年SD 大鼠的致肥率仍然会很高。本实验的致肥率83%,比较其他营养性肥胖模型成功率更高。本文发现,青年SD 大鼠混合喂养时间不能少于8 周,喂养时间短致肥率会比较低,但也不是延长喂养时间致肥率就会提高,这是因为有一部分SD 大鼠是肥胖抵抗型。
[1]赵玉琼.肥胖大鼠模型[J].实验动物科学,2011,28(6):59-61.
[2]Chandler PC,Viana JB,Oswald KD,et al.Feeding response to melanocortin agonist predicts preference for and obesity from ahighfat diet[J].Physiol Behav,2005,85(2):221-230.
[3]Jackman M R,MacLean PS,Bessesen DH.Energy expenditure in obesity-prone and obesity-resistant rats before and after the introduction of a high-fat diet[J].Am J Physiol Regul Integr Comp Physiol,2010,299 (4):R1097-R1105.
[4]姚荣英,郑玲,李霞,等.营养性幼年肥胖雌性大鼠模型的建立[J].现代预 防医学,2012,39(3):558-559.
[5]田辉,王玉婷,陶莉,等.一种新型小鼠肥胖模型的建立[J].中国药理学通报,2013,29(7):1016-1018.
[6]任亚萍,孙莉,宫晓洁,等.雄性SD 大鼠性成熟期营养性肥胖模型的建立[J].现代医药卫生,2010,26(1) :3-4.
[7]路瑛丽,张漓,冯连世,等.高脂饮食大鼠高住高练模型的建立[J].中国运动医学杂志,2012,31(5):438-442.

