柠檬酸和EDTA对铜污染土壤环境中吊兰生长的影响
汪楠楠,胡 珊,吴 丹,王友保,2,*
(1.安徽师范大学生命科学学院,芜湖 241000;2.安徽师范大学生物环境与生态安全安徽省高校省级重点实验室,芜湖 241000)
随着我国经济建设的腾飞,工矿业的迅速发展,环境污染问题也日益严峻,其中土壤的重金属污染更是令人堪忧。在此背景下,土壤的铜污染已经日益成为人们关注的焦点,而铜污染土壤的修复和治理也作为一个全球性研究课题,吸引着众多的学者和专家。经过近年来的不断探索,污染土壤的植物修复技术由于其成本低、效果显著以及不会造成二次污染等优点,为解决土壤重金属污染问题提供了一条新的绿色途径[1]。
重金属在土壤中一般以多种形态赋存,不同的化学形态对植物的有效性不同。重金属生物有效态是指能被植物所吸收的那部分重金属[2]。植物修复的首要目标应是减少土壤有效态重金属浓度,而不是土壤重金属总量,所以植物修复技术的效率在很大程度上取决于对重金属生物有效态的吸收[3]。
研究表明,螯合剂对土壤中的重金属有一定的活化作用,能够通过扰动污染物在土壤液相浓度和固相浓度之间的平衡,提高重金属的有效态含量。这种施用螯合剂或配位基诱导或强化植物超富集作用被称为螯合诱导修复技术(Chelate-induced phytoremediation)。林琦等人研究认为,柠檬酸可降低土壤对铅、镉的吸附,即活化了土壤中的铅和隔[4]。吴龙华等人对人工螯合剂EDTA进行了研究,发现施用3mmol/kg EDTA大幅度提高了土壤溶液中铜、锌、镉和铅的浓度[5]。
观赏植物吊兰(Chlorophytum comosum)隶属于百合科吊兰属,具有分布性广,环境竞争力强和易于栽培等特点,对重金属具有较好的耐性与积累特性[6]。柠檬酸(Citric acid,CA)是一种低分子有机酸,为天然螯合剂;EDTA(Ethylenediaminetetraacetic acid,乙二胺四乙酸)则是人工合成螯合剂的代表性物质。
本文采用吊兰对土壤中的铜进行提取,通过对相关指标的实验分析,初步讨论了在梯度浓度柠檬酸或EDTA的影响下,铜污染土壤中吊兰生长状况的变化,为柠檬酸和EDTA在土壤植物修复中的应用提供了理论基础和科学依据。
1 材料与方法
1.1 实验材料
供试植物为吊兰。2011年9月自吊兰母枝剪下带有气生根的吊兰幼苗,培养2周,待幼苗生根稳定后,选取根长5cm、株高8cm左右,生长状况近似的幼苗进行实验。供试土壤来源于安徽师范大学后山,基本性质为黄棕壤,最大持水量为60%,有机质含量13.35g/kg,全氮、全磷、全钾和土壤全铜含量分别为1.25、0.15、10.89、26.35g/kg。
1.2 实验设计
土壤风干后过2mm筛备用。在直径为12.5cm的塑料花盆中分别加入上述土壤250g,在前期预实验的基础上,一次性加入CuSO4·5H2O,使土壤的初始铜含量为400mg/kg,以不添加铜的土壤作为空白组(CK),将土壤静置2周。
静置结束后,将吊兰幼苗栽入实验组盆中,每盆2株。(每种处理各设置4盆:3盆为栽种吊兰的实验组,1盆为不种吊兰的对照组。)吊兰栽培20d后,采用滴灌的方法施加柠檬酸或EDTA溶液。柠檬酸和EDTA分别设置了 5 个处理浓度,即 0、2.5、5、7.5、10mmol/L,施加量为 5mL/d,共 40d。待栽培结束,立即对土壤和吊兰的相关指标进行实验分析。
1.3 实验方法
1.3.1 土壤全铜和有效态铜含量的测定
将花盆中的土壤倒出,风干,过0.1mm筛备用。取土样经盐酸-硝酸-高氯酸消解后,使用日本岛津(SHIMADZU)AA-6800型原子吸收分光光度计,以火焰原子吸收分光光度法测定其全铜含量。另取土样经0.1mol/L稀HCl浸泡并振荡90min后,同样采用火焰原子吸收分光光度法测定其有效态铜含量。
1.3.2 吊兰铜富集量的测定
称取烘干后的吊兰材料粉末 0.2g,加 10mL 混酸(HNO3∶60%HCLO4∶H2SO4=8∶1∶1)浸泡过夜。次日高温消化至溶液澄清,以0.5%HCl定容至25mL。双层滤纸过滤,取滤液,用日本岛津(SHIMADZU)AA-6800型原子吸收分光光度计测定其吸光度和对应的待测液铜浓度,分别计算吊兰地上部分和地下部分的铜含量,单位为mg/kg。
1.3.3 吊兰形态学指标的测定
将吊兰从盆中连根移出,仔细清理掉附着在根系表面的土壤,并用刻度尺(最小分度单位为mm)分别量取吊兰的根长(cm)和株高(cm)。
1.3.4 吊兰生物量的测定
将吊兰洗净,用剪刀从根部剪开,再用电子天平分别称取其地上部分和地下部分鲜重(g)。
1.3.5 吊兰叶片几种生理指标的测定
电导率(Electrical conductivity,EC):剪取吊兰叶片0.2g,剪成1cm长小段,加20mL双蒸水浸泡,振荡90min,用DDS-11A数显电导仪测定电导率,单位为μs/cm。
分别以TCA和丙酮提取丙二醛(Malondialdehyde,MDA)和叶绿素(Chlorophyll,Chl),并用WFJ7200型可见光分光光度计测定其含量[7]。
1.3.6 吊兰叶片抗氧化酶活性的测定
过氧化氢酶(Catalase,CAT)的活性测定采用高锰酸钾滴定法[8]。
过氧化物酶(Peroxidase,POD)的活性测定采用愈伤木酚法[7]。
超氧化物歧化酶(Superoxide dismutase,SOD)的活性测定采用NBT光还原法[7]。
1.4 数据分析
本节主要采用的是Microsoft Excel 2003和SPSS 17.0两种软件。使用Microsoft Excel 2003对平行样的平均值和标准差进行计算,同时使用SPSS 17.0进行不同处理之间的多重比较,以及数据之间的相关性分析。
2 结果与讨论
2.1 柠檬酸和EDTA对土壤中铜含量的影响
如图1所示,随着柠檬酸施加浓度的上升,土壤全铜含量先增大后减小,且在柠檬酸浓度为7.5mmol/L时达到峰值394.9mg/kg,显著高于不施加柠檬酸时的371.2mg/kg;在EDTA浓度为2.5mmol/L时,土壤全铜的含量达到最大值384.8mg/kg,高于在相同浓度柠檬酸调节下的土壤全铜含量,而在其他浓度的EDTA处理下,土壤全铜含量均低于柠檬酸的处理结果。
土壤中重金属的环境行为和生态效应除了受到土壤中重金属的总含量的影响,主要取决于其存在的形态,即生物有效态。有效态一般主要是指提取的水溶态和交换态等重金属,这部分重金属在土壤中具有较大的活性,容易被植物所吸收利用[9]。因此,土壤有效态铜含量的变化可以直接反映柠檬酸和EDTA对铜的活化效果的优劣。
如图2所示,随着柠檬酸处理浓度的上升,土壤中有效态铜的含量同样是先增大后减小,且在柠檬酸浓度为5mmol/L时达到峰值255.4mg/kg,显著高于不施加柠檬酸时的235.45mg/kg;EDTA对土壤铜的活化效果要低于相同浓度的柠檬酸,且土壤有效态铜含量在EDTA的影响下出现波动,也在浓度为5mmol/L时达到峰值 245.25mg/kg。
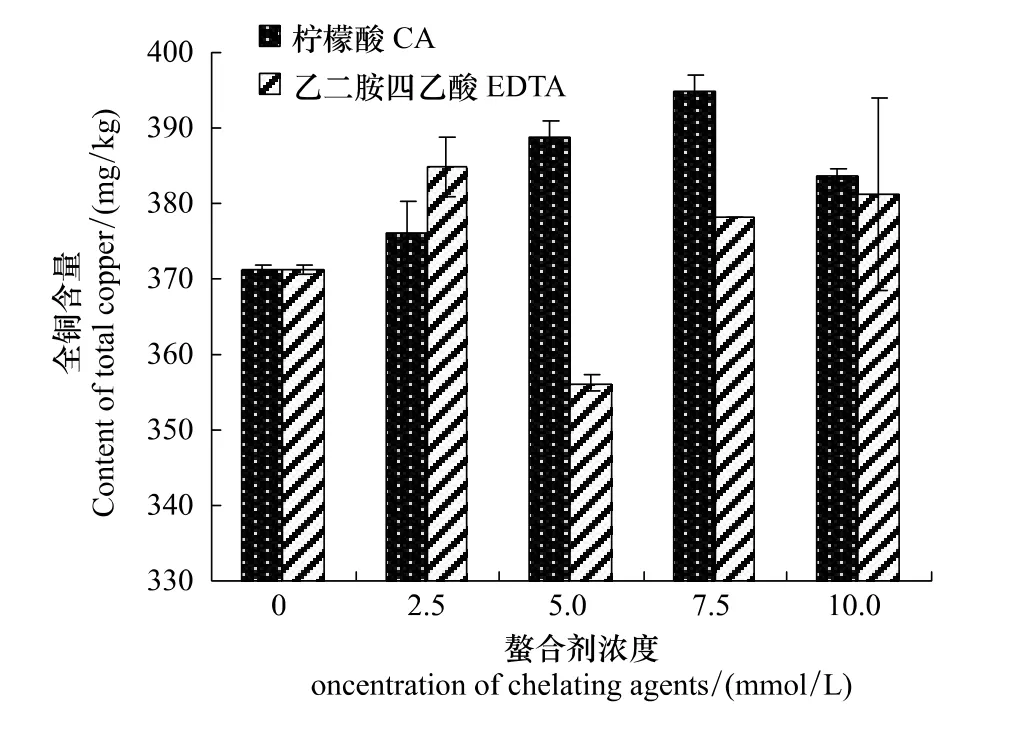
图1 柠檬酸和EDTA对土壤全铜含量的影响Fig.1 Effects of CA and EDTA on content of total copper in soil
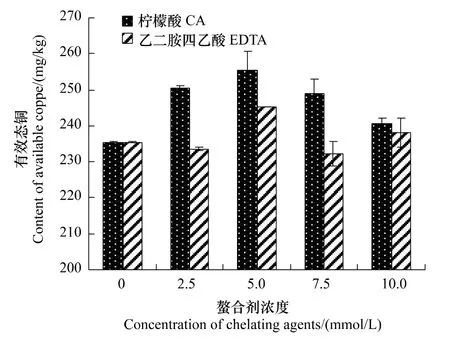
图2 柠檬酸和EDTA对土壤有效态铜含量的影响Fig.2 Effects of CA and EDTA on content of available copper in soil
由图1、图2可知,低浓度的柠檬酸和EDTA能够显著活化土壤中的铜,而这种活化作用在高浓度水平时却有所降低。这可能是由于高浓度的柠檬酸和EDTA会让土壤的pH值略有下降,从而使土壤中的各种生理生化活动都受到一定的影响,间接导致了这两种螯合剂对土壤铜活化作用的减弱。
可见,柠檬酸和EDTA对土壤铜的活化作用均在浓度为5mmol/L时达到最大,且柠檬酸的活化效果更强。
2.2 柠檬酸和EDTA对吊兰富集作用的影响
由图3可知,随着柠檬酸浓度的增大,吊兰对铜的富集量先上升后下降,地下部分富集量在柠檬酸浓度为2.5mmol/L时达到峰值1078.25mg/kg;地上部分的富集量在柠檬酸浓度为5mmol/L时达到峰值190.188mg/kg。由此可见,吊兰的地下部分比地上部分对柠檬酸更为敏感。在EDTA的调节下,吊兰对铜的富集量出现了大幅度的波动,且地下部分富集量明显低于相同浓度条件下柠檬酸调节的吊兰,其最大富集量出现在EDTA浓度为5mmol/L时,为808.375mg/kg,仅为柠檬酸调节下吊兰地下部分最大富集量的74.97%。可以看出,柠檬酸比EDTA对吊兰富集量的影响更大。
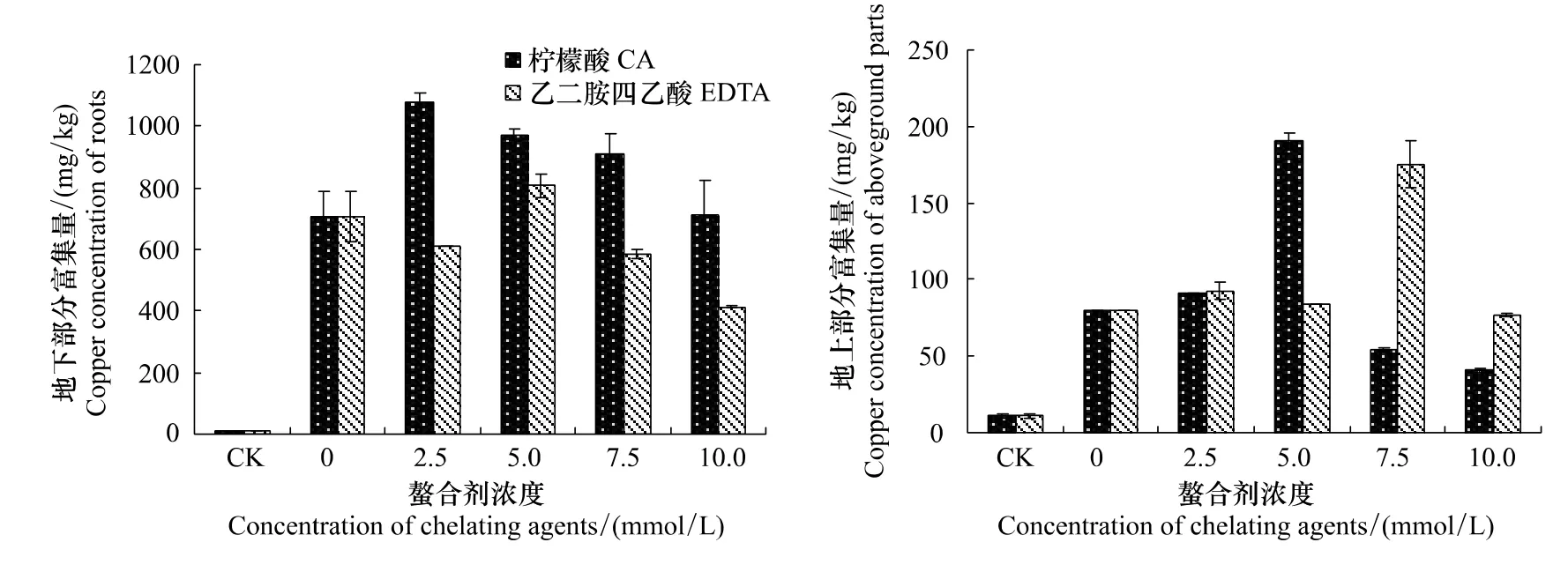
图3 柠檬酸和EDTA对吊兰富集作用的影响Fig.3 Effects of CA and EDTA on copper enrichment of C.comosum
由图2和图3可知,在柠檬酸和EDTA的作用下,吊兰对铜富集量的变化趋势与土壤中有效态铜含量的变化趋势基本吻合。经SPSS分析,在柠檬酸和EDTA的影响下,土壤的有效态铜含量与吊兰地下部分的铜富集量为显著性正相关(表1)。结合本章第一节的讨论,可以得出以下结论:由于柠檬酸对土壤中铜的活化能力较强,所以其对吊兰富集作用的影响比EDTA大。
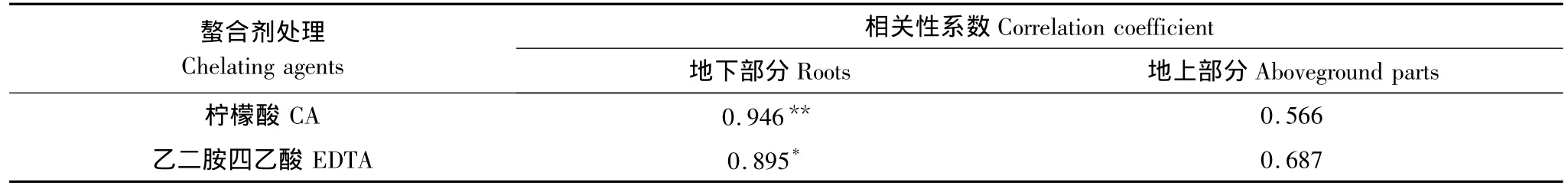
表1 土壤有效态铜含量与吊兰对铜富集量的相关性分析Table 1 Correlation analysis of available copper in soil and copper enrichment of C.comosum
此外,生物富集系数(BC)是指植物中重金属的浓度除以土壤的全铜浓度所得到的值。通常用来描述植物对重金属的富集能力[10]。如图4所示,在柠檬酸影响下吊兰的BC曲线高于EDTA影响下的吊兰,且值均大于1,这进一步肯定了以上结论。为什么柠檬酸和EDTA在高浓度时会明显抑制吊兰对土壤铜的吸收呢?首先,由2.1部分的讨论可知,
在高浓度螯合剂的影响下,土壤有效态铜的含量有所降低,这直接影响了吊兰对铜的富集效果;其次,高浓度螯合剂施入土壤后会与阳离子形成稳定的络合物,而复杂结构形态的重金属生物活性较差,所以会抑制植物对其的吸收作用[11]。因此,低浓度的柠檬酸和EDTA通过活化土壤中的铜,能够促进吊兰对铜的吸收;而高浓度的柠檬酸和EDTA使土壤溶液中的高稳定螯合剂-重金属复合物增多,反而不利于吊兰的吸收。
2.3 柠檬酸和EDTA对铜污染条件下吊兰生长的影响
2.3.1 柠檬酸和EDTA对铜污染条件下吊兰形态学指标的影响
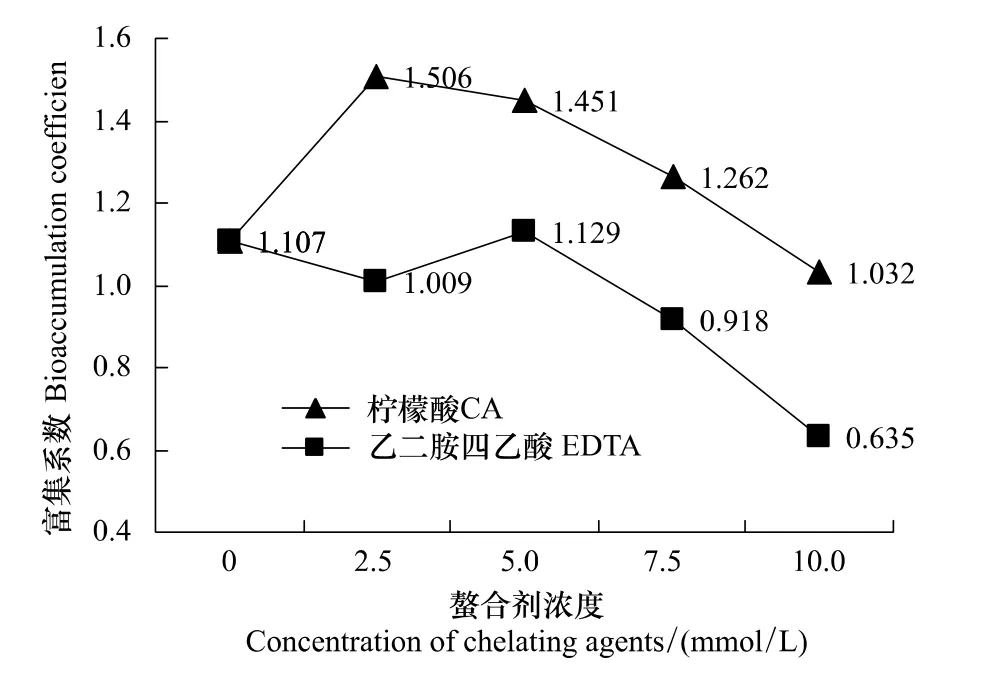
图4 柠檬酸和EDTA对吊兰富集系数的影响Fig.4 Effects of CA and EDTA on bioaccumulation coefficient of C.comosum
由表2可知,吊兰的根长在柠檬酸浓度低于2.5mmol/L时下降,在柠檬酸浓度高于2.5mmol/L时数值明显上升;吊兰株高以5mmol/L柠檬酸为界,先减小后变大。这与柠檬酸对吊兰地下部分和地上部分铜富集量的影响恰好相反,说明柠檬酸对土壤铜的活化作用将间接抑制吊兰的生长。
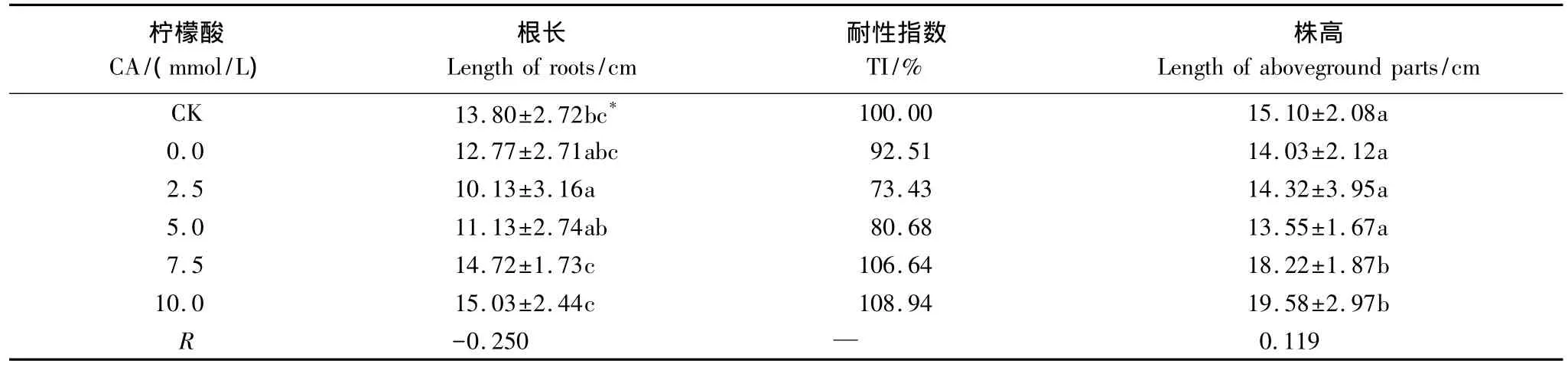
表2 柠檬酸对吊兰形态学指标的影响Table 2 Effects of CA on morphological indicators of C.comosum
本实验采用的土壤铜浓度为400mg/kg,接近吊兰存活条件的临界值,在这种水平的铜胁迫下,吊兰生长会受到一定程度的抑制。从相关性系数上看,在柠檬酸和EDTA的影响下,吊兰根长与土壤有效态铜含量呈不显著负相关,吊兰株高则是与两种螯合剂的浓度变化基本无关。然而,吊兰的根长和株高均在柠檬酸浓度为10mmol/L 时达到最大值,分别是 15.03、19.58cm,都超过了空白组(CK)的数值13.8、15.1cm,耐性指数 TI也达到了最大值108.94%。也就是说,在高浓度柠檬酸的作用下,铜污染土壤中吊兰的形态学指标恢复到了正常生长水平以上。可以看出,柠檬酸本身对吊兰的生长可能还具有一定的促进作用。
已知在EDTA的影响下吊兰对土壤铜的富集量呈波动状态。如表3所示,随着EDTA浓度的上升,吊兰的形态学指标数据也呈现出不规律波动的变化趋势。其中,根长只在EDTA浓度为5mmol/L时与不添加EDTA时的值差异显著,株高则在各个处理之间均表现为差异不显著。说明EDTA对铜污染土壤中吊兰的生长没有明显的影响。
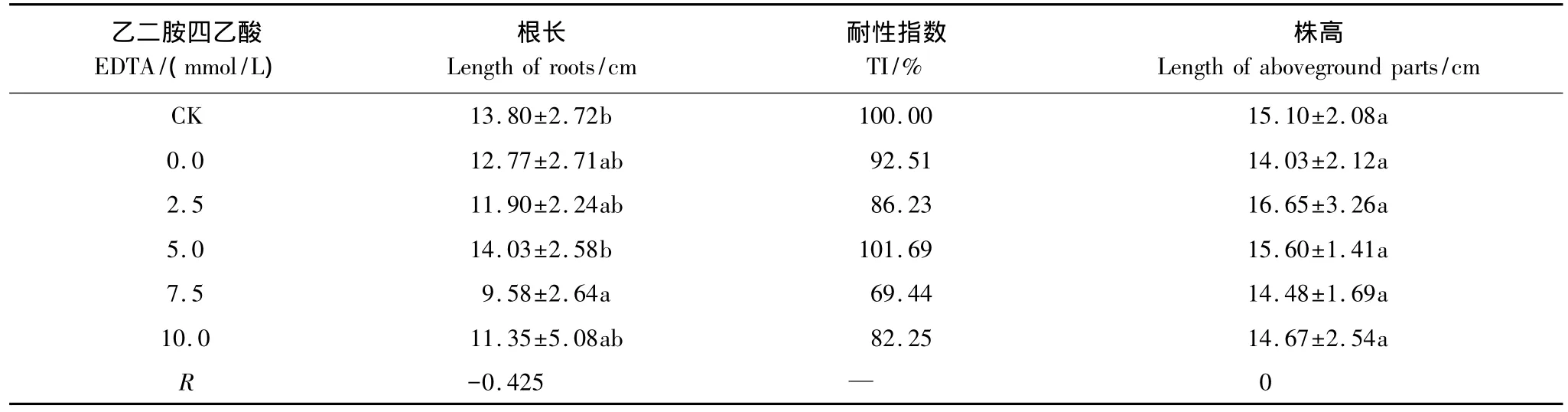
表3 EDTA对吊兰形态学指标的影响Table 3 Effects of EDTA on morphological indicators of C.comosum
2.3.2 柠檬酸和EDTA对铜污染条件下吊兰生物量的影响
如图5,与形态学指标相似,在柠檬酸的影响下,吊兰的鲜重水平以5mmol/L柠檬酸为转折点先减小后变大;在EDTA的影响下,吊兰的生物量大致呈现出了无显著差异性的波动。结合2.1部分的讨论,吊兰生物量的变化与吊兰对土壤铜的富集量密切相关,即吊兰的生物量间接地与柠檬酸和EDTA对土壤铜的活化作用相关。
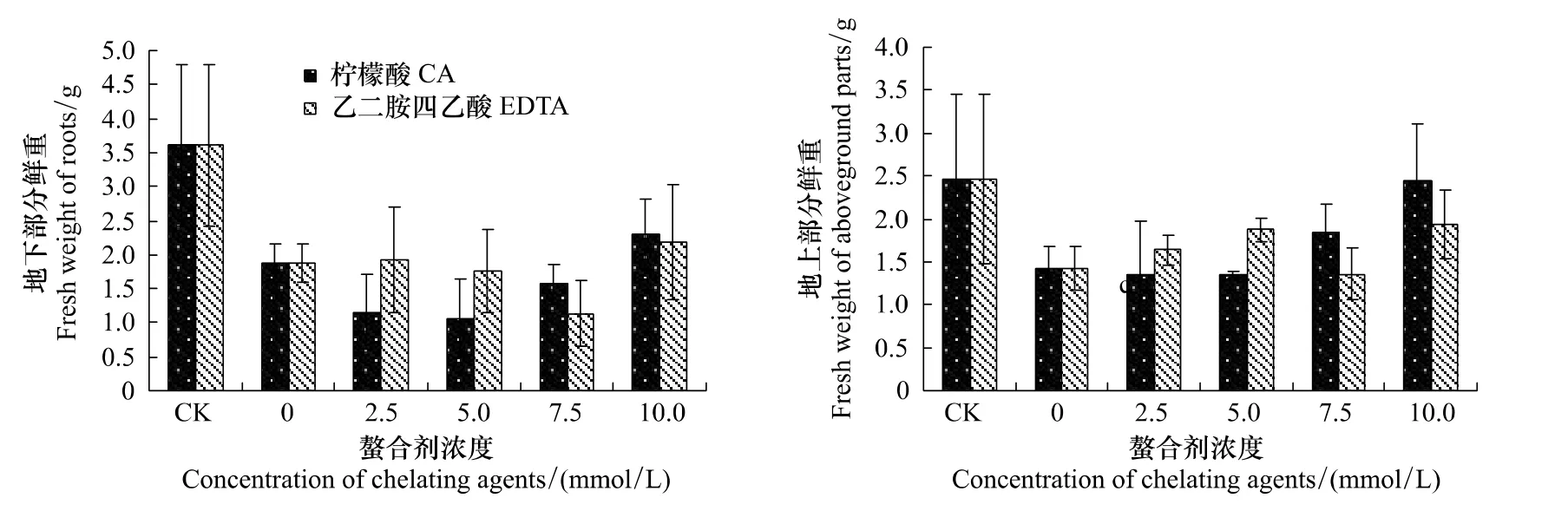
图5 柠檬酸和EDTA对吊兰生物量的影响Fig.5 Effects of CA and EDTA on biomass of C.comosum
2.3.3 柠檬酸和EDTA对铜污染条件下吊兰叶片几种生理指标的影响
当植物处于逆境时,自由基增多,作用于脂质发生过氧化反应,产生的大量活性氧会打破动态平衡,给植物体造成严重的损伤,从而导致电解质外泄。因此,电导率(EC)是检测叶片损伤程度的重要指标。而叶绿素含量(Chl)则是反映植物光合作用强度的指标之一[13-14]。
由表4、表5可知,在土壤中加入柠檬酸和EDTA后,吊兰叶片的电导率以较大幅度的波动对铜胁迫产生应答,且电导率的实验组数据均比空白组(CK)大。叶绿素含量则呈现出幅度较小的变化。由表中的相关性系数可知,两种螯合剂对吊兰生理指标的影响虽不显著,但相比而言,柠檬酸的影响要略小于EDTA。
可以看出,柠檬酸和EDTA对因土壤铜污染而受到损伤的吊兰叶片没有明显的修复作用。
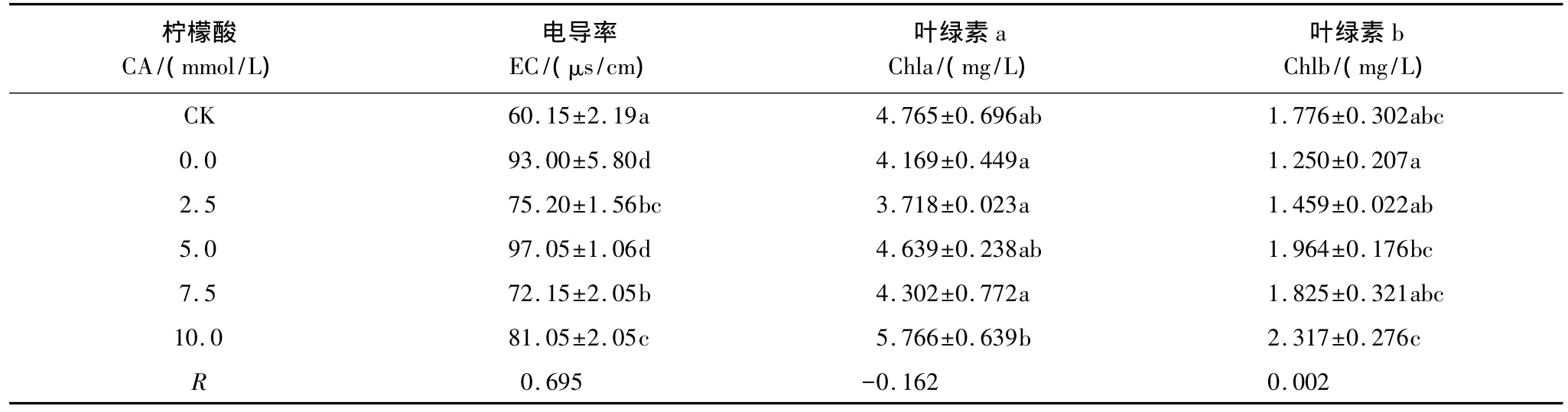
表4 柠檬酸对吊兰几种生理指标的影响Table 4 Effects of CA on some physiological indexes of C.comosum
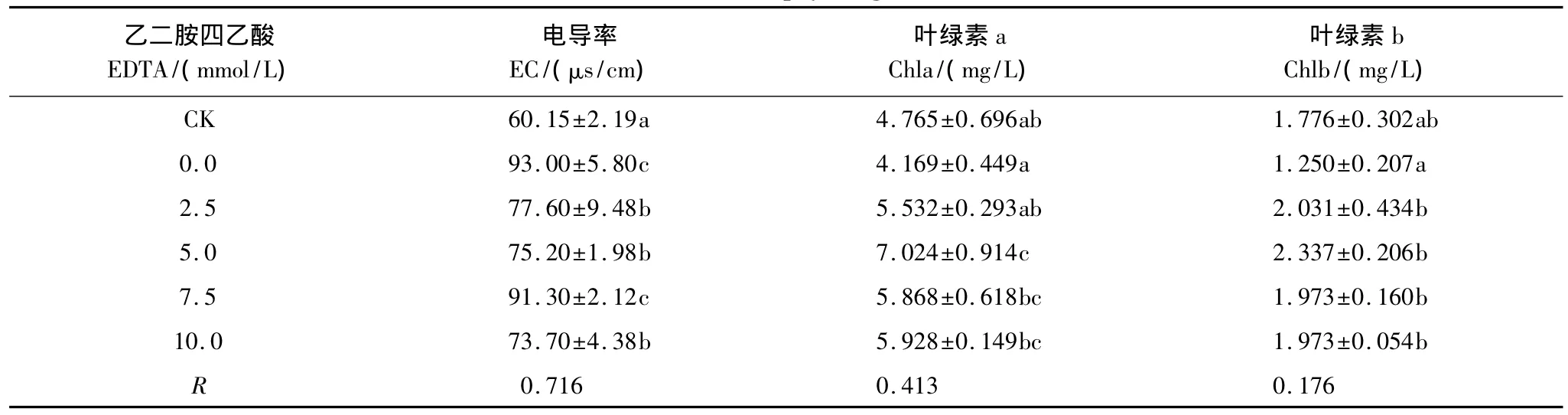
表5 EDTA对吊兰几种生理指标的影响Table 5 Effects of EDTA on some physiological indexes of C.comosum
2.3.4 柠檬酸和EDTA对铜污染条件下吊兰叶片的丙二醛含量和抗氧化酶活性的影响
当植物受到环境胁迫时,会由于自由基增多而导致过氧化损伤,而氧化终产物丙二醛(MDA)则常被用来指示植物叶片的受损程度。如表6、表7所示,在土壤中加入柠檬酸和EDTA后,吊兰叶片的丙二醛含量表现为各个处理之间无统计学差异,且实验组数据均比空白组(CK)大。
细胞中H2O2的积累能降低CO2的固定效率,尤其是H2O2和通过Haber-Weiss反应会产生更多的活性氧,所以及时清除H2O2对防止活性氧十分重要。在正常情况下,生物体会通过抗氧化酶的联合作用对活性氧自由基进行清除,以减轻机体损伤。超氧化物歧化酶(SOD)是的净化剂,通过消除;过氧化氢酶(CAT)可将高浓度的H2O2清除;过氧化物酶(POD)可清除植物组织中产生的低浓度的
当生物体受到轻度逆境胁迫时,抗氧化酶活性会应激性升高,增强对活性氧的清除能力;当受到重度环境胁迫时,细胞抗氧化系统的平衡遭到破坏,抗氧化酶活性会受到抑制,体内活性氧积累,带来机体损伤,所以抗氧化酶活性也是反映生物体对环境胁迫适应程度的重要指标[17]。在土壤铜浓度为400mg/kg的环境下,吊兰的抗氧化酶活性应该是处于受到抑制的状态。
如表6、表7所示,在柠檬酸和EDTA的作用下,吊兰叶片CAT的活性出现小幅度波动,可见柠檬酸和EDTA对铜污染环境下吊兰CAT活性所受到的抑制没有明显的缓解作用。
在柠檬酸和EDTA的影响下,实验组吊兰的POD活性表现为先显著低于空白组(CK),后随着柠檬酸和EDTA浓度的升高而有所上升,特别是EDTA调控下的吊兰POD活性呈现出明显的上升趋势,在EDTA浓度为7.5mmol/L时达到最大值111.833U·min-1·g-1,显著高于不添加EDTA时的73.167U·min-1·g-1,活性提高了 52.846%。
实验组吊兰的SOD活性虽然随着柠檬酸和EDTA浓度的增加有一定的波动,但仍表现为低于空白组(CK),甚至高浓度处理组还低于未施加调节剂的组别。这是由于在受到胁迫时,SOD的灵敏度较高,通常会首先发生变化[18]。且根据相关性分析的结果也不难看出,吊兰的抗氧化酶活性对两种螯合剂的敏感度依次为:SOD>POD>CAT。因此在高浓度铜的胁迫下,吊兰的SOD活性整体上是受到抑制的,而且柠檬酸和EDTA对土壤中铜的活化可能还加重了这种抑制。
从以上分析可以得出,柠檬酸和EDTA对铜污染环境下吊兰抗氧化酶活性的影响主要体现在有利于POD活性的提高,且EDTA效果较好。
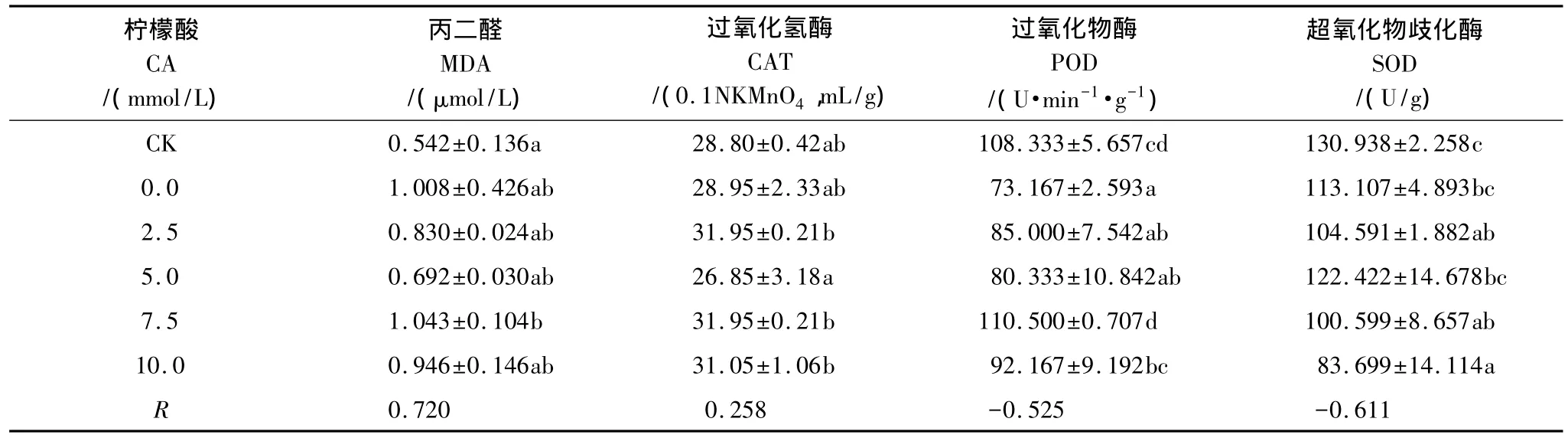
表6 柠檬酸对吊兰的丙二醛含量和抗氧化酶活性的影响Table 6 Effects of CA on content of MDA and activities of antioxidant enzymes of C.comosum
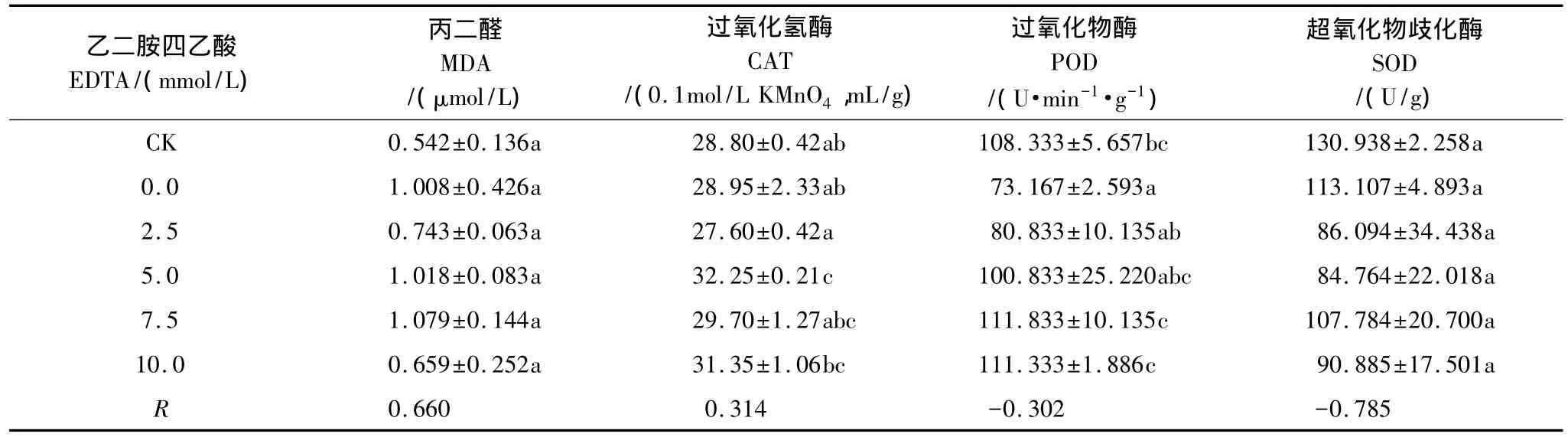
表7 EDTA对吊兰的丙二醛含量和抗氧化酶活性的影响Table 7 Effects of EDTA on content of MDA and activities of antioxidant enzymes of C.comosum
3 结论
(1)柠檬酸和EDTA对吊兰富集量的影响与其对土壤中铜的活化能力呈显著性正相关。柠檬酸对土壤铜有较强的活化作用,能够有效提高吊兰对铜的吸收,且在浓度为5mmol/L时效果最为明显;而EDTA对吊兰富集作用的影响相对较弱。
(2)柠檬酸本身对吊兰生长可能具有一定的促进作用,但其通过提高吊兰的铜富集量,间接抑制了吊兰的生长,且这种抑制主要体现在形态学指标和生物量上;EDTA对吊兰生长无显著影响,对吊兰叶片的POD活性却有明显的促进作用。相比而言,柠檬酸对吊兰生长状况的影响比EDTA大。
[1] Bai X Y,Liu H H,Hu J J,Qin F,Su X L.Research progress and development trend of floral bioremediation technology in the soil polluted by heavy metal.Journal of Anhui Agricultural Sciences,2009,37(18):8672-8674.
[2] Shang A A,Liu Y R,Liang Z S,Dang Z.Research progress of bioavailability of heavy metals in soil.Soils,2000,6:294-300.
[3] Jiang L Y,Yang X E,Shi W Y,Ye Z Q.Activation of soil heavy metals for phytoremediation.Chinese Journal of Soil Science,2003,34(2):154-157.
[4] Lin Q,Chen Y X,Chen H M,Zheng C R.Effect of organic acids on soil chemical behavior of lead and cadmium and their toxicity to plants.Chinese Journal of Applied Ecology,2001,12(4):619-622.
[5] Wu L H,Luo Y M,Zhang H B.Research of environmental risk in strengthening phytoremediation by organic complexation I.Effect of EDTA on TOC and heavy metals dynamic changes in composite contaminated soil.Soils,2001,4:189-192.
[6] Wang Y B,Yan A L,Zhang X Q,Wu T T.Effect of the growth of Chlorophytum comosum on Cd forms and content in soil.Journal of Soil and Water Conservation,2010,24(6):163-172.
[7] Zhang Z L,Qu W J.Guidance of Plant Physiological Experiments,3rd ed.Bei Jing:Higher Education Press,2003:67-69,123-124,268-269,274-276.
[8] Bai B Z,Tang X J.Testing Technology of Plant Physiology.Bei Jing:Science and Technology Press of China,1993:82-83.
[9] Hou M,Wang X G.Study on extraction conditions and extractants for available vanadium in soil.Chinese Journal of Soil Science,2010,41(5):1241-1245.
[10] Monni S,Salemaa M,White C,Tuittila E,Huopalainen M.Copper resistance of Calluna vulgaris originating from the pollution gradient of a Cu-Ni smelter,in southwest Finland.Environmental Pollution,2000,109:211-219.
[11] Yu G F,Jiang X,Sun L,Wang F,Bian Y R.A review for effect of organic substances on the availability of cadmium in soils.Acta Ecologica Sinica,2002,22(5):770-776.
[12] Wilkins D A.The measurement of tolerance to edaphic factors by means of root growth.New Phytologist,1978,80:623-633.
[13] Burzynski M,Klobus G.Changes of photosynthetic parameters in cucumber leaves under Cu,Cd,and Pb stress.Photosynthetica,2004,42(4):505-510.
[14] Faisal M,Anis M.Changes in photosynthetic activity,pigment composition,electrolyte leakage,lipid peroxidation,and antioxidant enzymes during ex vitro establishment of micropropagated Rauvolfia tetraphylla plantlets.Plant Cell Tissue and Organ Culture,2009,99:125-132.
[15] Fu C,Guan Y,Xu N.Effect of salt stress on the activity of antioxidative enzymes of glycine soja and glycine max.Soybean Science,2007,26(2):144-148.
[16] Gajewska E,Sklodowska M.Effect of nickel on ROS content and antioxidative enzyme activities in wheat leaves.BioMetals,2007,20:27-36.
[17] Ou X M,Lei M X,Wang X G,Fan D F.Effect of novel insecticide HNPC-A9908 on physiological and biochemical characteristics of green algae Chlorella pyrenoidosa chick.Journal of Agro-environment Science,2004,23(1):154-158.
[18] Jiang L,Chen S Y,Yin D Q.Effects of tetracycline on photosynthesis and antioxidant enzymes of Microcystis aeruginosa.Journal of Ecology and Rural Environment,2010,26(6):564-567.
参考文献:
[1] 白向玉,刘汉湖,胡佳佳,秦峰,苏晓丽.重金属污染土壤的花卉植物修复技术研究进展及发展趋势.安徽农业科学,2009,37(18):8672-8674.
[2] 尚爱安,刘玉荣,梁重山,党志.土壤中重金属的生物有效性研究进展.土壤,2000,6:294-300.
[3] 姜理英,杨肖娥,石伟勇,叶正钱.植物修复技术中有关土壤重金属活化机制的研究进展.土壤通报,2003,34(2):154-157.
[4] 林琦,陈英旭,陈怀满,郑春荣.有机酸对Pb、Cd的土壤化学行为和植株效应的影响.应用生态学报,2001,12(4):619-622.
[5] 吴龙华,骆永明,章海波.有机络合强化植物修复的环境风险研究I.EDTA对复合污染土壤中TOC和重金属动态变化的影响.土壤,2001,4:189-192.
[6] 王友保,燕傲蕾,张旭情,吴亭亭.吊兰生长对土壤镉形态分布与含量的影响.水土保持学报,2010,24(6):163-172.
[7] 张志良,瞿伟菁主编.植物生理学实验指导,第三版.北京:高等教育出版社,2003:67-69,123-124,268-269,274-276.
[8] 白宝璋,汤学军主编.植物生理学测试技术.北京:中国科学技术出版社,1993:82-83.
[9] 侯明,王香桂.土壤有效态钒的浸提剂和浸提条件研究.土壤通报,2010,41(5):1241-1245.
[11] 余贵芬,蒋新,孙磊,王芳,卞永荣.有机物质对土壤镉有效性的影响研究综述.生态学报,2002,22(5):770-776.
[15] 付畅,关旸,徐娜.盐胁迫对野生和栽培大豆中抗氧化酶活性的影响.大豆科学,2007,26(2):144-148.
[17] 欧晓明,雷满香,王晓光,樊德方.新杀虫剂HNPC-A9908对蛋白核小球藻生理生化特性的影响.农业环境科学学报,2004,23(1):154-158.
[18] 姜蕾,陈书怡,尹大强.四环素对铜绿微囊藻光合作用和抗氧化酶活性的影响.生态与农村环境学报,2010,26(6):564-567.

