氮磷供给比例对长白落叶松苗木磷素吸收和利用效率的影响
魏红旭,徐程扬,马履一,段 劼,江俐妮,朱开元,周江华
(1.北京林业大学省部共建森林培育与保护国家重点实验室,北京 100083;2.浙江省农业科学院花卉研究开发中心,杭州 311202)
磷(P)素几乎在所有植物体生理代谢中都起着核心作用,P也是限制植物生长的主要营养元素之一[1]。P在植物体内含量较低,且在土壤中移动性极差,土壤养分有效性较高时植物体内P浓度仅占干物质的0.4%—1.5%[2]。与之相反,氮(N)素被植物吸收和利用的水平远高于P。大量研究力图通过量化树体N∶P比例关系来估测生态系统的养分限制因子[3-5]。最新研究结果显示P缺乏和桉树体内大多数氨基酸无明显关联[1],但更多报道结果显示树体地上部分有机N和P浓度间呈正相关关系[5-6]。然而,前人研究更多的关注于植物地上部分——尤其叶片的响应[2,4-5]。对于根系养分吸收过程中N对P的影响研究相对较少。
已有研究结果表明,植物根系对P的吸收会因N素的添加而增强[7-9]。然而,N对P吸收的影响是否和同化P的关键作用酶活性有关?由于针叶苗木对于-N具有吸收偏好性[10-11],在不同无机N形态环境中苗木根系对P的吸收是否也受该偏好性影响?N会对同化后P的利用产生何种影响?目前研究结果尚不能对这些问题给出明确答案。
长白落叶松(Larix olgensis Henry.)广泛的分布于我国东北长白山(42°23'N,128°6'E)、北朝鲜(41°52'N,128°23'E)和东俄罗斯(45°18'N,137°6'E)地区,是典型的东亚温带针叶树种之一。因其速生及耐旱等特性,长白落叶松在我国东北地区得以广泛的培育和栽植[12]。本研究以长白落叶松幼苗为材料,通过控制条件下不同N∶P的供给创造不同N∶P有效性比例,观察苗木对P的吸收和利用、根系形态以及酸性磷酸酶活性的影响(试验一)。同时,考虑到针叶树种对不同无机N素形态吸收的选择性[10-11],本研究另选同一批的不同苗木用于养分耗竭试验,通过改变不同无机形态N素的浓度创造出和试验一相同的N∶P供给比例,并观察根系对P素短期吸收的响应(试验二),用以补充解释试验一的结果。本研究力图通过控制试验手段从机理上解释N∶P比例关系对P素吸收和利用的影响,为相关研究和生产工作提供一定的理论参考。
1 材料与方法
1.1 试验材料
供试植物为长白落叶松(L.olgensis H.)播种苗,种子来自吉林省吉林市江密峰苗圃(43°45'N,126°45'E),发芽率为35%,千粒重3.9 g。本研究由两个试验组成。用于试验一的苗木采用盆栽方法培育;用于试验二的苗木采用常规方法培育后取样并移至控制环境。
1.2 试验方法及设计
(1)试验一
试验地点为北京市门头沟区华北林业实验中心温室。育苗容器规格为24 cm×20 cm×36 cm(口径 ×底径 ×高);基质为1∶1的草炭和珍珠岩,容重0.16 g/cm3,pH值6.63。N源采用北京凯恩威利化肥国际贸易有限公司生产的含N量43%的缓释N肥;P源为北京庆盛达化工有限公司生产的含P2O5量16%的过磷酸钙。通过同一容器内不同 N∶P 供给量设置 N∶P 比例为1∶3(N 15 mg/株,P 45 mg/株)、1∶2(N 20 mg/株,P 40 mg/株)、1∶1(N 30 mg/株,P 30 mg/株)、2∶1(N 40 mg/株,P 20 mg/株)、3∶1(N 45 mg/株,P 15 mg/株)的处理。以上各N∶P比例的设置参考我国东北地区对长白落叶松苗木培育中的N、P施肥量:1∶3比例模拟生产上只基肥(磷酸二铵,18-46-0)不追肥处理,1∶2—3∶1比例分别表示尿素(46-0-0)追肥量逐渐增大直至供N总量达到供P量3倍的水平。每处理3重复,每重复1容器,完全随机摆设。2009年5月14日浇透底水以充分淋洗基质中预存养分,随后根据试验设计施肥后每盆播种50粒;5月29日出苗,6月8日幼苗出齐,6月13日间苗后每盆定株20。出苗期、夏季和秋季每盆灌溉量分别为0.8、0.4和0.2 L。每周雾化灌溉3次并将所有容器重新摆放一次以减少边际影响。基质平均温度26.3℃,昼、夜平均气温分别是30.1°C和20.2℃,空气湿度41%,自然光周期。2009年9月初收获苗木。
(2)试验二
2009年4月末以常规方法于江米峰苗圃苗床内播种并育苗。为保证取样的代表性,2009年夏季苗木速生期时于苗圃内不同位置完整挖取长势均一的长白落叶松苗木500株并以冰盒(0—4°C)鲜运至实验室。所取苗木平均苗高8.4 cm、地径1.8 mm。洗净根系表面土壤及杂质后,用蒸馏水对苗木进行24 h的养分饥饿预处理。
采用养分耗竭法开展试验,于9:00开始,采用自然光源,试验期间温度保持在23°C。初始营养溶液pH值调至6.5。将饥饿处理的苗木移入容积为90 mL的容器瓶中,每瓶10株苗。分别以-N和-N为N源开展不同N∶P供给比例的吸收动力学试验,通过调整N浓度实现N∶P浓度比例的变化。-N由(NH4)2SO4提供,-N 由 KNO3提供,P 由 H3PO4提供。每 N 源各设置 5 个 N 浓度:0.6、0.9、1.8、3.6 和5.4 mmol/L/株。所有处理P浓度均为1.8 mmol/L/株。因此,各N浓度下分别对应和试验一相同的1∶3、1∶2、1∶1、2∶1、3∶1的比例。每处理5重复,每瓶为一个测定单元。以小块海绵固定于瓶口处。为控制无氧呼吸,向每瓶内加入1滴H2O2。耗竭时间为6 h,逐瓶记录时间。营养液初始体积为75 mL,试验后在30 s内吸干根系表面水分、切下根系并称其鲜重,之后精测每瓶内剩余溶液体积和P浓度。以上试验方法设置参考魏红旭等的报道[11]。
1.3 指标测定
试验一中苗木收获后立即洗净根系表面
其中10株分为叶、茎和根3部分。称量根系鲜重后,利用EPSON 1600+型扫描仪对根系形态扫描后,以WinRHIZO®软件(加拿大Regent公司)分析扫描生成的TIF图片,并获得根系长度、表面积、体积、根尖数和平均根直径的数据。扫描后根系和茎、根于烘箱内70℃烘干48 h后称其干重生物量,之后粉碎、过1 mm筛后,取0.5 g样品以H2SO4-H2O2消煮,取7 mL消煮液定容至50 mL,通过0.45 μm滤膜后测定P浓度(ICAPOES,Perkin Elmer Co.,Waltham,United States)[13]。
试验二中剩余溶液P浓度测定方法同此。
试验一中每盆另外10株苗木以液氮保存至试验室进行酸性磷酸酶活性的测定:
0.1 g鲜样用蒸馏水洗净表面后以滤纸吸干,置于盛有10 mL反应液(以0.2 mol/L CH3COONa为溶剂在pH值5.8时溶解0.5 g对硝基苯磷酸二钠)试管中,在25℃、黑暗条件下培养30 min后立刻加入1 mL的6 mol/L NaOH终止反应,在波长405 nm处测定反应液中对硝基苯酚(NPP)的量(μg),酸性磷酸酶活性以μg
NPP/min/g根系FW来表示,并以培养前加入1 mL的6 mol/L NaOH为对照[14]。
1.4 数据计算
P利用指数的计算参考Hawkins[15]所使用的方法,以苗木整株生物量(mg)除以叶片P浓度(%)得到。P吸收效率以全株苗木P含量占总供P量的百分比得到。为了更为直观的对苗木生物量和P吸收在不同施肥处理下的响应进行描述,参考Salifu和Timmer[16]所介绍的矢量养分分析的方法分别对苗木叶片和根系中的生物量、P含量和P浓度间关系加以矢量化。离子吸收速率I(mmol·h-1·g-1鲜重)的计算同魏红旭等[11]的方法:

式中,C0和C1分别表示处理前后营养液的离子浓度(mmol/L),本试验以营养液中N离子浓度的变化来计算P的I值;V0和V1分别表示处理前后营养液的体积(L);T为处理时间(h);RFM为根系鲜重(g)。
Michaelis-Mentens方程描述的计算采用Hanes-Wolf线性转换法[17]:
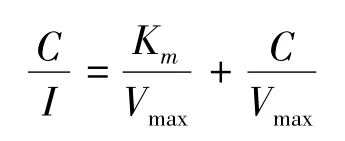
式中,C为营养液离子浓度(mmol/L);Vmax为最大吸收速率(mmol·h-1·g-1鲜重);Km为表观米氏常数[11]。
1.6 数据分析
用 SAS 9.0 软件(SAS Institute Inc.,NC,U.S.A.)的 ANOVA 过程的分析 N∶P 供给比例(1∶3、1∶2、1∶1、2∶1、3∶1)对试验一中测得的苗木生长、P吸收和利用、酶活性以及试验二中的P吸收速率结果的影响,如果one-way ANOVA效应显著则以Tukey检验对结果在α=0.05水平进行多重比较。用Sigmaplot 11.0软件(Systat Software,Inc.,Washington,U.S.A)对试验一中P吸收和利用数据和试验二中P吸收速率数据进行回归拟合分析并找出相关关系最为紧密的模型对其进行描述。对比利用Hanes-Wolf线性转换所计算出的Michaelis-Mentens系数在不同N源处理下对苗木根系对P吸收速率的差异,并用回归结果估计拟合精度。
2 研究结果
2.1 苗木生长响应
随着N∶P供给比例的提高,长白落叶松苗木根系生物量呈现增加的趋势(P=0.0027)(表1)。2∶1和3∶1比例下根系生物量分别较1∶3比例提高了18%(P=0.0250)和29%(P=0.0003),同时3∶1比例下根系生物量较1∶1比例提高了28%(P=0.0056)。和根系生物量的规律类似,根系直径也表现出随着供N比例的提高而增加的趋势 (P=0.0013)。3∶1比例下细根长度、表面积和直径分别较1∶1比例提高了14%(P=0.0178)、21%(P=0.0004)和5%(P=0.0009),但是这两个比例下根系体积或根尖数间均无显著差异(根系体积P=0.0934;根尖数P=0.1153)。1∶2比例下根系长度、表面积和根尖数分别较1∶1比例下根系高出10%(P=0.0024)、13%(P=0.0018)和17%(P=0.0005)。
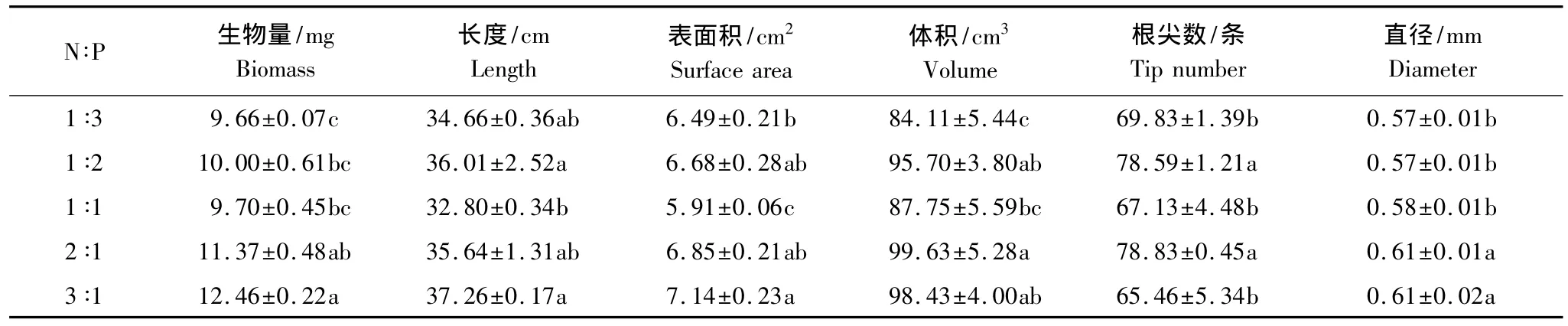
表1 不同N∶P比对长白落叶松苗木根系生物量和形态指标的影响Table 1 The effect of N∶P ratio on root biomass and root morphological parameters of L.olgensis seedlings
2.2 N∶P比例对P素吸收和利用的影响
N∶P供给比例对叶片P浓度具有显著影响(P=0.0187)。1∶2比例下叶片P浓度较2∶1和3∶1比例分别高 37%(P=0.0270)和 45%(P=0.0014),但是和 1∶3 或 1∶1 间差异不显著(1∶3 P=0.0699;1∶1 P=0.0804)(图1)。N∶P供给比例对根系P浓度(P=0.8889)和叶片与根系中的P含量(叶片 P=0.2459;根系P=0.9971;图1)均无显著影响。和叶片P浓度的响应规律相反,2∶1和3∶1比例下P利用指数较1∶2比例显著提高84%(P=0.0002)和37%(P=0.0014)(图2),拟合结果显示当N∶P比例为0.488时P利用指数将达到最小值16。随着N∶P供给比例的提高,P吸收效率呈线性正相关响应(图2),3∶1比例下的P吸收效率较1∶3和 1∶2 比例显著高出 1.9 倍和1.6 倍(P=0.0004)。

图1 长白落叶松苗木叶片和根系中P浓度和P含量对不同N∶P比例的响应Fig.1 Responses of P concentrations and P contents in needles and roots of L.olgensis seedlings to different N∶P ratios

图2 不同N、P比例对长白落叶松苗木P利用效率和P吸收效率的影响Fig.2 The effect of N∶P ratio on P utilization index and P uptake efficiency of L.olgensis seedlings
以1∶2比例作为参照进行矢量养分分析的结果显示:对于叶片,除1∶1比例表现出相对养分稀释的趋势外,3∶1、2∶1和1∶3比例均表现出相对养分亏缺的趋势(图3)。由于2∶1和3∶1比例下叶片P浓度显著低于1∶2比例(图1),此两个N∶P比例下叶片的相对养分亏缺症状表现显著(图3)。然而,2∶1和3∶1比例下叶片酸性磷酸酶活性显著高于1∶2比例(P=0.0026;表2)。和1∶2比例相比,3∶1比例下根系生物量显著提高(表1),但P含量和浓度变化均不显著(图1),因此该比例下苗木表现出显著的相对养分稀释症状,同时其它比例下苗木则表现出相对养分过量的趋势(图3)。根系中酸性磷酸酶活性在1∶2比例下显著高于1∶1比例(P=0.0003;表2)。
2.3 不同无机N形态对P素吸收的动力学特征影响

图3 长白落叶松苗木叶片和根系中生物量、P含量和P浓度间关系的矢量营养分析Fig.3 Vector analysis of the relationship between biomass,P content and P concentration in needles and roots of L.olgensis seedlings
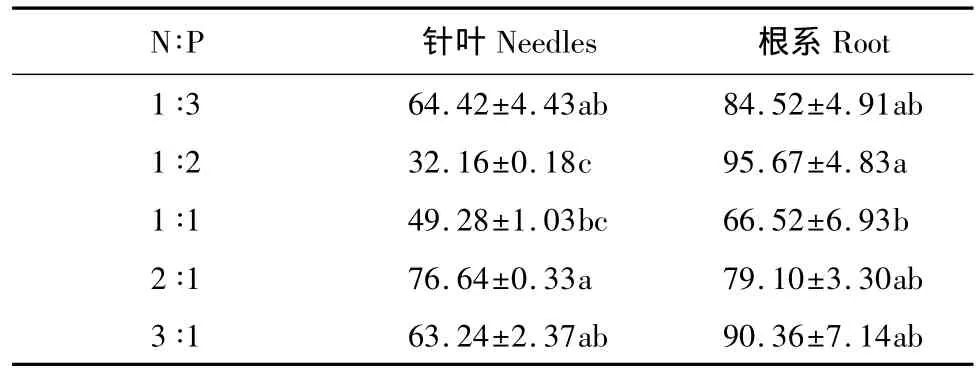
表2 长白落叶松苗木针叶和根系中酸性磷酸酶的活性对N∶P比例的响应/(μg NPP min-1g-1鲜重)Table 2 Responses of activity of acid phosphatase in needles and roots of L.olgensis seedlings to different N∶P ratios

图4 以铵态N和硝态N为N源情况下不同N∶P比例处理对长白落叶松苗木根系P吸收速率的影响Fig.4 Effects of-N and-N originated N ∶P ratios on P uptake rate in roots of L.olgensis seedlings
3 讨论与结论
3.1 苗木根系生长响应
试验一中随着N∶P比例的提高根系生物量的增加(表1)很有可能是苗木根系在N供给逐渐充盈的情况下对供P量逐渐降低直至胁迫程度的一种响应机制[17]。该响应很有可能和根系的细胞分裂素分泌有关[6]。Güsewell和Bollens[18]对4种草本植物的研究结果显示:在中、高N+P供给总量的情况下根系生物量均随着N∶P供给比例的提高而增加,但是在低供养总量时根系生物量和N∶P供给比例间呈反比。也许试验一中N+P的供给总量(60 mg/株)对于长白落叶松苗木来说属于中等偏高水平。细根形态方面,本研究中根系生长结果表明,当N∶P供给比例较小时,根系主要通过增加新生根系数量提高吸收效率;当供给比例较高时,根系主要通过直径的变粗和变长提高觅养效率(表1)。当N∶P供给比例较低时,N供给相对不足,新生根系数量的增加可能是对此的一种响应机制以攫取更多的N素资源;当N∶P供给比例较高时,虽然N供给相对充足,但是P的相对缺乏可能对根尖细胞分裂素的产生影响更为显著[19-20],因此导致根系变长和变粗以启动觅养响应机制。另外,叶片生物量结果和苗木地上形态结果对N∶P比例响应不显著的根本原因,可能是试验一设计中N∶P梯度范围不够广泛,没有引起显著的细胞分裂素向地上部分的转移。在另外一个相关研究中[18]N∶P供给比例在1.7—135范围内,植物地上部分生长对此产生了显著响应。
3.2 P的吸收和利用
试验一中较低N∶P供给比例时叶片P浓度较高是P供给量提高的结果(图1)。但是由于叶片生物量对N∶P比例响应不显著,P含量(生物量 ×浓度)亦没有产生显著响应(图1)。拟合结果显示当N∶P为0.488时P利用效率最低,且此时P吸收效率亦较低,这说明当N∶P供给比例较低时,虽然P的相对供给量较高,但是长白落叶松苗木对P的吸收和利用效率都没有因此而提高。和1∶2比例相比,更高比例的N∶P供给下叶片养分亏缺和供P不足有关(图3 A),而根系养分的相对稀释可能源自上文所述的应对相对供养不足而引起的根系生物量增加(图3 B)。综上,在对长白落叶松苗木进行培育的过程中应规避较低或较高的极端N∶P供给比例以防止P吸收利用效率低下或相对供给不足。
3.3 酸性磷酸酶活性
试验一中叶片酸性磷酸酶活性总体上与叶片P浓度间呈负相关关系(Y=-0.0014X+0.2539,R2=0.807),这个结果与对欧洲赤松(Pinus sylvestris L.)新生针叶随供P量下降而变化的趋势类似[21],说明酸性磷酸酶在叶片中的活性的提高主要是对P供给相对不足的一种响应机制。虽然根系P浓度没有对N∶P比例产生显著响应,但是1∶2比例下酸性磷酸酶活性显著高于1∶1比例。产生这种现象的原因可能有:1)根系酸性磷酸酶受缺P诱导而产生,但是这种应急响应并没有引起足够显著的P吸收的反馈;2)根系酸性磷酸酶的产生不仅受根系P的影响,也受到根系N-P的联合作用[21];3)根系酸性磷酸酶的分泌受到了根际微生物的影响[22];4)由较低的P吸收效率(图2)可以推测,本研究使用过磷酸钙作为P供给源可能导致了大量的P素在出苗前淋失。
3.4 不同无机N形态对P吸收的影响
由于本研究试验一中N∶P供给比例差异是由N和P的供给量同时变化而产生,因此试验一无法确切回答不同N素形态对P吸收的影响问题。试验二中,不同N∶P比例下P吸收速率间差异不显著的结果很有可能跟各处理中P浓度不变有关。随着-N∶P比例的增加P吸收速率表现出的升高趋势(图4)说明在根际P浓度不变的情况下-N的增加具有促进P吸收的潜力。类似的,大麦(Hordeum vulgave)[8]和彩萼石楠(Calluna vulgaris)[9]的根系P吸收量被报道过与根际-N浓度间呈正相关关系。Leonce和Miller[7]曾提出假设认为环境-N浓度主要通过提高运送P的载体向木质部释放P离子的速率来提高P的吸收效率。而Humble等[8]则认为N对P吸收的促进作用可能和N中间体合成过程中DPNH或ATP等的周转速率提高有关。笔者认为:可能由于长白落叶松苗木对-N的吸收偏好[11],在pH=6.5的土壤条件下,根系对-N的吸收的同时伴随着H+向根际溶液中反向运输[7],之后随着根外环境中H+浓度的增加,H+向根内流入的电位差也随之增大,同时促进了和H+同向运输的阴离子(H2)流进根内[23]。本研究结果并非特例,Hawkins和Robbions[24]通过微电机离子检测技术发现,在-N环境中花旗松(Pseudotsuga menziesii)苗木可以在pH值为4或7的环境中维持H+流出至根际,同时美国黑松(Pinus contorta)苗木可在pH=7时维持H+流出而大豆(Glycine max)幼苗可在pH=4时维持H+流入根内;严君等[25]也发现-N的添加能显著提高大豆的P吸收效率。相反-N浓度的改变对P吸收无显著影响的结果可以解释为长白落叶松苗木对-N 吸收率较低[11],导致 H+和 H2均没有对-N的供给产生显著响应。另一方面,吸收动力学参数拟合结果表明:-N环境中根系运输P的载体效率高于-N环境(表3),这可能是由于后者与H2竞争运输阴离子的载体所致,也可能由于-N的吸收需要更多的能量代价,影响了能量向ATPase的投入。-N环境中根系对P的亲和力较差可能和溶液中对H2的吸引有关。
3.5 总结与结论
试验一中较高N∶P比例时,N的供给相对充盈而P的供给相对匮乏,长白落叶松苗体内生物量更多的向根系分配,同时根系形态表现出变粗和变长的趋势(表1)以提高觅养效率。然而,根系酸性磷酸酶活性并没有在高N∶P比例下表现出太大的变化(表2),同时P浓度也没有显著提高(图1),因此导致了高N∶P比例下根系P素被稀释的症状(图3 B)。与根系不同,在N∶P供给比例较低的1∶2比例下,叶片P浓度表现出显著优势(图1),导致与之相比的较高N∶P供给比例下苗木出现显著的养分亏缺症状(图3 A)。1∶2比例下叶片酸性磷酸酶活性的显著降低现象(表2),根据前人研究结论[14,21]推测极有可能是此比例下P相对供给充分所致。但是,如上文所述根系P浓度响应并不显著(图1),此情况下叶片P浓度和酸性磷酸酶活性出现的显著响应可能由于部分根系中的P以被分配(或重新分配)至叶片。此推论受叶片光合作用机理的支持,因为P是限制RuBisCo羧化效率最为重要的元素[26]。因此,需要布设短期试验以排除P在苗体内被重新分配的可能。
综上,随着N∶P比例由1∶3提高到3∶1,虽然P的吸收和利用效率会随之增加,但叶片P浓度在N∶P大于1∶2后会有下降的趋势,且根系P的浓度不会产生显著相应。理论上,-N较-N更有利于提高苗木根系中运输P的载体效率,且随着-N∶P比例的提高P的吸收速率有增加趋势。因此,如想在N、P同时存在的情况下提高苗木对P的吸收和利用效率,可考虑适当控制N的硝化并在一定范围内提高N∶P供给比例。
[1] Warren C R.How does P affect photosynthesis and metabolite profiles of Eucalyptus globules?Tree Physiology,2011,31(7):727-739.
[2] Broadley M R,Bowen H C,Cotterill H L,Hammond J P,Meacham M C,Mead A,White P J.Phylogenetic variation in the shoot mineral concentration of angiosperms.Journal of Experimental Botany,2004,55(396):321-336.
[3] Ostertag R.Foliar nitrogen and phosphorus accumulation responses after fertilization:an example from nutrient-limited Hawaiian forests.Plant and Soil,2010,334(1/2):85-98.
[4] Huang W J,Zhou G Y,Liu J X.Nitrogen and phosphorus status and their influence on aboveground production under increasing nitrogen deposition in three successional forests.Acta Oecologica,2011,doi:10.1016/j.actao.2011.06.005.
[5] Du Y X,Pan G X,Li L Q,Hu Z L,Wang X Z.Leaf N/P ratio and nutrient reuse between dominant species and stands:predicting phosphorus deficiencies in Karst ecosystems,southwestern China.Environmental Earth Sciences,2011 64(2):299-309.
[6] Güsewell S.N:P ratios in terrestrial plants:variation and functional significance.New Phytologist,2004,164(2):243-266.
[7] Leonce F S,Miller M H.A physiological effect of nitrogen on phosphorus absorption by corn.Agronomy Journal,1966,58(3):245-249.
[8] Humble G D,Leboudi A E,Rendig V V.Effect of nitrogen on phosphorus absorption by excised barley roots.Plant and Soil,1969,31(2):353-365.
[9] Khade S W,Rodrigues B F,Sharma P K.Arbuscular mycorrhizal status and root phosphatase activities in vegetative Carica papaya L.varieties.Acta Physiologiae Planta,2010,32(3):565-574.
[10] Miller B D,Hawkins B J.Ammonium and nitrate uptake,nitrogen productivity and biomass allocation in interior spruce families with contrasting growth rates and mineral nutrient preconditioning.Tree Phsyiology,2007,27(6):901-909.
[11] Wei H X,Xu C Y,Ma L Y,Jiang L N,Li X L,Yang Z.Dynamic kinetic characteristics of different forms of nitrogen absorbed by Larix olgensis seedling.Plant Nutrition and Fertilizer Science,2010,16(2):407-412.
[12] Zhu J J,Liu Z G,Wang H X,Yan Q L,Fang H Y,Hu L L,Yu L Z.Effects of site preparation on emergence and early establishment of Larix olgensis in montane regions of northeastern China.New Forests,2008,36(3):247-260.
[13] Williams P N,Zhang H,Davison W,Meharg A A,Hossain M,Norton G J,Brammer H,Islam M R.Organic matter-solid phase interactions are critical for predicting arsenic release and plant uptake in bangladesh paddy soils.Environmental Science and Technology,2011,45(14):6080-6087.
[14] Liang X,Liu A Q,Ma X Q,Feng L Z,Chen Y L.The effect of phosphorus deficiency stress on activities of acid phosphatase in different clones of Chinese fir.Acta Phytoecologica Sinica,2005,29(1):54-59.
[15] Hawkins B J.Family variation in nutritional and growth traits in Douglas-fir seedlings.Tree Physiology,2007,27(6):911-919.
[16] Salifu K F,Timmer V R.Optimizing nitrogen loading of Picea mariana seedlings during nursery culture.Canadian Journal of Forest Research,2003,33(7):1287-1294.
[17] Kronzucker H J,Siddiqi M Y,Glass A D M.Kinetics of NH+4influx in spruce.Plant Physiology,1996,110(3):773-779.
[18] Güsewell S,Bollens U.Composition of plant species mixtures grown at various N ∶P ratios and levels of nutrient supply.Basic and Applied Ecology,2003,4(5):453-466.
[19] Forde B G.The role of long-distance signaling in plant responses to nitrate and other nutrients.Journal of Experimental Botany,2002,53(366):39-43.
[20] Falkengren-Grerup U.Nitrogen response of herbs and graminoids in experiments with simulated acid soil solution.Environmental Pollution,1998,102(1):93-99.
[21] Kolari K K,Sarjala T.Acid phosphatase activity and phosphorus nutrition in Scots pine needles.Tree Physiology,1995,15(11):747-752.
[22] Olde Venterink H.Legumes have a higher root phosphatase activity than other forbs,particularly under low inorganic P and N supply.Plant and Soil,2011,347(1/2):137-146.
[23] Marschner H.Mineral Nutrition of Higher Plants.2nd ed.London:Academic Press,2002:889-889.
[24] Hawkins B J,Robbins S.pH affects ammonium,nitrate and proton fluxes in the apical region of conifer and soybean roots.Physiologia Plantarum,2010,138(2):238-247.
[25] Yan J,Han X Z,Zu W.Effects of Nitrogen forms on root morphology and phosphorous efficiency in soybean(Glycine max L.).Soybean Science,2010,29(6):1003-1007.
[26] Warren C R,Livingston N J,Turpin D H.Photosynthetic responses and N allocation in Douglas-fir needles following a brief pulse of nutrients.Tree Physiology 2004,24(6):601-608.
参考文献:
[11] 魏红旭,徐程扬,马履一,江俐妮,李雪莲,杨卓.长白落叶松幼苗对铵态氮和硝态氮吸收的动力学特征.植物营养与肥料学报,2010,16(2):407-412.
[14] 梁霞,刘爱琴,马祥庆,冯丽贞,陈友力.磷胁迫对不同杉木无性系酸性磷酸酶活性的影响.植物生态学报,2005,29(1):54-59.
[25] 严君,韩晓增,祖伟.不同形态氮肥对大豆根系形态及磷效率的影响.大豆科学,2010,29(6):1003-1007.

