外源NO对镉胁迫下水稻幼苗抗氧化系统和微量元素积累的影响
朱涵毅,陈益军,劳佳丽,沈 梁,李菲菲,米 兰,王慧中,薛大伟
(杭州师范大学生命与环境科学学院,杭州 310036)
镉(Cd)是重要的工业和环境污染物,也是毒性最强的重金属之一,极易被植物吸收并积累,超过一定限度时严重影响作物的产量和品质,进而严重威胁人类健康。作物生长在有毒重金属污染的土壤上,其生长发育将受到严重抑制。Cd对植物的毒害,在形态上主要表现为根、茎生长迟缓和叶片失绿、卷曲;生理生化方面多表现为光合作用和蒸腾作用受到抑制,引起氧化胁迫和膜的损伤等[1]。现已明确,Cd对水稻的毒害主要有:阻碍水稻根系生长、影响种子萌发及植株生长,最终导致生物量和产量的下降;在生理上造成氧化胁迫以及叶绿素、糖类、蛋白质等大分子合成受阻,体内养分失调及其它一系列生理代谢紊乱[2]。Cd还可能通过影响水稻细胞质膜的透性从而影响一些营养元素的吸收和积累,导致植株和籽粒中营养元素和成分的改变[3]。Cd被认为是南方土壤污染中常见的重金属元素,一般土壤中的Cd含量己超过土壤正常值。因此,研究Cd对农作物,尤其是对水稻的影响,成为研究重金属污染的热点。
一氧化氮(Nitric Oxide,NO)广泛存在于植物组织中,是植物体内一种重要的氧化还原信号分子,属于活性氮范畴。NO参与植物种子萌发、生长发育、光形态建成、衰老等一系列生理过程[4-6]。近年来的研究表明,NO作为植物体内的一种活性信号因子,还参与了植物对各种胁迫的应答[7-9]。研究发现,0.1和1 mmol/L SNP(硝普钠,一氧化氮供体)处理能显著增强小麦幼苗SOD和CAT活性,降低由NaCl处理引起的小麦叶片氧化损伤。NO能有效缓解Cu对水稻的毒害效应[10]。NO还能通过提高盐胁迫下芦苇愈伤组织中质膜H+-ATPase的表达和活性,进而提高组织中K+/Na+而提高抗盐性[11]。Wang和Yang研究发现NO能显著缓解Al对决明子的毒害[12],NO预处理能显著缓解Al对植株生长的抑制,减少Al胁迫引起的脂质过氧化和ROS的积累。刘建新等研究发现[13],外源NO通过提高Cd胁迫下植株体内的SOD、APX、CAT活性及GSH含量,来增强活性氧的清除能力,保护由Cd胁迫引起的黑麦草幼苗叶片光合机构的破坏,缓解Cd胁迫对幼苗生长的抑制作用。Besson-Bard等通过对Cd胁迫下拟南芥基因差异表达分析发现,NO可能通过诱导根部IRTI基因的上调表达,使Cd大量截留在根部,减少地上部Cd的积累从而缓解Cd毒害,说明NO参与了Cd胁迫下植物对重金属离子的吸收与转移。目前NO缓解Cd对水稻毒害的研究特别是对微量元素积累的影响研究较少,因此本研究以两个基因型水稻幼苗为实验材料,通过对其生长状况、抗氧化酶系活性、Cd和3种微量元素的含量进行分析,研究外源NO对Cd胁迫下水稻幼苗的抗性和生理生化机制,以期为Cd污染治理和水稻的重金属Cd抗性研究提供理论参考。
1 材料与方法
1.1 供试材料
供试材料为籼稻品种ZF802和粳稻品种ZH11,浸种后催芽3 d,转入沙盒培养,采用1/2国际水稻所营养液配方[14]浇灌。长至3叶期转入水培箱中培养,并进行处理。
1.2 试验设计
每个品种设置3个处理:对照组(采用国际水稻所营养液配方进行培养)、100 μmol/L Cd2+和100 μmol/L Cd2++1.5 mmol/L SNP。3组分别用CK、Cd、Cd+1.5SNP表示。营养液每3 d更换1次,实验重复3次。培养3周后对水稻根和叶的各项指标进行测定。
1.3 测定方法
处理3周后取植株样,根系在乙二胺四乙酸二钠溶液中(20 mmol/L)浸泡3 h去除表面粘附的离子,再用蒸馏水洗净,分别测量株高和根长,并将地上部和根系分开,杀青后,80℃恒温烘干,用原子吸收光谱仪(AA6300,Shimadzu,Tokyo,Japan)分析 Cd和微量元素[15]。
丙二醛(MDA)含量测定采用硫代巴比妥酸分光光度法[16];抗氧化酶活性测定参照张宪政介绍的方法[17],并略加改动(主要增加95%乙醇二次洗涤过程,提高纯度)。超氧化物歧化酶(SOD)活性测定采用氯化硝基四氮唑蓝(NBT)光化还原法[18];过氧化物酶(POD)活性测定采用愈创木酚氧化法。用SHIMADZU UV-2410PC分光光度计酶动力学软件测定吸光度的变化。
1.4 数据分析
利用Excel软件进行数据的分类汇总,用SPSS15.0软件进行数据分析及差异显著性检验。
2 结果与分析
2.1 外源NO对镉胁迫下水稻幼苗根长和株高的影响
水稻幼苗根系在100 μmol/L Cd2+处理7 d后呈现棕黄色,14 d后变褐色并逐渐坏死。叶尖在处理10 d后逐步失绿,14 d后叶尖呈现褐色的坏死斑,叶色变黄,植株生长矮小,两个基因型水稻在Cd2+胁迫下根长和株高均明显下降(图1)。添加1.5 mmol/LSNP有效缓解了水稻幼苗Cd毒害的症状,两个基因型的株高和根长均比Cd处理下显著提高,基本恢复到对照水平,其中籼稻ZF802的根长甚至超过了对照。
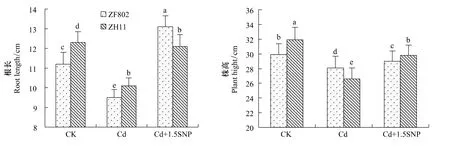
图1 Cd胁迫下外源NO对水稻幼苗根长株高的影响Fig.1 Effect of exogenous NO on the roots length and the plant height of the rice seedlings under Cd stress
2.2 外源NO对不同基因型水稻Cd积累的影响
与野生型对比可以发现,Cd处理下两种水稻幼苗地上部Cd含量均有显著提高,通过施加外源1.5 mmol/L SNP后发现,NO对两种水稻品种地上部和根部Cd积累量影响差异较大。ZF802地上部在施加SNP后,Cd含量会明显降低;而ZH11则略有升高(图2)。而在根部情况相反,外源SNP显著降低了ZH11根部的Cd含量,却提高ZF802的根部Cd含量(图2),存在基因型差异。
2.3 外源NO对不同基因型水稻微量元素积累的影响
Cd处理显著影响了植株对微量元素的吸收和分配,且存在一定的基因型差异。Cd处理下,ZF802和ZH11地上部Mn和Zn含量较对照下降,特别是ZF802地上部的Mn含量比对照下降了64.5%;但在Cd处理下,ZF802地上部Cu含量较对照增加,而ZH11的Cu含量却比对照下降了34.9%(图3)。
而在根部中,两个基因型Zn、Mn、Cu含量在Cd处理下变化更具差异,ZF802根部Mn、Cu含量比对照均下降,而Zn含量显著升高;但ZH11恰恰相反,根部Mn、Cu含量比对照均增加,而Zn含量则下降(图4)。外源NO的添加使ZF802地上部Zn、Cu的含量降低,Mn含量升高;而ZH11地上部Zn、Cu含量在添加外源NO后比Cd处理有所升高,Mn含量下降(图3)。在根部中,除Cu外,施加外源NO后,两个基因型的Mn、Zn含量均较Cd处理显著下降,ZF802和ZH11的Zn含量分别较Cd处理下降了43.7%和37.7%;添加SNP后,ZF802根部的Cu含量显著上升,但ZH11的Cu含量却显著下降,具有明显的基因型差异。

图2 外源NO对水稻幼苗地上部分和根部Cd含量的影响Fig.2 Effect of exogenous NO on Cd content in the shoot and the root of rice seedlings under Cd stress
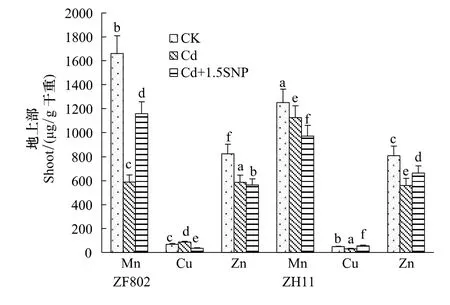
图3 外源NO对水稻幼苗地上部微量元素含量的影响Fig.3 Effect of exogenous NO on microelements content in the shoot of rice seedlings under Cd stress

图4 外源NO对水稻幼苗根部微量元素含量的影响Fig.4 Effect of exogenous NO on microelements content in the root of rice seedlings under Cd stress
2.4 镉胁迫下外源NO对抗氧化酶系统的影响
SOD是植物体内清除氧自由基的一种重要的保护酶。两个基因型在处理之间SOD活性的变化存在显著的差异,Cd处理3周后,ZF802的SOD活性比对照略低,而加入外源SNP与Cd处理相比SOD活性也基本没有变化,但是ZH11在Cd处理下,SOD活性显著上升,加入外源SNP后,SOD活性与Cd处理相比下降(图5)。总体上ZH11的SOD活性高于ZF802,能有效地清除自由基,说明SNP能缓解Cd毒害引起的氧化胁迫。从图6中可以看出,两个基因型叶片POD活性在Cd胁迫下均显著上升。添加外源SNP后,两个基因型叶片POD活性较Cd处理有所下降,基本能恢复到对照水平,这也说明了SNP可以缓解Cd胁迫下水稻体内的氧化胁迫。
2.5 镉胁迫下外源NO对丙二醛含量的影响
植物器官在逆境条件下会发生脂膜过氧化作用,丙二醛是脂膜过氧化作用的最终产物之一,也是膜系统受害的重要指标之一,可用于表示细胞脂膜过氧化程度和植物对逆境条件反应的强弱。图7反映了Cd胁迫下两个基因型的MDA含量,结果表明,Cd胁迫3周后,二者的叶片MDA含量均上升,其中ZF802上升较ZH11显著,说明细胞膜伤害较严重。而添加外源NO后,两个基因型叶片的MDA含量均回落,ZF802叶片的MDA含量比Cd处理下降了36.5%,但仍高于对照;而ZH11的MDA含量比Cd处理下降了22.5%,甚至略低于对照水平。这也说明NO在缓解Cd胁迫下植物细胞脂膜过氧化过程中具有重要作用,同时不同基因型间具有明显的差异。
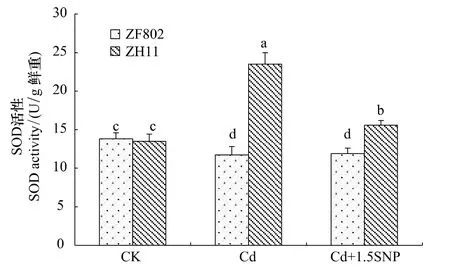
图5 Cd胁迫下外源NO对水稻幼苗SOD活性的影响Fig.5 Effect of exogenous NO on activity of SOD in rice seedlings under Cd stress

图6 Cd胁迫下外源NO对水稻幼苗POD活性的影响Fig.6 Effect of exogenous NO on activity of POD in rice seedlings under Cd stress
3 讨论
Cd是目前对农作物毒害最普遍的重金属之一,Cd胁迫对植物的伤害是多方面的。它能诱导活性氧的产生,导致膜质过氧化和生物大分子的损伤,从而使光合作用等生理过程发生紊乱,抑制植株的生长。本实验结果表明,不同基因型水稻在Cd胁迫下根长和株高均受到抑制,水稻生长发育受影响,与前人结果相同。NO是植物体内的一种重要的活性信号因子,可参与植物对各种胁迫的应答。SNP是一种最常用的外源NO供体,研究表明,0.5 mmol/L SNP 大约可释放 2.0 μmol/L 的NO。Laspina等发现SNP处理可以显著缓解Cd胁迫对向日葵幼苗生长的抑制,提高了向日葵抗Cd胁迫的能力[19]。本研究发现通过施加外源NO供体SNP可以缓解Cd胁迫对水稻幼苗生长的抑制。
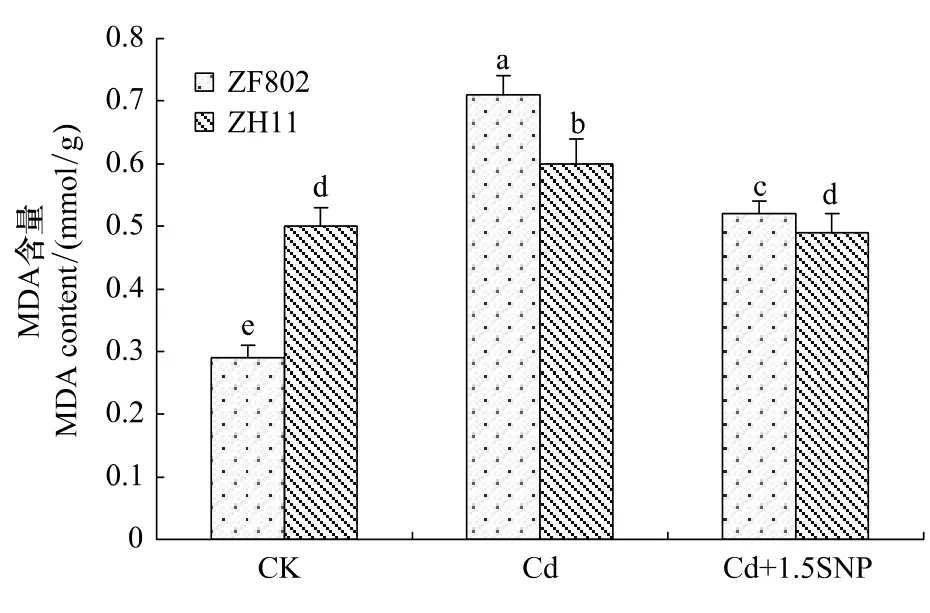
图7 Cd胁迫下外源NO对水稻幼苗丙二醛含量的影响Fig.7 Effect of exogenous NO on MDA content in rice seedlings under Cd stress
逆境胁迫对植物的伤害是多方面的,其中膜系统是植物受伤害的敏感部位和原初位点。逆境首先引起植物离子失衡和高渗胁迫,并导致包括氧化伤害的次生胁迫,例如各种活性氧(ROS)的积累,导致膜结构完整性的破坏,叶绿素降解、蛋白质变性、核酸断裂,甚至细胞死亡。植物体内SOD、POD等抗氧化酶活性对维持膜结构完整性和防御活性氧自由基对膜的攻击有重要作用[20],SOD和POD共同作用可将H2O2转化为H2O,使自由基维持在一个较低水平,从而避免膜伤害。酶活性测定结果表明,Cd胁迫下诱导两个基因型叶片POD显著上升(图6),说明Cd胁迫诱导抗氧化酶活性增强,从而清除自由基,阻止植物体内ROS的积累。但Cd处理后两个基因型SOD活性表现差异显著,其中ZH11叶片SOD活性显著增强,而ZF802叶片SOD活性在处理3周后下降,这可能是由于Cd胁迫时间过长,导致ZF802的叶片保护酶系统的崩溃,而ZH11对Cd耐性较强,叶片保护酶系统破坏较小。已有大量报道表明外源NO能够起到缓解重金属胁迫的作用[21],但其解毒机制一直未明确。现在主要认为是由于外源NO通过减少氧化胁迫来缓解重金属毒害。Tewari等研究表明外源NO能够缓解Cu毒害引起的人参不定根中产生的氧化胁迫[22],Wang等的研究也表明外源NO是通过缓解氧化胁迫来降低Al对肉桂根系的毒害作用。而对于外源NO缓解氧化胁迫的机理目前主要存在两种观点。Kopyra和Gwóz'dz'认为外源NO的这种抗氧化胁迫是通过直接清除ROS来实现的[23],刘建新等人认为NO的抗氧化胁迫能力并非直接参与ROS的清除,而是提高了抗氧化酶系的活性,这与Jiang等[24]和胡向阳等[25]的观点一致。本研究表明,加入外源SNP后,两个基因型叶片中的SOD和POD活性均下降,NO可以作为抗氧化剂直接清除体内积累的ROS,使Cd胁迫下活性增强的酶活性下降。
植物在逆境胁迫下,活性氧的过量积累会引起膜脂过氧化,破坏细胞膜系统稳定和完整,进而导致植物细胞结构的损伤[26]。本研究也发现,Cd处理使水稻幼苗叶片MDA含量升高,特别是ZF802细胞膜伤害更加严重。MDA含量增加到一定程度的时候可能对抗氧化酶活性有一定的影响,从实验结果中可以发现,在Cd处理3周后,MDA的积累很高的ZF802,SOD的活性受到抑制而有所下降(图5,图7),而POD的活性增强(图6),也就是说高度积累的MDA对于SOD的活性起抑制作用,而对于POD活性并没有大的抑制作用。施加外源SNP后,两个基因型叶片的MDA含量比Cd处理下明显下降,说明NO在缓解Cd胁迫下植物细胞脂膜过氧化过程中具有重要作用,与前人在小麦中的研究一致[27]。
通过化学调控手段缓解Cd毒害,是降低作物对Cd吸收与积累是作物安全生产的重要手段。前人的研究表明,NO参与了Cd胁迫下植物对重金属离子的吸收与转移,通过诱导基因表达,使Cd积累在根部,从而缓解地上部的Cd毒害。本研究发现籼稻品种ZF802与前人的研究相符,Cd胁迫下地上部和地下部Cd含量均增加,施加外源NO后,地上部Cd含量下降,根部含量增加。但是粳稻品种ZH11却相反,施加外源SNP后,地上部Cd含量略有升高,而在根部Cd含量却降低(图2),说明NO的施加促使ZH11中的Cd含量从根部更多的转移到了地上部。这也说明Cd在水稻的体内转移和分配机制比较复杂,有待于进一步研究。Cd作为一种重金属离子,在植物体内可能与必需营养元素竞争根部的吸收位点,也可能通过影响植物对养分的吸收,从而影响植物的正常生长[28]。本研究中,Cd胁迫下3种微量元素在根部和地上部的分布存在基因型差异。Cd的存在抑制了ZH11根部对Zn的吸收,增加了对Mn和Cu的积累,但ZF802却情况相反,根部Zn含量上升。地上部Cu的含量也存在基因型差异。目前对于Cd胁迫影响植物对微量元素的吸收有一些研究,但是得出的结论很不一致[29-30],有些研究认为Cd对微量元素的影响是通过协同作用[31],而有的认为是通过拮抗作用[32]。本研究表明,Cd对Zn、Mn、Cu等微量元素吸收的影响存在基因型差异,与张国平等在小麦上的结果一致[33]。外源SNP能减少Cd胁迫下两个基因型根部对Zn、Mn的积累,但是对根部Cu的积累和地上部3中微量元素含量的影响却存在基因型差异。这也说明水稻中NO对Cd处理下微量元素吸收的影响存在基因型差异,且机制比较复杂,需进一步探讨。
[1] Di Toppi L S,Gabbrielli R.Response to cadmium in higher plants.Environmental and Experimental Botany,1999,41(2):105-130.
[2] Wu F B,Dong J,Jia G X,Zheng S J,Zhang G P.Genotypic difference in the responses of seedling growth and Cd toxicity in rice(Oryza sativa L.).Agricultural Sciences in China,2006,5(1):68-76.
[3] Liu J G,Liang J S,Li K Q,Zhang Z J,Yu B Y,Lu X L,Yang J C,Zhu Q S.Correlations between cadmium and mineral nutrients in absorption and accumulation in various genotypes of rice under cadmium stress.Chemosphere,2003,52(9):1467-1473.
[4] Besson-Bard A,Gravot A,Richaud P,Auroy P,Duc C,Gaymard F,Taconnat L,Renou J P,Pugin A,Wendehenne D.Nitric oxide contributes to cadmium toxicity in arabidopsis by promoting cadmium accumulation in roots and by up-regulating genes related to iron uptake.Plant Physiology,2009,149(3):1302-1315.
[5] Brennan T,Frenkel C.Involvement of hydrogen peroxide in the regulation of senescence in pear.Plant Physiology,1977,59(3):411-416.
[6] Li H Y,Li C G,Guan L J,Shao S.Effect of nitric oxide(NO)on heat-shock-induced chilling tolerance in maize seedlings.Jiangsu Journal of Agricultural Sciences,2009,25(3):503-507.
[7] Delledonne M,Xia Y J,Dixon R A,Lamb C.Nitric oxide functions as a signal in plant disease resistance.Nature,1998,394(6693):585-588.
[8] Beligni M V,Lamattina L.Nitric oxide:a non-traditional regulator of plant growth.Trends in Plant Science,2001,6(11):508-509.
[9] Beligini M V,Lamattina L.Nitric oxide counteracts cytotoxic processes mediated by reactive oxygen species in plant tissues.Planta,1999,208(3):337-334.
[10] Singh H P,Batish D R,Kaur G,Arora K,Kohli R K.Nitric oxide(as sodium nitroprusside)supplementation ameliorates Cd toxicity in hydroponically grown wheat roots.Environmental and Experimental Botany,2008,63(1/3):158-167.
[11] Zhao L Q,Zhang F,Guo J K,Yang Y L,Li B B,Zhang L X.Nitric oxide functions as a signal in salt resistance in the calluses from two ecotypes of reed.Plant Physiology,2004,134(2):849-857.
[12] Wang Y S,Yang Z M.Nitric oxide reduces aluminum toxicity by Preventing oxidative stress in the roots of Cassia tora L.Plant and Cell Physiology,2005,46(12):1915-1923.
[13] Liu J X,Hu H B,Wang X.Effects of an exogenous nitric oxide donor on active oxygen metabolism,photosynthesis and the xanthophyll cycle in Ryegrass(Lolium perenne L.)seedlings under cadmium stress.Acta Scientiae Circumstantiae,2009,29(3):626-633.
[14] Yoshida S,Forna D A,Cock J H,Gomez K A.Laboratory manual for physiological studies of rice//International Rice Research Institute.Los Baños:Philippines,1976:62-63.
[15] Xue D W,Chen M C,Zhang G P.Mapping of QTLs associated with cadmium tolerance and accumulation during seedling stage in rice(Oryza sativa L.).Euphytica,2009,165(3):587-596.
[16] Zhang X Q,Wu K L,Xue D W.Effects of waterlogging stress on antioxidative enzyme system in different barley genotypes.Journal of Zhejiang University:Agriculture and Life Sciences,2009,35(3):315-320.
[17] Zhang X Z,Tan G R,Huang Y J,Song Y H.Experimental Techniques of Plant Physiology.Shenyang:Liaoning Science and Technology Publishing House,1989:107-108.
[18] Zheng D F,Zhao L M,Ma N J.Effects of plant growth regulators(PGRs)on endogenous hormone contents and activities of protective enzymes in soybean leaves.Acta Agronomica Sinica,2008,34(7):1233-1239.
[19] Laspina N V,Groppa M D,Tomaro M L,Tomaro M P,Benavides.Nitric oxide protects sunflower leaves against Cd induced oxidative stress.Plant Science,2005,169(2):323-330.
[20] Baisak R,Rana D,Acharya P B B,Kar M.Alterations in the activities of active oxygen scavenging enzymes of wheat leaves subjected to water stress.Plant and Cell Physiology,1994,35(3):489-495.
[21] Sandalio L M,Dalurzo H C,Gómez M,Romero-Puertas M C,Del Río L A.Cadmium-induced changes in the growth and oxidative metabolism of pea plants.Journal of Experimental Botany,2001,52(364):2115-2126.
[22] Tewari R K,Hahn E J,Paek K Y.Modulation of copper toxicity-induced oxidative damage by nitric oxide supply in the adventitious roots of Panax ginseng.Plant Cell Reports,2008,27(1):17-181.
[23] Kopyra M,Gwóz'dz'E A.Nitric oxide stimulates seed germination and counteracts the Inhibitory effect of heavy metals and salinity on root growth of Lupinus luteus.Plant Physiology and Biochemistry,2003,441(11/12):1011-1017.
[24] Jiang M Y,Zhang J H.Effect of abscisic acid on active oxygen species,antioxidative defence system and oxidative damage in leaves of maize seedlings.Plant and Cell Physiology,2001,42(11):1265-1273.
[25] Hu X Y,Cai W M.Nitric oxide and elicitor-induced plant defense responses.Chinese Bulletin of Life Sciences,2005,17(2):176-182.
[26] Lin C C,Kao C H.Effect of NaCl stress on H2O2metabolism in rice leaves.Plant Growth Regulation,2000,30(2):151-155.
[27] Zheng C F,Jiang D,Dai T B,Jing Q,Cao W X.Effects nitroprusside,a nitric oxide donor,on carbon and nitrogen metabolism and the activity of the antioxidation system in wheat seedings under salt stress.Acta Ecologica Sinica,2010,30(5):1174-1183.
[28] Tu C,Zheng C R,Chen H M.Advances on interaction of heavy metals and nutrient elements in soil plant system.China Environmental Science,1997,17(6):526-529.
[29] Bjerre G K,Schierup H H.Uptake of six heavy metals by oat as influenced by soil type and additions of cadmium,lead,zinc and copper.Plant and Soil,1985,88(1):57-69.
[30] Guo Z,Huang S Z,Yuan H Y.Effects of Cd stress on the development,Cd accumulation and microelements absorption of two species of Iris.Ecology and Environment,2008,17(2):651-656.
[31] Smith G C,Brennan E G.Cadmium-zinc interrelationship in tomato plants.Phytopathology,1983,73:8679-882.
[32] Oliver D P,Hannam R,Tiller K G,Wilhelm N S,Merry R H,Cozens G D.The effect of Zinc fertilization on cadmium concentration in wheat grain.Journal of Environmental Quality,1994,23:705-711.
[33] Zhang G P,Fukami M,Guan B G.Difference between two wheat cultivars in Cd and mineral nutrient uptake under different Cd levels.Chinese Journal of Applied Ecology,2002,13(4):454-458.
参考文献:
[6] 李海燕,李春光,关丽杰,邵双.一氧化氮对热激诱导玉米幼苗耐冷性的影响.江苏农业学报,2009,25(3):503-507.
[13] 刘建新,胡浩斌,王鑫.外源一氧化氮供体对镉胁迫下黑麦草幼苗活性氧代谢、光合作用和叶黄素循环的影响.环境科学学报,2009,29(3):626-633.
[16] 张晓勤,吴克利,薛大伟.湿害对不同大麦基因型抗氧化酶系统的影响.浙江大学学报:农业与生命科学版,2009,35(3):315-320.
[17] 张宪政,谭桂茹,黄元极,宋玉华.植物生理学实验技术.沈阳:辽宁科学技术出版社,1989:107-108.
[18] 郑殿峰,赵黎明,冯乃杰.植物生长调节剂对大豆叶片内源激素含量及保护酶活性的影响.作物学报,2008,34(7):1233-1239.
[25] 胡向阳,蔡伟明.一氧化氮与激发子诱导的植物抗病防卫反应.生命科学,2005,17(2):176-182.
[27] 郑春芳,姜东,戴廷波,荆奇,曹卫星.外源一氧化氮供体硝普钠浸种对盐胁迫下小麦幼苗碳氮代谢及抗氧化系统的影响.生态学报,2010,30(5):1174-1183.
[28] 涂从,郑春荣,陈怀满.土壤-植物系统中重金属与养分元素交互作用.中国环境科学,1997,17(6):526-529.
[30] 郭智,黄苏珍,原海燕.Cd胁迫对马蔺和鸢尾幼苗生长、Cd积累及微量元素吸收的影响.生态环境,2008,17(2):651-656.
[33] 张国平,深见元弘,关本根.不同镉水平下小麦对镉及矿质养分吸收和积累的品种间差异.应用生态学报,2002,13(4):454-458.

