2005年夏季东太平洋中国多金属结核区小型底栖生物研究
王小谷 ,周亚东,张东声,洪丽莎,王春生
(1.国家海洋局第二海洋研究所,杭州 310012;2.国家海洋局海洋生态系统与生物地球化学重点实验室,杭州 310012)
东北太平洋海底蕴藏大量多金属结核,其主要存在于热带东北太平洋克拉里昂一克里帕顿断裂带(Clarion-Clipperton Fracture Zones,CCFZ)的表层沉积物中间,结核覆盖面积超过50%[1-2]。20世纪70年代开始,多国为了获取结核区巨大的矿产资源,开始在该区进行大面积的勘探[3-4],我国从20世纪80年代末期开始,对位于CCFZ的多金属结核以及沉积物进行了多年调查,现已在CCFZ区获得7.5万km2的专属开辟区—中国多金属结核区合同区(The COMRA's Contract Area)。
小型底栖生物作为底栖生态系统的重要组成部分,是构成底栖食物网的基本环节,对整个底栖群落(种类,密度,新陈代谢)作出巨大贡献[5-7]。多年来,人们对近岸、陆架以及深海边缘的小型底栖生物已经进行了广泛的研究[8-15]。从20世纪70年代开始,基于采矿势必给深海生物及环境带来破坏的共同认识[16-20],国际上为了控制和减轻采矿所带来的影响,保护矿区生物多样性,开始在CCFZ进行深海环境及生物基线的调查,并取得了一定成果[21-28]。目前我国仅高爱根,杨俊毅等[29-30]对我国多金属结核合同区的小型底栖生物进行过研究。本项研究的主要目的是加深对结核区小型底栖生物的认识,评估小型底栖生物的群落组成,密度,生物量以及分布特征,以便将来采矿后对海洋环境的持续管理。
1 材料和方法
1.1 调查区域和站位
研究样品由“大洋一号”调查船于2005年夏季采自东太平洋中国多金属结核开辟区东、西两小区 (以下简称东、西小区)内(图1),东、西两小区各设6个采样站位,具体站位经纬度及深度见表1。

图1 研究海域图Fig.1 Map of the study area

表1 中国多金属结核区小型底栖生物采样站位及深度Table 1 Locations and depth of sampling stations
1.2 采样及样品处理
小型底栖生物样品使用MCS-1型沉积物多管取样器采集,每根取样管长61 cm,内径9.5 cm,每站取2根取样管样品进行小型底栖生物分样。每根样现场处理如下:(1)将上覆水虹吸入32 μm孔径的网筛,滤取其中的小型底栖动物,(2)用分样器把每根样按0—1 cm、1—2 cm、2—4 cm和4—6 cm分层装瓶,上覆水滤样与0—1 cm层合装一瓶,用7%的中性福尔马林溶液固定。回实验室后样品经250μm,125μm,63μm,38μm孔径的网筛过滤后,采用改进后的ludox离心法进行离心分选[31],虎红染色后在显微镜下鉴定并计数。
小型底栖生物生物量的测定步骤:
(1)在显微镜下利用Leica QWin软件测量生物体最大体宽和体长(线虫包括细尾),并由公式计算体积:
V=L×W2×C
式中,L为体长(mm),W为直径(mm),系数C。
(2)体积V到湿重生物量(g)的换算系数为1.13,湿重生物量到干重乘以系数0.25[32]。另取一根芯样按0—1 cm、1—2 cm、2—4 cm和4—6 cm分层,分取现场参数测定子样,叶绿素和脱镁叶绿素现场采用唐纳荧光法进行测定[33]。沉积物中微型生物的生物量用ATP法(三磷酸腺苷)测定计算[34-35]。
1.3 数据处理
小型底栖生物密度和生物量分布图采用Surfer8.0软件绘制。小型底栖生物密度和生物量与环境因子相关性分析使用primer 6.0软件。
2 结果
2.1 沉积物叶绿素a和脱镁叶绿素的水平分布
中国开辟区东小区和西小区沉积物(0—6cm)叶绿素a含量极低,变化范围为0.001—0.007 μg/cm2,平均值为 0.003 μg/cm2,其中东小区沉积物叶绿素 a 平均值为 0.004 μg/cm2,西小区为 0.002 μg/cm2;东、西小区沉积物(0—6cm)脱镁叶绿素变化范围为 0.074—0.199 μg/cm2,平均值为 0.125 μg/cm2,其中东小区沉积物脱镁叶绿素平均值为 0.169 μg/cm2,西小区为 0.082 μg/cm2。
中国开辟区东区和西区之间的沉积物叶绿素含量显然有所差异,东小区沉积物叶绿素a含量、脱镁叶绿素含量均高于西小区(图2),表明上层水体有机碎屑沉降于两个区域的通量是不同的。

图2 各站位沉积物(0—6cm)叶绿素和脱镁叶绿素Fig.2 Top 6cm sediment Chl-a and Phl-a of the survey stations
2.2 沉积物微型生物生物量水平分布
中国开辟区东小区和西小区沉积物(0—6 cm)微型生物生物量变化范围为 0.043—0.477 μg/cm2,平均值为0.163 μg/cm2,其中东小区沉积物叶绿素a平均值为 0.252 μg/cm2,西小区为0.074 μg/cm2。中国开辟区东小区沉积物微型生物生物量明显高于西小区(图3)。

图3 各站位沉积物(0—6 cm)微型生物生物量Fig.3 Top 6cm sediment microbial biomass of the survey stations
2.3 小型底栖生物类群组成
调查海域共有13个类群的小型底栖生物,其中东小区11类,西小区12类。包括线虫(Nematoda)、腹毛类(Gastrotricha)、动 吻 类 (Kinorhyncha)、多 毛 类(Polychaeta)、寡毛类(Oligochaeta)、介形类(Ostracoda)、桡足类(绝大部分为猛水蚤 Harpacticoida)、等足类(Isopoda)、缓步类(Tardigrada)、蜱螨类(Acari)、双壳类(Bivalvia)、铠甲类(Loricifera)、其他未鉴定种类(Other)。其中海洋线虫为绝对优势类群,其他较为重要的类群有底栖桡足类,多毛类,介形类等。东、西两小区小型底栖生物主要类群的密度见表2。
2.4 小型底栖生物密度和生物量水平分布
调查海域东、西两小区小型底栖生物平均密度分别为(104.4±20.48)个/10 cm2,(40.26±25.84)个/10 cm2,密度占前五位的的类群依次为线虫、桡足类、多毛类、介型类和缓步类。东小区最高密度值出现在ES0506站,为137.55个/10 cm2,最低密度出现在ES0504站,为84.65个/10 cm2;西小区最高密度值出现在WS0502站,为90.15个/10 cm2,最低密度出现在WS0504,为17.35个/10 cm2。线虫是小型底栖生物中的绝对优势种,东、西两小区平均密度分别为(97.23±19.51)个/10 cm2和(36.78±25.08)个/10 cm2;桡足类东、西两小区平均密度分别为(4.21±1.05)个/10 cm2和(2.08±0.82)个/10 cm2,东小区最高值出现在 ES0503站,为5.50个/10 cm2,最低值出现在ES0502站,为2.82个/10 cm2;西小区最高值出现在WS0502,为3.1个/10 cm2,最低值出现在WS0504,为0.85个/10 cm2。多毛类在东小区平均密度较高,有(1.03±0.39)个/10 cm2,而在西小区平均密度仅有0.14个/10 cm2(图4)。

表2 东、西小区小型底栖生物各类群平均密度Table 2 Abundanc of meiofaunal groups and nematode biomass
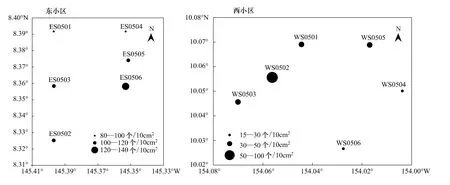
图4 小型底栖生物密度水平分布Fig.4 horizontal distribution of the abundance of meiofauna
调查海域东、西两小区线虫平均生物量分别为(5.25±0.99)μg干重/10 cm2和(1.68±0.77)μg干重 /10cm2。东小区线虫最高生物量出现在ES0506站,为6.57μg干重/10cm2,最低生物量出现在ES0504站,仅为3.86 μg干重/10cm2;西小区线虫最高生物量出现在 WS0502,为 3.15 μg干重/10cm2;最低出现在WS0504,为0.96 μg干重/10cm2。深海线虫生物量较近岸低,与其个体小有一定关系。
2.5 小型底栖生物密度垂直分布
中国开辟区小型底栖生物密度的垂直分布趋势为:至表层向底层递减的趋势,小型底栖生物分布集中在沉积物表面0—2 cm层中,占总数的75%以上(图5)。

图5 小型底栖生物垂直分布Fig.5 Vertical distribution of meiofauna abundance
2.6 小型底栖生物密度与环境变量的相关性
对2005年调查中同步测定的小型底栖生物密度,线虫密度,线虫生物量,桡足类密度,多毛类密度分别对各站位的经、纬度(n=12),沉积物叶绿体含量(n=10),沉积物微型生物生物量(n=10)进行相关分析,分析结果见表3。

表3 小型底栖生物密度、生物量与环境因子的相关分析结果Table 3 Correlationanalysis between miofuana abundance,biomass and environmental variables
结果显示:调查区域的小型底栖生物密度,线虫密度,线虫生物量,桡足类密度,多毛类密度与经、纬度呈显著负相关,与脱镁叶绿素呈显著正相关,与沉积物微型生物生物量相关性不显著。小型底栖生物密度,线虫密度,线虫生物量,多毛类密度与叶绿素a呈显著正相关,桡足类与叶绿素a相关性不显著。脱镁叶绿素与沉积物微型生物生物量呈显著正相关。
3 讨论
3.1 深海小型底栖生物密度的影响因子
深海海盆通常食物贫瘠,食物来源主要依靠表层水体中有机碎屑的沉降,有机碎屑沉降通量对深海沉积物中底栖生物密度,生物量高低起着决定性影响。调查结果显示,中国开辟区小型底栖生物密度及线虫生物量与沉积物中叶绿素a和脱镁叶绿素含量均呈显著正相关(表2),这与以往相关研究结果相同[26,36-38]。此外,沉积物特性也对小型底栖生物密度、垂直分布有一定影响,中国开辟区内的沉积物以硅质粘土、硅质软泥和含硅质粘土为主。其中东小区表层沉积物以硅质粘土为主,硅质软泥和含硅质粘土次之,它们分别约占东区面积为70%、26%、4%,沉积物松软[40];西小区表层沉积物硅质软泥含量偏低,占西区的16%,硅质粘土占79%,含硅质粘土占4%,表明东区的沉积物组分更细,更松软,西区沉积物则较东区粗而硬,两区在沉积环境上存在着差异[39]。由于底质颗粒越细越有利于有机物的富集[40-41],底质越松软则越有利于小型底栖生物上下活动,向深层分布,从大面分布来看东区小型底栖生物的密度要高于西区,从垂直分布来看,东区小型底栖生物在深层的分布的比例要比西区的比例大一些。
3.2 与历史资料的比较
由于受到采样技术的限制,历史上对深海的小型底栖生物研究相对近海而言较少,特别是在太平洋CCZ,加之不同的研究运用采样和室内分选的方法有所差异,因此要进行精确比较是相对困难的。从群落结构上来说,各项研究差异性不大,线虫,底栖桡足类,多毛类是小型底栖生物的优势类群,尤其是线虫,为深海小型底栖生物的绝对优势类群[23,42]。
表4记录了国际上关于太平洋CCFZ以及周边深海小型底栖生物的数据,由于沉积物样品的厚度以及研究的重点有所不同(Bown[26]等调查沉积物最表层线虫密度,Renaud-Mornant等对沉积物2.5 cm厚度的线虫进行研究,Snider等[27],A.Miljutina等[25],Kaneko等[28]对沉积物5 cm 厚度的小型底栖生物进行研究),因此只能进行粗略的对比。A.Miljutina等数据显示,CCFZ沉积物表层5 cm线虫平均密度为80个/10 cm2,与本次研究的中国合同区东小区线虫密度((97.23±19.51)个/10 cm2)相仿,但远高于中国合同区西小区的线虫密度((36.78±25.08)个/10 cm2)。总体而言,CCFZ线虫密度要远低于 Mokievskij等[43]2007年所得到的全球深海线虫密度值((196±15)个/10 cm2)。这与CCFZ位于透光层初级生产力很低的中北太平洋寡营养区有直接关系[25]。

表4 本研究与历史资料比较Table 4 Comparison between present study and history data
[1] Smith C R,Demopoulos A W J.The deep pacific ocean floor//Tyler P A,ed.Ecosystems of the Deep Oceans 28.Amsterdam:Elsevier,2003:179-218.
[2] Thistle D.The deep-sea floor:an overview//Tyler P A,ed.Ecosystems of the Deep Ocean Ecosystems of the World 28.Amsterdam:Elsevier,2003:5-37.
[3] Glover A G,Smith C R.The deep-sea floor ecosystem:current status and prospects of anthropogenic change by the year 2025.Environmental Conservation,2003,30(3):219-241.
[4] Thiel H.Anthropogenic impacts on the deep sea//Tyler P A,ed.Ecosystems of the World 28.Amsterdam:Elsevier,2003:427-472.
[5] Gerlach S A.On the importance of marine meiofauna for benthos communities.Oecologia,1971,6(2):176-190.
[6] Heip C,Vincx M,Vranken G.The ecology of marine nematodes.Oceanography and Marine Biology Annual Review,1985,23:399-489.
[7] Coull B C.Long-term variability of meiobenthos:value,synopsis,hypothesis generation and predictive modelling.Hydrobiologia,1986,142(1):271-279.
[8] Zhang Z N,Li Y G,Tu L H,Yu Z S.Preliminary study on the ecology of the benthic meiofauna in the Huanghe river estuary and its adjacent waters.Oceanologia Et Limnologia Sinica,1989,20(3):197-208.
[9] Zhang Z N,Gu F,Yu Z S.A study on spatial pattern of marine nematodes in the subaqueous delta of the Huanghe river.Oceanologia et Limnologia Sinica,1990,21(1):11-18.
[10] Zhang Z N,Lin K X,Zhou H,et al.Abundance and biomass of meiobenthos in autumn and spring in the East China Sea and Yellow Sea.Acta Ecologica Sinica,2004,24(5):997-1005.
[11] Wang X G,Wang C S,Zhang D S,Hong L S,Yang D.Abundance and biomass of meiofauna in the Changjiang Estuary and its adjacent continental shelf waters in spring,2007.Acta Ecologica Sinica,2010,30(17):4717-4727.
[12] Juario J V.Nematode species composition and seasonal fluctuation of a sublittoral meiofauna community in the German bight.Veroff Inst Mecresforsch Bremerh,1975,15(4):283-337.
[13] Warwick R M,Gee J M.Community structure of estuarine meiobenthos.Marine Ecology Progress Series,1984,18:97-111.
[14] Vanhove S,Vermeeren H,Vanreusel A.Meiofauna towards the South Sandwich Trench(750—6300 m)focus on nematodes.Deep Sea Research Part II,2004,51(14/16):1665-1687.
[15] Shirayama Y,kojima S.Abundance of deep-sea meiobenthos off Sanriku,Northeastern Japan.Journal of Oceanography,1994,50(1):109-117.
[16] Thiel H,Schriever G,Bussau C,Borowski C.Manganese nodule crevice fauna.Deep Sea Research Part I,1993,40(2):419-423.
[17] Morgan C L,Odunton N A,Jones A T.Synthesis of environmental impacts of deep seabed mining.Marine Georesources and Geotechnology,1999,17(4):307-356.
[18] Sharma R,Nagender N B,Parthiban G,Jai S S.Sediment redistribution during simulated benthic disturbance and its implications on deep seabed mining.Deep Sea Research Part II,2001,48(16):3363-3380.
[19] Thiel H,Schriever G,Ahnert A,Bluhm H,Borowski C,Vopel K.The large-scale environmental impact experiment DISCOL-reflection and foresight.Deep Sea Research Part II,2001,48(17/18):3869-3882.
[20] Wang C S,Zhou H Y.Assessment of potential impacts of deep-sea mining on marine ecosystem Ⅱ.Benthic ecosystem.Marin Environmental Science,2001,20(2):32-37.
[21] Bernstein B B,Hessler R R,Smith R,Jumars P A.Spatial dispersion of benthic foraminifera in the abyssal central North Pacific.Limnology and Oceanography,1978,23(3):401-416.
[22] Hecker B,Paul A Z.Benthic base-line survey of the DOMES area.NOAA,1977:115.
[23] Renaud-Mornant J,Gourbault N.Evaluation of abyssal meiobenthos in the eastern central Pacific(Clarion-Clipperton Fracture Zone).Progress in Oceanography,1990,24(1/4):317-329.
[24] Wilson G D F.Biological evaluation of a preservational reserve area:faunal data and comparative analysis//The Biological Impact of Deep Ocean Manganese Nodule Mining.Report for National Oceanic and Atmospheric Administration Ocean Minerals and Energy Office contract number 50-DSNC-9-00108.Sydney:Australian Museum,1992:60-60.
[25] Miljutina M A,Miljutin D M,Mahatma R,Galéron J.Deep-sea nematode assemblages of the Clarion-Clipperton Nodule Province(Tropical North-Eastern Pacific).Marine Biodiversity,2009,40(1):1-15.
[26] Brown C J,Lambshead P J D,Smith C R,Hawkins L E,Farley R.Phytodetritus and the abundance and biomass of abyssal nematodes in the central,equatorial Pacific.Deep Sea Research Part I,2001,48(2):555-565.
[27] Snider L J,Burnett B R,Hessler R R.The composition and distribution of meiofauna and nanobiota in a central North Pacific deep-sea area.Deep Sea Research Part A.Oceanographic Research Papers,1984,31(10):1225-1249.
[28] Kaneko(Sato)T,Maejima Y,Teishima H.The abundance and vertical distribution of abyssal benthic fauna in the Japan deep-sea impact experiment//Chung J S,Das B M,Matsui T M,Thiel H,eds.The Proceedings of the 7thInternational Offshore and Polar Engineering Conference.Honolulu,USA,1997,1:475-480.
[29] Gao A G,Wang C S,Yang J Y,Wang Z P,He D H.Distribution of deep-sea meiobenthos of the eastern and western portions of the COMRA’s Pioneer Area.Donghai Marine Science,2002,20(1):28-35.
[30] Yang J Y,Wang C S,Liu Z S,Gao A G,Wang X G.The spacial distribution of tropical north Pacific deep-sea meiobenthos.Journal of Marine Sciences,2005,23(3):23-29.
[31] Wang X G,Wang C S,Zhang D S,Hong L S.An improved method for separating meiofauna from deep-sea sediments using colloidal silica Ludox@HS-40.Journal of Marine Sciences,2010,28(3):79-84.
[32] Higgins R P,Thiel H.Introduction to the Study of Meiofauna.Washington DC:Simithsonian Insitution Press,1988.
[33] Specifications for Oceanographic Survey.The Standards of the People's Republic of China GB/T 13745-92.Beijing:Standards Press of China,2007.
[34] Holm-hansen O,Booth C R.The measurement of adenosine triphosphate in the ocean and its ecological significance.Limnology& Oceanography,1966,11(4):510-519.
[35] Zhang D S,Wang C S,Yang J Y.Distribution of sediment microbial biomass and their impact factors of COMRA’s contract area in eastern pacific ocean.Journal of Marine Sciences,2010,28(1):32-38.
[36] Pfannkuche O.The deep-sea meiofauna of the Porcupine Seabight and abyssal plain(NE Atlantic):population structure,distribution,standing stocks.Oceanologica Acta,1985,8(3):343-353.
[37] Pfannkuche O,Thiel H.meiobenthic stocks and benthic activity on the NE-Svalbard Shelf and in the Nansen Basin.Polar Biology,1987,7(5):253-266.
[38] De Bovée F,Guidi L D,Soyer J.Quantitative distribution of deep-sea meiobenthos in the northwestern Mediterranean(Gulf of Lions).Continental Shelf Research,1990,10(9/11):1123-1145.
[39] Jin X L.Polymetallic Nodules in the Eastern Pacific Metallogenic Belt Marine Geology and Deposit Characteristics.beijing:Ocean Press,1997.
[40] Mayer L M.Surface area control of organic carbon accumulation in continental shelf sediments.Geochemica Et Cosmochinica Acta,1994,58(4):1271-1284.
[41] Keil R G,Tsamakis E,Fuh C B,Giddings J C,Hedges J I.Mineralogical and texture controls on the organic composition of coastal marine sediments:Hydrodynamic separation using SPLITT-fractionation.Geochemica Et Cosmochimica Acta,1994,58(2):879-893.
[42] Pfannkuche O.The deep-sea meiofauna of the Porcupine Seabight and abyssal plain(NE Atlantic):population structure,distribution and standing stocks.Oceanologica Acta,1985,8:343-354.
[43] Mokievskii V O,Udalov A A,Azovskii A I.Quantitative distribution of meiobenthos in deep-water zones of the World Ocean.Oceanology,2007,47(6):797-813.
参考文献:
[8] 张志南,李永贵,图立红,于子山.黄河口水下三角洲及其邻近水域小型底栖动物的初步研究.海洋与湖沼,1989,20(3):197-208.
[9] 张志南,谷峰,于子山.黄河口水下三角洲海洋线虫空间分布的研究.海洋与湖沼,1990,21(1):11-18.
[10] 张志南,林岿旋,周红,韩洁,王睿照,田胜艳.东、黄海春秋季小型底栖生物丰度和生物量研究.生态学报,2004,24(5):997-1005.
[11] 王小谷,王春生,张东声,洪丽莎,杨丹.长江口及其陆架春季小型底栖生物丰度和生物量.生态学报,2010,30(17):4717-4727.
[20] 王春生,周怀阳.深海采矿对海洋生态系统影响的评价II.底层生态系统.海洋环境科学,2001,20(2):32-37.
[29] 高爱根,王春生,杨俊毅,王自磐,何德华.中国多金属结核开辟区东、西两小区小型底栖动物的空间分布.东海海洋,2002,20(1):28-35.
[30] 杨俊毅,王春生,刘镇盛,高爱根,王小谷.热带北太平洋深海小型底栖生物大尺度空间分布.海洋学研究,2005,23(3):23-29.
[31] 王小谷,王春生,张东声,洪丽莎.深海小型底栖生物Ludox离心分选方法的改进研究.海洋学研究,2010,28(3):79-84.
[33] 海洋调查规范.中华人民共和国国家标准GB/T 13745-92.北京:中国标准出版社,2007.
[35] 张东声,王春生,杨俊毅.东太平洋中国合同区沉积物微型生物生物量的分布特征及其影响因子.海洋学研究,2010,28(1):32-38.
[39] 金翔龙.东太平洋多金属结核矿带海洋地质与矿床特征.北京:海洋出版社,1997.

