红树林植被对大型底栖动物群落的影响
陈光程,余 丹,叶 勇,陈 彬
(1.国家海洋局第三海洋研究所,厦门 361005;2.近海海洋环境国家重点实验室(厦门大学),厦门 361005)
作为河口海区生态系统初级生产者,红树林支撑着与其临近的的陆域和海域生命系统,为海区和海陆交界带的生物提供食物来源,也为鸟类、昆虫、鱼虾贝类等提供栖息繁衍场所,并构成复杂的食物链和食物网关系[1]。
基于红树林植被对大型底栖动物分布和生存的重要作用以及大型底栖动物在红树林生态系统内组成和在食物链中的作用,国内外研究人员在红树区大型底栖动物群落结构方面已展开了一定的研究,主要集中在红树林大型底栖动物群落调查、红树林与其周边生境大型底栖动物群落的比较,以及红树林生境变化对大型底栖动物群落的影响等[2-3]。本文综述了红树林植被对大型底栖动物群落影响的研究现状,提出了相应的研究展望,以期为红树林湿地底栖动物生物多样性的保护及恢复提供参考。
1 红树林大型底栖动物种类
大型底栖动物群落调查是潮间带红树林湿地保护和管理的一个重要内容,底栖动物种类组成和数量分布特点可以为红树林管理和保护提供科学依据[4-6]。国内外关于红树林大型底栖动物组成和分布已展开大量的研究。
1.1 全球区域红树林大型底栖动物种类
红树林植被通常会促进潮间带生境的复杂性和多样性,以及与其密切相关的底栖动物的生物多样性[7-8]。表1为全球几大红树林分布区域的大型底栖动物物种数量情况[9]。可以看出,亚洲红树林中甲壳类动物和软体动物的物种数量高于其他几个区域,但多毛类动物物种数量较低。印度-西太平洋区红树林内底栖动物多样性也高于位于低纬度的西大西洋区红树林[9]。
1.2 我国红树林大型底栖动物种类
表2为中国报道的部分红树林区的大型底栖动物物种数量情况。福建红树林共有278种大型底栖生物,广西沿海红树林大型底栖动物共262种,数量上与福建红树林接近。从物种数量组成来看,除福建红树林外,其余几项研究中软体动物数量均超过甲壳类动物数量,而这两类底栖动物构成了红树林大型底栖动物的主要部分,这也是滩涂大型底栖动物组成的普遍规律[5]。除珠带拟蟹守螺(Cerithidea cingulata)为这些红树林的共同优势种外,其它红树林在底栖动物优势种组成上存在差异,其中福建红树林与深圳福田红树林的优势类群组成较相似,海南东寨港和清澜港红树林较相似。黑口滨螺(Littorina elanostoma)、相手蟹(Sesarma)和招潮蟹(Uca)属蟹类也是我国红树林的常见底栖动物。
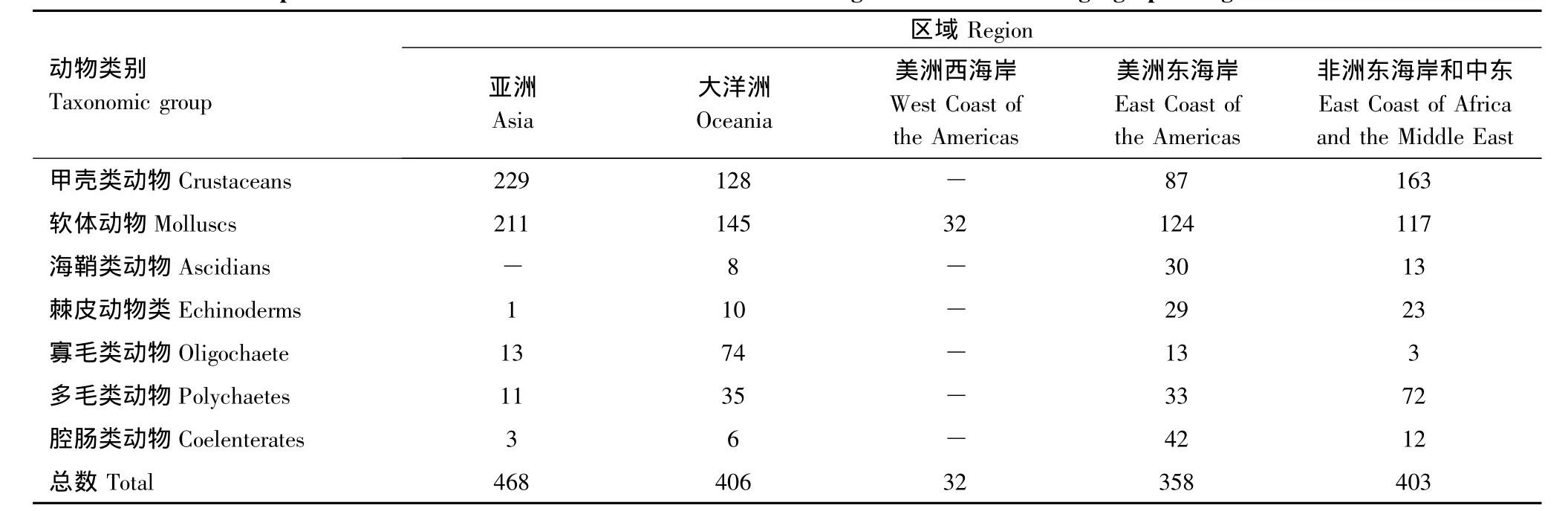
表1 全球几大红树林区域大型底栖动物种类数量组成Table 1 Species numbers of associated biota recorded from mangroves in the various geographic regions of the world
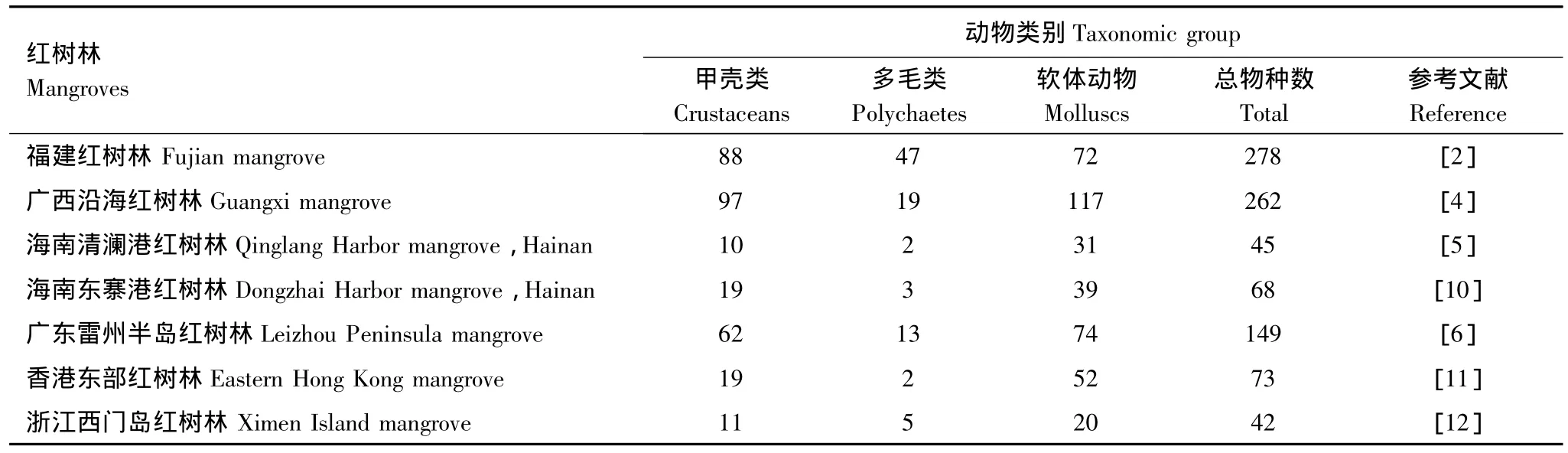
表2 中国部分红树林大型底栖动物种类数量组成Table 2 Species numbers of associated biota recorded from some mangroves in China
1.3 影响红树林大型底栖动物分布的环境因素
影响潮间带大型底栖动物分布的环境因素包括海水盐度[2,6,13]、潮位[2,6,12]和土壤特性[6,11,14-16]等。随着盐度的增加,大型底栖动物的种类增多,其物种多样性指数、种类丰度、均匀度等参数与海水平均盐度大致呈正相关关系,种类优势度则与海水平均盐度大致呈负相关关系[2]。吴启泉等对比了九龙江口相同底质类型的9个站位的底栖动物群落,发现底栖动物物种多样性与底质盐度呈正相关,即河口区底栖动物群落的多样性是随着径流影响的减弱和外海水影响的增强而增大的[17]。这种分布趋势与不同底栖动物种类对盐度的适应能力有关[16]。不同潮位区红树林的底栖动物群落也有差别。在红树林中,林带前缘区大型底栖动物的生物多样性高于红树林中心区域[18-20]。大型底栖动物群落的分布也与沉积物类型密切相关,一般情况下泥质沙或者沙质泥的底质中动物多样性高于沙质或者粘土质等均质的底质环境[14,21]。大型底栖动物群落的分布还呈现出一定的季节变化,这与环境参数的季节变化以及底栖动物自身的生理及繁殖特性等有关。但不同的研究中底栖动物群落的季节变化规律并不一致[10-11,22-23]。例如,在东寨港,无论是密度还是生物量,大型底栖动物的多样性和均匀度均是夏季高于冬季;而在香港东部红树林,夏季底表动物的平均密度和生物量均小于冬季[11],深圳湾福田红树林区大型底栖动物的密度、生物量和物种数则均在秋季达到最低,在春季达到最高[22]。这种季节变化的区域差异可能是由于不同区域的气候条件、底栖动物优势种组成及其季节变化的差异引起的。
与潮间带光滩生境不同,红树林生境中植被林冠可以为一些大型底栖动物特别是腹足类动物提供适宜栖息生境[24],红树林凋落物更是一些大型底栖动物直接或者间接的食物来源[25-27],红树植被的这些特性吸引了大量的底栖动物栖息其中。因此在小范围区域,红树林生境内大型底栖动物群落的分布更多地与植被特性和潮位有关。例如在泰国白海榄雌(Avicennia alba)红树林中,主要大型底栖动物拟沼螺科物种(Ovassiminea brevicula)的栖息密度与红树植物密度呈极显著正相关关系[28]。
红树林中的底栖动物优势物种通常都包括招潮蟹属的物种,其分布与红树林植被有密切关系[29-31],多受林内光照的影响[32]。Nobbs研究发现,光照对招潮蟹属蟹类空间上的迁移和分布的作用强于植被结构的作用,招潮蟹属蟹类倾向于分布在光照充足的地方,因此他认为红树林植被并不能为招潮蟹属蟹类提供有利的栖息条件(如挖穴、抵御捕食者)[31]。红树植物的形态结构复杂,对招潮蟹属蟹类的视觉造成一定的影响,这也是造成一些招潮蟹属蟹类在红树林内分布少于光滩的原因之一。招潮蟹属蟹类通常通过一些视觉信号或者通过挥动大螯进行交流,在红树林中,这些信息交流则会被红树植物所阻挡和影响[29-30,32]。但也有个别物种则倾向于栖息在郁闭的红树林区。在肯尼亚Gazi,植被覆盖率较低的红树林内,清白招潮(Uca lactea)和倒转招潮(U.inversa)为红树林底内大型底栖动物的优势种,而乌氏招潮(U.urvillei)则更多地分布在覆盖率较高的红树林[33]。
方蟹科(Grapsidae)的相手蟹属蟹类是东方红树林中常见的底栖动物。在新加坡和马来西亚红树中共记录到41种相手蟹属蟹类[34],在澳大利亚北部的昆士兰红树林中也记录到30种相手蟹属蟹类[35]。在泰国Ronang红树林中,相手蟹属蟹类的物种数量大约占到甲壳类动物的一半[9]。在分布特点上,通常较大个体的相手蟹物种分布在红树林的高潮区,而小个体的物种分布在低潮区[36]。它们的分布与红树林土壤类型没有密切的相关性[37],而与红树林植被的类型则有明显的关系[38]。但在一些研究中,相手蟹属蟹类并未形成红树林区的优势种或者常见种[2,6,11,39-40]。其原因,除了红树林生境特征外,调查采样的方法也可能是影响结果的因素之一。相手蟹属蟹类通常较活跃,其洞穴的深度可达55—110 cm,而招潮蟹属蟹类的洞穴形态通常较简单,其深度也仅为10—40 cm[41]。在挖掘过程中,相手蟹属蟹类可能会通过洞穴逃到采集深度以下的部分,导致它们的密度相对招潮蟹属蟹类被低估[3]。用手捕捉的调查方法对相手蟹属蟹类则不会造成剧烈的扰动,特别在暖和的季节这种调查方法可以更好地定量出相手蟹属蟹类的密度,因为这段时间内红树林内相手蟹属蟹类较活跃,通常于红树林地面部分活动[3]。
2 红树林生境与其他生境大型底栖动物群落的比较
某些大型底栖动物具有较强的迁移能力,可以借助潮水的作用在毗邻的不同生境中迁移,这种迁移行为为这些底栖动物提供更多选择资源的机会,如食物或者栖息地[42]。Morrisey等认为,在研究大型底栖动物群落时,如仅仅考虑一个类型的近岸海洋生境,或者仅仅将一个生境与另外一个生境进行比较,则无法充分认识近岸海洋生境中底栖动物在空间和时间上的差异的原因,也无法了解某个生境的变化会对整个区域生境内的底栖动物的影响[42]。另一方面,由于红树林在固定沉积物方面有明显的作用并可能由此向周边区域扩散,红树林植被的扩散将给周围其他生境类型带来威胁,如海草床生境和无植被滩涂,而海草床被认为是海洋中生产力最高的生境之一[43]。基于这些原因,国外研究人员开展了一些调查研究,比较近海海洋不同生境类型内大型底栖动物群落的差异,以期为这些区域的海洋环境管理提供科学依据[42,44-45]。
通常认为,近海海洋生境中红树林生境可以维系物种多样、丰富的大型底栖动物群落[8,46-48]。一些研究发现,红树林大型底栖动物的丰富度高于邻近的其他生境类型。Sheridan的研究结果表明,在佛罗里达的Rookery Bay,红树林大型底栖动物的密度显著高于邻近的海草床和无植被的区域[45]。但是红树林生境维系大型底栖动物群落上的作用在世界各地并不一致[45,49-52]。在波多黎各,红树林大型底栖动物的生物量为邻近海草床的7—61倍[44]。在新西兰北部,Alfaro却发现红树林大型底栖动物的密度和生物量在所研究的几个生境类型中为最低,而海草床大型底栖动物种类数量和个体数均明显高于红树林生境和其他生境类型[43]。在新西兰温带地区,红树林大型底栖动物多样性和密度低于沙滩生境,也略低于毗邻的泥滩生境[52]。Wells的研究表明,在与红树林毗邻的泥滩中,大型底栖动物的密度高于红树林,动物种类数量也高于后者[49]。在随后的研究中,Wells发现,白骨壤(Avicennia marina)红树林软体动物的密度为无植被泥滩的2倍,生物量更是达到后者的7倍之多[53]。Wells的研究也表明,红树林和泥滩在动物群落结构也存在差异,滤食性动物和腐食性动物在泥滩生境中占优势,红树林内则以腐食性动物为主[53]。福建红树林底栖生物的生物量和栖息密度也低于同期调查的全省软相潮间带的平均值[2]。但这些调查中所获取的生物样本为底内动物和地表动物,未采集红树植物树栖动物,而红树林内树栖软体动物为底栖动物群落的一个重要组成部分,例如九龙江口桐花树(Aegiceras comiculatum)林内黑口滨螺的密度可达到46个/m2,对应的生物量为15 g/m2[24]。因此,在这些调查中,红树林底栖动物的物种数量和密度均被低估。
在福建九龙江口的研究表明:秋茄(Kandelia candel)红树林底栖动物(包括树栖动物)的密度与光滩虽无明显的差异规律,但红树林内底栖动物物种数量则明显高于位于邻近光滩[3];桐花树林底栖动物密度和物种数量则高于邻近光滩[54]。由于调查的红树林和光滩样地均处于相同潮位,具有相似的地形和底质特性,这些研究证实了红树林在促进潮间带生物多样性方面的作用。
3 红树林生境变化对大型底栖动物群落的影响
红树林植被会改变林内土壤的性质,如盐度、酸度和营养元素含量[55-58],而这些底质因素是影响大型底栖动物组成和分布的重要因子。此外,红树林植被可以直接为一些底栖动物提供栖息场所;红树林植被对潮间带不利环境的改善也有利于一些底栖动物的分布[37,59-61]。因此,红树林植被及其生境的变化会导致林内大型底栖动物群落的相应变化。例如红树林沙化使原有林地大型底栖动物群落异质化,使动物群落的物种数量、密度和生物显著下降,同时降低原有林地优势种群的密度[62]。
近年来,沿海地区人口增长、工业和城市的发展,造成对红树林生境的严重破坏[63-65],这些破坏的方式包括向红树林中排放污染物、堆填垃圾、生境改造以及开发休闲娱乐场所等[46]。
在红树林区进行养殖、砍伐和采矿行为也会给红树林植被带来一定的破坏,并影响底栖动物的群落结构。红树林被部分砍伐导致林内光照强度和温度上升,林内地表大型底栖动物的密度较未受干扰的天然林显著降低,相比下底内大型底栖动物群落所受到的影响不如地表动物明显[66]。在地表活动的大型底栖动物中,不同物种对这种生境的变化也表现出不同的响应,一些招潮蟹属蟹类,如乌氏招潮,不分布在砍伐林的空旷区域,而一些在天然红树林中未分布的物种则出现在砍伐林中[66]。
Ashton等发现在泰国Klong Ngao,矿区和废弃虾池红树林内蟹类群落与其他红树林区存在明显的差异,说明蟹类对红树林生境的变化表现出明显的响应[67]。由于蟹类的活动性较强,它们可以从邻近的红树林内迁移并栖息于这些废弃矿区和虾池的红树林内[8,68]。这些差异也说明蟹类群落的组成结构可以用于指示红树林生境的状态[67]。Macintosh等认为当红树林内大型底栖动物以某个物种为强优势种时,该红树林可能处于较强的环境压力之中,而当红树林内方蟹科动物,特别是相手蟹属蟹类的多样性较高时,该红树林可能处于健康成熟的状态[9]。
木栈道的修建也被证实会给红树林内大型底栖动物群落带来一些影响。Skilleter和Warren发现在修建木栈道的区域中红树植物的气生根较林内减少65%—80%,同时软体动物的种类和个体数量也显著减少,但是这种干扰对蟹类的分布有利,因为在受干扰区域出现更多的蟹类个体[69]。在悉尼Buffalo Creek红树林,木栈道附近3米区域内,大型底栖动物群落与红树林内(距离木栈道24 m以上)表现出较大的差异,其中片脚类动物Paracalliope australis和腹足类动物Assiminea buccinoides的密度低于红树林内区域[70]。在悉尼的其它红树林内,Kelaher等也发现类似的结果,但是受到木栈道影响的物种却有所差异[70]。导致对底栖动物群落影响的一个重要因素是,木栈道的周围红树林植物的气生根和附生藻类的数量明显少于未受干扰红树林区[69]。
红树林生境被破坏的同时,人类的环境意识也得以提高,在这两种因素的促进下,世界范围内开展了大量的红树林生态恢复的项目。关于红树林生态恢复过程中大型底栖动物群落的研究可采取“空间代替时间”的方式进行,即选择历史背景较接近,但是恢复时间不同的红树林进行比较[65]。在泰国 Ronan红树林,Macintosh等比较了不同恢复历史的红树林和天然林内甲壳类动物和软体动物的组成和分布特征,研究发现,在天然林内甲壳类中方蟹科蟹类的优势度高于沙蟹科(Ocypodidae),软体动物中蜒螺科(Neritidae)和耳螺科(Ellobiidae)动物在天然林内的密度高于幼林,但是在人工幼林内滨螺科(Littoriinidae)、拟沼螺科(Assimineidae)和溪蟹科(Potamidae)动物则占优势[9]。在新西兰,人工恢复的白骨壤幼林内大型底栖动物的物种数量和个体数量均高于恢复时间较长的白骨壤林,但是后者内却分布有大量的腹足类动物Potamopyrgus antipodarum[42]。
陈光程等通过比较具有相似恢复背景的人工桐花树林和人工秋茄林内黑口滨螺的分布特征,发现桐花树内黑口滨螺的密度和生物量显著高于同期恢复的秋茄林,但桐花树林内黑口滨螺的个体明显小于秋茄林[24]。随着桐花树植被的发育,黑口滨螺的密度呈先增加后降低的趋势[23]。研究同时发现秋茄林内黑线蜒螺(Nerita lineata)的密度大于桐花树林,而黑线蜒螺在秋茄天然林内密度最大,可能与成熟秋茄植株明显的板状根有关,因为秋茄的板状根可以为黑线蜒螺提供栖息场所[24]。
在福建九龙江口,秋茄红树林内大型底栖动物群落结构随恢复时间发生变化:幼林内的优势种为秀丽长方蟹(Metaplax elegans)和黑口滨螺,而弧边招潮(Uca arcuata)和可口革囊氏星虫(Phascolosoma esculenta)则为光滩和成熟林的优势种;而这些优势种的密度也随秋茄林恢复时间而异[3]。基于研究结果,Chen等认为恢复时间达到19a后,九龙江口秋茄红树林的植被和底栖动物群落的发育趋于稳定[3]。同样,九龙江口桐花树恢复初期,林内大型底栖动物物种数量较光滩相比未发生明显的变化[71]。但伴随桐花树红树林的发育,大型底栖动物群落,特别是甲壳类动物的分布发生明显的变化。作为红树林恢复的起始状态,光滩的甲壳类动物密度高于桐花树林,优势种为弧边招潮和蜾赢蜚(Corophium sp.),桐花树林内的甲壳类动物以秀丽长方蟹为主,褶痕相手蟹(Sesarma plicata)也较多。作为恢复的终点状态,天然桐花树林内物种多样性指数较高,且均匀度最高。
4 研究展望
在红树林生态系统中,关于大型底栖动物群落的研究与其它组份(如植被和土壤)相比相对欠缺。已开展的关于大型底栖动物群落的研究主要集中在群落结构或者某个物种的生物学上[72]。因此,也导致了对红树林植被和大型底栖动物群落生态学关系中一些认识的欠缺。
已有的报道显示一些大型底栖动物在红树林繁殖体定植、凋落物周转、以及营养盐的生物地球化学过程中具有不可忽视的作用[41,71-73],同时,一些底栖动物也可用于指示红树林的生境状况[3,8,66]。国内对底栖动物群落特征(包括物种、密度、生物量、群落结构等)进行过大量的调查,这对红树林区生物多样性研究及其保护提供了基础依据,但对红树林内常见物种或者关键物种的种群结构的报道并不多,导致对红树林的生态功能和生态过程不能给予清晰的认识。因此,红树林区常见(或关键)物种的种群生态学研究是今后值得加以关注的内容。此外,大型底栖动物种间关系及其对红树林生态系统影响的研究也需要进一步加强。
红树林恢复生态学是一个比较重要的研究的领域。目前,无论在国内还是国外,红树林恢复研究多集中在植被恢复的研究上,较注重育苗技术和宜林地的选择,而关于恢复过程中红树林底栖动物亚系统的恢复过程的研究却起步较晚,也相对有限。不同国家和地区在红树植物种类和底栖动物区系上存在一定的差异,某个国家或者地区的研究也可能对其他国家或者地区的红树林生态恢复的指导有限。在我国目前常用于修复的11个红树林物种中,仅报道了少量物种(如秋茄和桐花树)生态恢复对大型底栖动物群落的影响。因此,在今后的研究中,红树林恢复过程中大型底栖动物群落的研究将会是一个重要的领域。在这个领域中,如何选择适当的红树林种植措施,如红树植物种类和种植密度,保证红树林生物多样性成功恢复是一个关键的研究方向,因为这些种植措施是影响红树林植被和大型底栖动物群落的重要因素。
红树林大型底栖动物群落结构受到生境条件的影响,例如潮汐条件、有机质和沉积物物理性质等。红树植被特征决定着红树林生境的复杂性,例如改变林内光照、减缓水分蒸发、提供凋落物和改变沉积物性质等[3],因此在改变林内大型底栖动物的多样性和分布有潜在重要作用。但目前关于红树林植被如何影响大型底栖动物群落结构及其分布还未从机理方面深入,对红树林恢复过程中大型底栖动物恢复过程的影响机制也尚不明确。因此,从地形地貌学、营养学和生态学等角度,研究大型底栖动物群落的分布机理也是将来探索的方向之一。
[1] Lu C Y,Lin P,Ye Y,Wang H H.Review on impact of global climate change on mangrove ecosystems and research countermeasure.Advance in Earth Science,1995,10(4):341-347.
[2] Zhang Y Z,Chen C Z,Wang Y Y,Chen P J,Yang R Q.The ecology of benthos in Fujian mangrove swamps.Acta Ecologica Sinica,1999,19(6):896-901.
[3] Chen G C,Ye Y,Lu C Y.Changes of macro-benthic faunal community with stand age of rehabilitated Kandelia candel mangrove in Jiulongjiang Estuary,China.Ecological Engineering,2007,31(3):215-224.
[4] Lai T H,He B Y.Studies on the macrobenthos species diversity for Guangxi mangrove areas.Guangxi Sciences,1998,5(3):166-172.
[5] Zou F S,Song X J,Chen K,Liang Y,Xu D H.The research on benthic macrofauna of swamp in Qinglangang Mangroue,Hainan.Ecological Science,1999a,18(2):42-45.
[6] Liu J,Han W,He X,Xuan L,Ye N.Studies on the biodiversity of benthic macrofauna of mangrove area in the Leizhou Peninsula,China.Marine Sciences,2006,30(10):65-69,74-74.
[7] Hutchings P A,Saenger P.Ecology of Mangroves.Saint Lucia:University of Queensland Press,1987.
[8] Macintosh D J,Ashton E C,Havanon S.Mangrove rehabilitation and intertidal biodiversity:a study in the ranong mangrove ecosystem,thailand.Estuarine,Coastal and Shelf Science,2002,55(3):331-345.
[9] Macintosh D J,Ashton E C.A Review of Mangrove Biodiversity Conservation and Management.Denmark:Centre for Tropical Ecosystems Research,University of Aarhus,2002.
[10] Zou F S,Song X J,Chen W,Zheng X R,Chen J H.The diversity of benthic macrofauna on mud flat in Dongzhaigang Mangrove Reserve,Hainan.Chinese Biodiversity,1999b,7(3):175-180.
[11] Cai L Z,Tan F Y,Huang Y S.Characteristics of quantitative distribution and species composition of macrozoobenthos in mangrove stands in eastern Hong Kong.Journal of Xiamen University:Natural Science,1998,37(1):115-121.
[12] Gao A,Chen Q,Zeng J,Liao Y,Yang J.Macrofauna community in the mangrove area of Ximen Island,Zhejiang.Journal of Marine Science,2005,23(2):33-40.
[13] Li H M,Li S Y,Cai L Z.Relationship between benthic community and environmental factors in Shenzhen Bay.Acta Scientiarum Naturalium Universitatis Sunyatseni,2003,42(5):93-97.
[14] Gray J S.Animal-sediment relationships.Oceanography and Marine Biology:An Annual Review,1974,12:223-261.
[15] Whitlach R B.Animal-sediment relationships in intertidal marine benthic habitats:some determinants of deposit-feeding species diversity.Journal of Experimental Marine Biology and Ecology,1981,53(1):31-45.
[16] He M H,Cai E X,Xu H Z,Jiang J X,Zheng F W,Li R G.Studies on benthic ecology in mangrove in Jiulong River Estuary,Fujian.Journal of Oceanography in Taiwan Strait,1993,12(1):61-68.
[17] Wu Q Q,Cai E X,He M H,Jiang J X,Lin S D,Xu H Z,Liu Q S.Ecological study on marine benthos in western Taiwan StraitⅠ.Analysis of benthic fauna community in Xiamen Bay.Acta Oceanologica Sinica,1985,7(3):378-387.
[18] McCormick W A.The Ecology of Benthic Macrofauna in New South Wales Mangrove Swamps[D].New South Wales:Univ New South Wales,1978.
[19] Yu R Q,Chen G Z,Huang Y S,Tan F Y.Spatial zonation of benthic macrofauna and possible effects of sewage discharge on it in Futian mangrove swamp,Shenzhen.Acta Ecologica Sinica,1996,16(3):283-288.
[20] Gao A G,Chen Q Z,Zeng J N,Liao Y B,Yang J Y.Macrofauna community in the mangrove area of Ximen Island,Zhejiang.Journal of Marine Sciences,2005,23(2):33-40.
[21] Rhoads D C,Young D K.The influence of deposit-feeding organism on sediment stability and community trophic structure.Journal of Marine Research,1970,28(2):150-178.
[22] Liu J J.Study of the Distribution Pattern of Macrobenthic Community in Futian Mangrove Area,Shenzhen Bay[D].Xiamen:Xiamen University,2000.
[23] Tang Y J,Yu S X.Spatial zonation of macrofauna in the Zhanjiang Mangrove Nature Reserve,Guangdong.Acta Ecologica Sinica,2007,27(5):1703-1714.
[24] Chen G C,Ye Y,Lu C Y,Li R,Wen J,Xu Y Y.Distribution of Littoraia melanostoma gray(Littorinidae)and Nerita lineata gmelin(Neritadae)in rehabilitated mangroves.Chinese Journal of Applied Ecology,2006,17(9):1721-1725.
[25] Odum W E,Heald E J.The detritus based food-web of an estuarine mangrove community//Cronin L E,ed.Esturine Research,vol.1.New York:Academic Press,1975:265-286.
[26] Robertson A I.Leaf-burying crabs:their influence on energy flow and export from mixed mangrove forests(Rhizophora spp.)in northeastern Australia.Journal of Experimental Marine Biology and Ecology,1986,102(2/3):237-248.
[27] Lee S Y.Potential trophic importance of the faecal material of the mangrove Sesarmine crab Sesarma messa.Marine Ecology Progress Series,1997,159:275-284.
[28] Suzuki T,Nishihira M,Paphavasi N.Size structure and distribution of Ovassiminea brevicula(Gastropoda)in a Thai mangrove swamp.Wetlands Ecology and Management,2002,10(3):265-271.
[29] Tea J M.Distribution of fiddler crabs in Georgia salt marshes.Ecology,1958,39(2):185-193.
[30] Crane J.Fiddler Crabs of the World:Ocypodidae:Genus Uca.New Jersey:Princeton University Press,1975.
[31] Nobbs M.Effects of vegetation differ among three species of fiddler crabs(Uca spp.).Journal of Experimental Marine Biology and Ecology,2003,284(1/2):41-50.
[32] Hyatt G W.Physiological and behavioral evidence for color discrimination by fiddler crabs(Brachyura,Ocypodidae,genus Uca)//Vernberg L L,ed.Physiological Ecology of Estuarine Organisms.Columbia:University of South Carolina Press,1975:333-365.
[33] Fondo E N.A comparative study of Macrofauna in a Highly Exploited and a Less Exploited Mangrove Swamp in Gazi Area,Kenya[D].Nairobi:University of Nairobi,1996.
[34] Tan C G S,Ng P K L.An annotated checklist of mangrove brachyuran crabs from Malaysia and Singapore.Hydrobiologia,1994,285(1/3):75-84.
[35] Davie P J F.A preliminary checklist of the Brachyura(Crustacea:Decapoda)associated with Australian mangrove forests.Operculum,1982,5:204-207.
[36] Macnae W.Zonation within mangrove associated with estuaries in north Queensland//Lauff G H,ed.Estuaries.Washington:AAAS,1967:432-441.
[37] Macnae W.A general account of the fauna and flora of mangrove swamps and forests in the Indo-West-Pacific region.Advance in Marine Biology,1969,6:73-103.
[38] Lee C Y,Kwok P W.The importance of mangrove species association to the population biology of the sesarmine crabs Parasesarma affinis and Perisesarma bidens.Wetlands Ecology and Management,2002,10(3):215-226.
[39] Lin X C,Cai L Z,Ma L,Gao Y,Yang L,Liu W M.The macrofaunal community in Fenglin mangrove area,Xiamen.Biodiversity Science,2006,14(2):128-135.
[40] Gao Y,Cai L,Ma L,Xu H,Wang Y,Zan Q.Vertical distribution of macrobenthos of Futian mangrove mudflat in Shenzhen Bay.Journal of Oceanography in Taiwan Strait,2004,23(1):76-81.
[41] Kristensen E.Mangrove crabs as ecosystem engineers;with emphasis on sediment processes.Journal of Sea Research,2008,59(1/2):30-43.
[42] Morrisey D J,Skilleter G A,Ellisa J I,Burns B R,Kemp C E,Burt K.Differences in benthic fauna and sediment among mangrove(Avicennia marina var.australasica)stands of different ages in New Zealand.Estuarine,Coastal and Shelf Science,2003,56(3/4):581-592.
[43] Alfaro A C.Benthic macro-invertebrate community composition within a mangrove/seagrass estuary in northern New Zealand.Estuarine,Coastal and Shelf Science,2006,66(1/2):97-110.
[44] Kolehmainen,S E,Hildner W K.Zonation of organisms in Puerto Rican red mangrove(Rhizophora mangle L)swamps//Walsh L L,Snedaker L L,Teas L L,eds.Proceedings of the International Symposium on Biology and Management of Mangroves.Florida:Gainesville,1975:357-369.
[45] Sheridan P.Benthos of adjacent mangrove,seagrass and non-vegetated habitats in Rookery Bay,Florida,U.S.A.Estuarine,Coastal and Shelf Science,1997,44(4):455-469.
[46] Lindegarth M,Hoskin M.Patterns of distribution of macro-fauna in different types of estuarine,soft sediment habitats adjacent to urban and nonurban areas.Estuarine,Coastal and Shelf Science,2001,52(2):237-247.
[47] Valiela I,Bowen J L,York J K.Mangrove forests:one of the world's threatened major tropical environments.BioScience,2001,51(10):807-815.
[48] Ashton E C,Macintosh D J.Preliminary assessment of the plant diversity and community ecology of the Sematan mangrove forest,Sarawak,Malaysia.Forest Ecology and Management,2002,166(1/3):111-129.
[49] Wells F E.An analysis of marine invertebrate distributions in a mangrove swamp in northwestern Australia.Bulletin of Marine Science,1983,33(3):736-744.
[50] Wells F E.Distribution of molluscs across a pneumatophore boundary in a small bay in northwestern Australia.Journal of Molluscan Studies,1986,52(2):83-90.
[51] Edgar G J.The influence of plant structure on the species richness,biomass and secondary production of macrofaunal assemblages associated with Western Australian seagrass beds.Journal of Experimental Marine Biology and Ecology,1990,137(3):215-240.
[52] Ellis J,Nicholls P,Craggs R,Hofstra D,Hewitt J.Effects of terrigenous sedimentation on mangrove physiology and associated macrobenthic communities.Marine Ecology Progress Series,2004,207:71-82.
[53] Wells F E.Comparative distribution of macrocrustaceans in a north-western Australian mangrove system.Australian Journal of Marine and Freshwater Research,1984,35(5):591-596.
[54] Chen G C,Ye Y.Restoration of Aegiceras corniculatum mangroves in Jiulongjiang Estuary changed macro-benthic faunal community.Ecological Engineering,2011,37(2):224-228.
[55] Kryger L,Lee S K.Effects of soil ageing on the accumulation of hydrogen sulphide and metallic sulphides in mangrove areas in Singapore.Environment International,1995,21(1):85-92.
[56] He B,Wen Y G,Liu S R.Soil chemical properties at succession stages of mangrove communities in Yingluo bay of Guangxi.Guangxi Sciences,2001,8(2):148-151,160-160.
[57] Gleason S M,Ewel K C,Hue N.Soil redox conditions and plant-soil relationships in a micronesian mangrove forest.Estuarine,Coastal and Shelf Science,2003,56(5/6):1065-1074.
[58] Lee H Y,Shih S S.Impacts of vegetation changes on the hydraulic and sediment transport characteristics in Guandu mangrove wetland.Ecological Engineering,2004,23(2):85-94.
[59] Dye A H.Composition and seasonal fluctuations of meiofauna in a Southern African mangrove estuary.Marine Biology,1983,73(2):165-170.
[60] Lasiak T,Dye A H.Behavioural adaptations of the mangrove whelk,Telescopium telescopium(L.),to life in a semi-terrestrial environment.Journal of Molluscan Studies,1986,52(3):174-179.
[61] McGuinness K A.The climbing behaviour of Cerithidea anticipata(Mollusca:Gastropoda):the roles of physical and biological factors.Australian Journal of Ecology,1994,19(3):283-289.
[62] Fang H Q,He B Y,Wei S Q.Influences of sand dune movement within the coastal mangrove stands on the macrobenthos in Situ.Acta Ecologica Sinica,2000,20(5):22-727.
[63] Das P,Basak U C,Das A B.Restoration of the mangrove vegetation in the Mahanadi delta,Orissa,India.Mangroves and Salt Marshes,1997,1(3):155-161.
[64] Field C D.Restoration of Mangrove Ecosystems.Okinawa:International Society for Mangrove Ecosystems,1996.
[65] Ye Y,Wen J,Lu C Y,Chen G C.Mangrove biodiversity restoration.Acta Ecologica Sinica,2006,26(4):1243-1250.
[66] Fondo E N,Martens E E.Effects of mangrove deforestation on macrofaunal densities,Gazi Bay,Kenya.Mangroves and Salt Marshes,1998,2(2):75-83.
[67] Ashton E C,Hogarth P J,Macintosh D J.A Comparison of brachyuran crab community structure at four mangrove locations under different management systems along the Melaka Straits-Andaman Sea Coast of Malaysia and Thailand.Estuaries and Coasts,2003,26(6):1461-1471.
[68] Macintosh D J,Aksornkoae S,Vanucci M,Field C D,Clough B F,Kjerfve B,Paphavasit N,Wattayakorn G.Final Report of the Integrated Multidisciplinary Survey and Research Programme of the Ranong Mangrove Ecosystem//UNDP/UNESCO regional project:Research and Its Application in The Management of The Mangroves of Asia and The Pacific(RAS/86/120).Bangkok:Funny Publishing Limited Partnership,1991:198-198.
[69] Skilleter G A,Warren S.Effects of habitat modification in mangroves on the structure of mollusc and crab assemblages.Journal of Experimental Marine Biology and Ecology,2000,244(1):107-129.
[70] Kelaher B P,Chapman M G,Underwood A J.Changes in benthic assemblages near boardwalks in temperate urban mangrove forests.Journal of Experimental Marine Biology and Ecology,1998,228(2):291-307.
[71] Li R,Ye Y,Chen G C,Wen J.Effect of Aegiceras corniculata mangrove rehabilitation on macro-benthic animals in Jiulongjiang River Estuary.Journal of Xiamen Univeristy:Natural Science,2007,46(1):109-114.
[72] Lee S Y.Mangrove macrobenthos:assemblages,services,and linkages.Journal of Sea Research,2008,59(1/2):16-29.
[73] Bosire J O,Kairo J G,Kazungu J,Koedam N,Dahdoulh-Guebas F.Predation on propagules regulates regeneration in a high-density reforested mangrove plantation.Marine Ecology Progress Series,2005,299:149-155.
参考文献:
[1] 卢昌义,林鹏,叶勇,汪和海.全球气候变化对红树林生态系统的影响与研究对策.地球科学进展,1995,10(4):341-347.
[2] 张雅芝,陈灿忠,王渊源,陈品建,杨瑞琼.福建红树林区底栖生物生态研究.生态学报,1999,19(6):896-901.
[4] 赖廷和,何斌源.广西红树林区大型底栖动物种类多样性研究.广西科学,1998,5(3):166-172.
[5] 邹发生,宋晓军,陈康,梁勇,许达宏.海南清澜港红树林滩涂大型底栖动物初步研究.生态科学,1999a,18(2):42-45.
[6] 刘劲科,韩维栋,何秀玲,宣立强,叶宁.雷州半岛红树林海区底栖动物多样性的研究.海洋科学,2006,30(10):65-69,74-74.
[10] 邹发生,宋晓军,陈伟,郑馨仁,陈建海.海南东寨港红树林滩涂大型底栖动物多样性的初步研究.生物多样性,1999b,7(3):175-180.
[11] 蔡立哲,谭凤仪,黄玉山.香港东部红树林区大型底栖动物种类组成与数量分布特点.厦门大学学报:自然科学版,1998,37(1):115-121.
[12] 高爱根,陈全震,曾江宁,廖一波,杨俊毅.西门岛红树林区大型底栖动物的群落结构.海洋学研究,2005,23(2):33-40.
[13] 厉红梅,李适宇,蔡立哲.深圳湾潮间带底栖动物群落与环境因子的关系.中山大学学报:自然科学版,2003,42(5):93-97.
[16] 何明海,蔡尔西,徐惠州,江锦祥,郑凤武,李荣冠.九龙江口红树林区底栖动物的生态.台湾海峡,1993,12(1):61-68.
[17] 吴启泉,蔡尔西,何明海,江锦祥,林双淡,徐惠州,刘泉顺.台湾海峡西部海域底栖生物生态研究——Ⅰ.厦门港底栖动物群落分析.海洋学报,1985,7(3):378-387.
[19] 余日清,陈桂珠,黄玉山,谭凤仪.深圳福田红树林区底栖大型动物群落的空间分带及灌污的可能影响.生态学报,1996,16(3):283-288.
[20] 高爱根,陈全震,曾江宁,廖一波,杨俊毅.西门岛红树林区大型底栖动物的群落结构.海洋学研究,2005,23(2):33-40.
[22] 刘俊杰.深圳湾福田红树林区大型底栖动物群落分布格局的研究[D].厦门:厦门大学,2000.
[23] 唐以杰,余世孝.广东湛江红树林保护区大型底栖动物群落的空间分带.生态学报,2007,27(5):1703-1714.
[24] 陈光程,叶勇,卢昌义,李蓉,翁劲,徐玉裕.人工红树林中黑口滨螺和黑线蜒螺分布的差异性.应用生态学报,2006,17(9):1721-1725.
[39] 林秀春,蔡立哲,马丽,高阳,杨丽,刘炜明.厦门凤林红树林湿地大型底栖动物群落.生物多样性,2006,14(2):128-135
[40] 高阳,蔡立哲,马丽,徐华林,王勇军,昝启杰.深圳湾福田红树林潮滩大型底栖动物的垂直分布.台湾海峡,2004,23(1):76-81.
[56] 何斌,温远光,刘世荣.广西英罗港红树植物群落演替阶段的土壤化学性质.广西科学,2001,8(2):148-151,160-160.
[62] 范航清,何斌源,韦受庆.海岸红树林地沙丘移动对林内大型底栖动物的影响.生态学报,2000,20(5):722-727.
[65] 叶勇,翁劲,卢昌义,陈光程.红树林生物多样性恢复.生态学报,2006,26(4):1243-1250.
[71] 李蓉,叶勇,陈光程,翁劲.九龙江口桐花树红树林恢复对大型底栖动物的影响.厦门大学学报:自然科学版,2007,46(1):109-114.

