猪鼻支原体Taq Man MGB探针荧光定量PCR方法的建立
白方方,武昱孜,刘茂军,冯志新,熊祺琰,韦艳娜,马庆红,邵国青
(江苏省农业科学院兽医研究所农业部兽用生物制品工程技术重点实验室国家兽用生物制品工程技术研究中心,江苏南京 210014)
猪鼻支原体(Mycoplasma hyorhinis)是一种能够引起猪多发性浆膜炎、关节炎、耳炎、肺炎等病症的致病性支原体。M.hyorhinis不仅在猪群中普遍存在,同时也是人类和多种动物细胞培养中常见的污染物。作为一种常见病原菌,M.hyorhinis通常由母猪或大猪传染给小猪。已有研究证实能够由10%母猪和30%~40%断奶仔猪的鼻腔分泌物中分离出该支原体。在英国和美国的慢性猪肺炎案例中,50%以上均能够检测到M.hyorhinis的存在;同时在地方性肺炎暴发群中几乎每次均能够分离到M.hyorhinis[1]。在台湾,研究者采用M.hyorhinis分离株ATIT-1、3、7混合物气管内注射可以诱发部分攻毒猪发生典型的猪支原体肺炎病变,并从大部分攻毒猪肺脏中分离到M.hyorhinis[2]。另外,已有研究证实M.hyorhinis与人类肿瘤的发生有关[3-4]。
迄今为止,对M.hyorhinis的检测方法有培养法、血清学检测方法等,而对M.hyorhinis检测主要以分离培养为主,耗时较长,亟需建立一种敏感性高、快速、定量检测M.hyorhinis的分子生物学检测方法。本研究建立了M.hyorhinis实时荧光定量PCR方法,有助于快速、定量检测M.hyorhinis的感染。
1 材料和方法
1.1 菌株 M.hyorhinis、猪肺炎支原体(M.hyopneumoniae)、鸡毒支原体(M.gallisepticum)、副猪嗜血杆菌(Haemophilus parasuis)、猪胸膜肺炎放线杆菌(Actinobacillus pleuropneumoniae)、猪圆环病毒 2型(PCV2)、猪瘟病毒(SFV)、猪流感病毒(SIV)均由江苏省农科院兽医研究所保存。
1.2 主要试剂 大肠杆菌Trans5α感受态细胞购自北京全式金生物技术有限公司;Prem ix Ex TaqTM(Perfect Real-time)、质粒载体pMD18-T购自TaKaRa公司。
1.3 引物和探针 根据GenBank登录的M.hyorhinis P37序列(X14140.1)设计引物和探针(表1)。P37全基因扩增引物为P1和P2,预期扩增片段为1212bp,荧光定量PCR检测引物为P3和P4,产物大小为79bp。引物和探针均由TaKaRa公司合成。
1.4 M.hyorhinis p37重组质粒的构建 提取临床采集的疑似M.hyorhinis肺组织样品基因组DNA,并以其为模板使用P1和P2扩增M.hyorhinis p37基因,同时以健康肺组织DNA为阴性对照。反应条件为:94℃ 5m in;94℃ 60s、50℃ 60s、72℃100s,30个循环;72℃10m in。回收PCR产物并克隆至pMD18-T载体中,对重组质粒进行测序分析。测序结果经序列相似性分析,确定为M.hyorhinis p37基因。

表1 引物序列Table 1Primers sequence
1.5 荧光定量PCR反应体系及条件的优化 以重组质粒为模板,采用矩阵法进行荧光定量PCR扩增,并优化退火温度和模板浓度、引物浓度。反应体系为 25μL,其中 2×Premix Ex Taq 12.5μL,P3、P4各 1μL,Taq Man探针 1μL,DNA模板 1μL,校正染料Rox 1μL,去离子水补至25μL。优化后的反应条件为95℃10min;95℃15s、53℃1min,40个循环,53℃测定荧光值。
1.6 荧光定量PCR标准曲线的建立 以M.hyorhinis p37基因阳性标准重组质粒为标准品,分光光度计测定浓度,并计算拷贝数,分别稀释至1.0×108拷贝 /μL~1.0×101拷贝 /μL,按照优化的 PCR 反应体系和程序进行扩增,经计算机分析得出不同拷贝数的Ct值,并绘制标准曲线。
1.7 荧光定量PCR的敏感性试验 将质粒标准品进行 10倍倍比稀释为 1.0×108拷贝 /μL~1.0×101拷贝/μL浓度梯度,进行荧光定量PCR检测,确定该方法的敏感性。
1.8 荧光定量PCR的特异性试验 分别以健康猪DNA、 M.hyorhinis、 M.hyopneumoniae、 M.gallisepticum、 M.flocculare, M.hyosynoviae, H.parasuis、A.pleuropneumoniae的基因组DNA及PCV2、SFV、SIV的核酸样品为模板,在相同的条件下进行荧光定量PCR扩增,以检测分子信标与目的DNA结合的特异性。
1.9 荧光定量PCR的重复性试验 以1.0×107拷贝 /μL~1.0×103拷贝 /μL质粒标准品为模板进行荧光定量PCR分析,分别进行批内和批间重复试验,验证该方法的稳定性。
1.10临床样品检测 应用建立的荧光定量PCR方法对江苏地区某猪场55份临床肺组织样品进行检测,并同时按照参考文献分别利用分离培养法[5]和普通PCR方法[6]进行检测,比较分离培养法、普通PCR和荧光定量PCR的检出率。
2 结 果
2.1 重组质粒的构建 以疑似阳性M.hyorhinis DNA为模板,以P1、P2为引物扩增p37基因,结果显示,扩增出的条带大小与预期目的片段相符(1212bp)(图1)。回收PCR产物并克隆至pMD18-T载体中,测定序列。将测序结果与GenBank中已知的各种微生物核苷酸序列进行相似性比对,与M.hyorhinis p37基因序列(CP002170.1)同源性达99%。表明M.hyorhinisp37基因重组质粒构建正确。

图1 M.hyorhinis p37基因扩增Fig.1Amplification of M.hyorhinis p37gene
2.2 荧光定量PCR标准曲线的建立 以不同拷贝数的重组质粒DNA为模板进行荧光定量PCR扩增,绘制标准曲线。以Ct值为Y轴,重组质粒标准品拷贝数的对数为X轴绘制标准曲线,其斜率为-3.267,轴截距为 40.535,方程式为 y=-3.267x+40.535。标准曲线具有很高的相关性,R2>0.99(图2)。
2.3 荧光定量PCR敏感性试验 将M.hyohinis重组质粒标准品10倍系列稀释进行荧光定量PCR检测,结果表明,荧光定量PCR的最低检测限为10拷贝 /μL(图 3)。
2.4 荧光定量PCR特异性试验 采用荧光定量PCR方法以健康猪DNA、M.hyorhinis、M.hyopneumoniae、 M.flocculare, M.hyosynoviae, M.gallisepticum、H.parasuis、A.pleuropneumoniae的基因组DNA及PCV2、SFV、SIV的核酸样品为模板,M.hyorhinis菌株的扩增曲线为阳性,其他样品均为阴性(图4)。

图2 荧光定量PCR检测M.hyorhinis标准品的标准曲线Fig.2Standard curve generated from positive plasm id of M.hyorhinis by real-time PCR

图3 荧光定量PCR敏感性试验Fig.3Sensitivity tests of real-time PCR

图4 荧光定量PCR特异性检测Fig.4Specificity tests of real-time PCR
2.5 重复性试验 对 1.0×107拷贝 /μL~1.0×103拷贝/μL的质粒DNA进行重复扩增,检测荧光定量PCR的重复性,结果表明,Ct值变异系数均小于2%,该检测方法具有良好的重复性(表2)。
2.6 临床样品的检测 对江苏地区某猪场55份临床肺组织样品进行检测,结果显示,建立的荧光定量PCR方法的检出率为87.3%(48/55),而分离培养方法和普通PCR方法的检出率分别为41.8%(23/55)和29.1%(16/55)。荧光定量PCR方法与分离培养方法及普通PCR方法相比检出率大大提高。
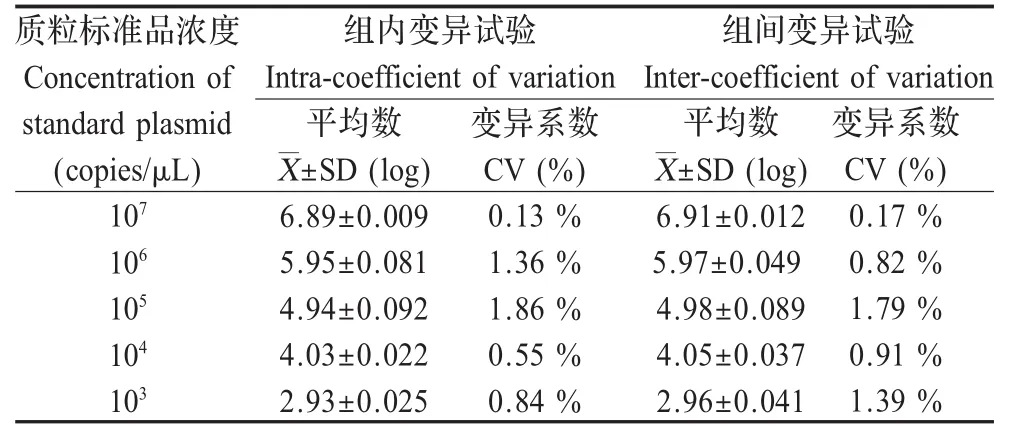
表2 荧光定量PCR组内、组间重复性试验结果Table 2Intra-and inter-assay of real-time PCR reproducibility
3 讨 论
目前,用于M.hyorhinis的检测方法主要包括病原学检测、免疫学检测及分子生物学检测3大类。病原学检测由组织分离病原及镜检,该方法费时费力,并且检出率低。免疫学检测方法有ELISA[7]、免疫胶体金快速检测卡(GICAs)[8]。分子生物学方法目前有基于p37基因的原位杂交方法[9],而国内外尚未有对M.hyorhinis定量检测的分子生物学方法的报道。M.hyorhinis P37蛋白能够诱导外周血单核细胞释放肿瘤坏死因子[10],P37蛋白是该病原的重要特异性膜蛋白,以该蛋白基因为靶基因可以特异性检测该病原。本研究建立的荧光定量PCR方法根据M.hyorhinis p37基因序列设计特异性引物和MGB探针,建立了M.hyorhinis荧光定量PCR检测方法。
Makhanon等[11]比较分离培养方法和普通PCR方法对270份临床肺组织样品中M.hyorhinis的检测,结果表明,分离培养法的检出率为18.15%(49/270),而常规单套16S rDNA PCR方法的检出率为5.19%(14/270)。普通PCR的敏感性较低,不能满足临床样品检测的需求,而本实验建立的Taq-Man MGB探针方法扩增的M.hyorhini片段较小,检测的特异性大大提高。本实验结果表明,对55份临床样品进行检测,建立的荧光定量PCR方法的阳性检出率为87.3%(48/55),而分离培养方法及普通单套p37DNA PCR的阳性检测率分别为41.8%(23/55)和29.1%(16/55)。表明荧光定量PCR方法敏感性比分离培养方法及普通PCR方法高。试验结果表明,本研究建立的M.hyorhinis荧光定量PCR检测方法具有较好的特异性、敏感性及稳定性,可以用于临床样品的检测,是对M.hyorhinis分子生物学定量检测方法的有益补充。
[1]Straw B E,Zimmerman J J,A llaire S D,et al.Disease of swine[M].9th edition,Oxford:Blackwell publishing,2006,715-816.
[2]Lin Jun-Hong,Chen Shi-Ping,Yeh K S,et al.Mycoplasma hyorhinis in Taiwan:Diagnosis and isolation of sw ine pneumonia pathogen[J].Vet M icrobioly,2006,115:111-116.
[3]Yong Hua,Qu Li-ke,Ma Hua-chong,et al.Mycoplasma hyorhinis infection in gastric carcinoma and its effects on the malignant phenotypes of gastric cancer cells[J].BMC Gastroenterol,2010,10:132.
[4]Urbanek G,Goodison S,Chang M,et al,Detection of antibodies directed at M.hyorhinis p37in the serum ofmen with new ly diagnosed prostate cancer[J].BMC Cancer,2011,11:233.
[5]韦艳娜,白昀,孔猛,等.猪肺炎支原体的分离方法[J].江苏农业学报,2012,28(1):104-107.
[6]Caron J,Ouardani M,Dea S.Diagnosis and differentiation of Mycoplasma hyopneumoniae and Mycoplasma hyorhinis infections in pigs by PCR amplification of the p36and p46genes[J].JClin M icrobiol,2000,8(4):1390-1396.
[7]刘星,张丽芳,杨玉萍,等.抗猪鼻支原体单克隆抗体的研制及双抗体夹心ELISA检测法的建立[J].中国比较医学杂志,2008,18(3):55-58.
[8]杨玉萍,刘星.猪鼻支原体感染免疫胶体金快速检测卡的研制[J].中国比较医学杂志,2007,17(2):85-87.
[9]Kim B,Lee K,Han K,et al.Development of in situ hybridization for the detection of Mycoplasma hyorhinis in formalin-fixed paraffin-embedded tissues from naturally infected pigs w ith polyserositis[J].JVet Med Sci,2010,72(9):1225-1227.
[10]Ketcham C M,Anai S,Reutzel R,et al.p37induces tumor invasiveness[J].Mol Cancer Ther,2005,4(7):1031-1038.
[11]Makhanon M,Tummaruk P,Thongkamkoon P,et al.Comparison of detection procedures of Mycoplasma hyopneumoniae,Mycoplasma hyosynoviae,and Mycoplasma hyorhinis in lungs,tonsils,and synovial fluid of slaughtered pigs and their distributions in Thailand[J].Trop Anim Health Prod,2012,44:313-318.?

