Mena表达及SNPs与胃癌遗传易感性及预后*
王 密 张 声 任彩虹 陈祥娜 王行富 黎三艳 陈余朋 曾赛凡
Mena表达及SNPs与胃癌遗传易感性及预后*
王 密 张 声 任彩虹 陈祥娜 王行富 黎三艳 陈余朋 曾赛凡
目的:探讨Mena表达与胃癌侵袭转移的相关性及SNPs与胃癌遗传易感性的关系。方法:制作模拟胃癌侵袭转移过程的组织芯片,免疫组化染色检测Mena蛋白的表达。PCR-LDR技术检测Mena基因5个SNPs位点多态性并行测序验证。结果:胃腺癌中Mena表达上调,肠型与混合型胃癌高于弥漫型,并与胃癌侵袭转移负相关,Mena高表达者预后好。Mena基因SNP位点rs3795443的188例对照组等位基因A、G的频率分别为91.0%和9.0%,胃癌病例组等位基因A、G的频率为82.4%和17.6%;AA、A/G和GG的基因型频率在对照组分别为81.9%、18.1%和0,而在病例组为68.35%、28.09%和3.56%,差异具有统计学意义(OR=2.1489,95%CI:1.4607~3.1613,P<0.01)。5个SNPs位点的基因型和等位基因频率与胃癌术后生存时间均无明显相关性。结论:胃癌Mena表达升高,组织学类型的维持以及侵袭转移与其表达密切相关,高表达者预后好。Mena SNP rs3795443位点携带等位基因G的GG和A/G基因型个体的胃癌患病风险提高,提示检测该位点基因型有助于评估胃癌的遗传易感性。
胃癌 Mena表达 SNP 传易感性 预后
哺乳动物肌动蛋白调节蛋白Mena与细胞运动性和粘附性的调节相关,在多种肿瘤中过表达,如乳腺癌、黑色素瘤、结直肠肿瘤、宫颈肿瘤和胰腺癌[1-4]等。Mena表达能够诱导细胞膜突起和增加肿瘤细胞对基质的降解活性,增加癌细胞能动性促进侵袭和转移[2]。胃癌是世界上最常见的恶性肿瘤之一,但Mena表达与胃癌发生发展间的关系未见报道。本研究通过构建模拟胃癌侵袭转移动态过程的组织芯片,采用免疫组织化学方法检测Mena蛋白的表达水平,探讨其表达变化与胃癌侵袭转移及预后间的关系,运用病例对照的研究方法检测胃癌患者正常胃黏膜组织和健康人血液样本中Mena基因SNPs的基因型和等位基因频率,探讨Mena基因SNPs与胃癌遗传易感性的关系。
1 材料与方法
1.1 组织芯片免疫组化染色研究Mena蛋白表达
1.1.1 研究对象 收集福建医科大学附属第一医院病理科2001年1月~2009年12月间外科手术切除胃癌标本存档蜡块共398例,其中男性289例,女性109例,年龄24~88岁,平均(60.1±11.7)岁。按2010版《消化系统肿瘤WHO分类》标准进行分类[5]。患者均为福建籍汉族人,随访资料完整,生存时间0.6~122个月。对照组(Control group)共188例,其中男119例,女69例,年龄17~87岁,平均(51.7±14.5)岁。均为福建医科大学附属第一医院健康体检的人群。
1.1.2 组织芯片的制备 构建模拟胃癌侵袭转移动态过程的组织芯片:癌旁正常胃黏膜、黏膜层癌组织、肿瘤中央区癌组织(即黏膜层与侵袭前沿中间的胃癌组织)、侵袭前缘区癌组织(即肿瘤纵向侵袭胃壁最远处)及淋巴结转移灶癌组织。
1.1.3 免疫组织化学染色 Mena鼠单克隆抗体(mAb clone 21,对应Mena氨基酸序列415~541,1∶20稀释)购自美国Santa cruz公司;非生物素免疫组化ElivisionTMplus检测试剂盒购自福州迈新公司。操作严格按照说明书进行。用已知阳性对照片作阳性对照,用PBS代替一抗作阴性对照。
1.1.4DNA提取及PCR-LDR主要试剂 总DNA抽提试剂盒TaKaRa DEX-PATTM试剂(日本TaKaRa公司),AxyPrep-96全血基因组DNA试剂盒(AXYGEN公司),Qiagen Hotstar Taq酶体系(酶5 U/μL,buffer,Q-solution,Mg+等,QIAGEN德国生物技术有限公司),GTPureTMFFPE Tissue DNA Extration Kit(中国基因科技有限公司)。
1.1.5 DNA提取及PCR-LDR主要仪器设备 QIA-cube DNA抽提仪(德国凯杰公司),ABI GeneAmp PCR System 9700(美国应用生物系统有限公司),Ta-KaRa PCR Thermal Cycler Dice TP600(日本 TaKaRa公司),Eppendorf Mastercycler epgradients(德国艾本德公司),ABI 3130xl Genetic Analyzer(美国应用生物系统有限公司)。
1.2 方法
1.2.1 SNP研究的标本采集与保存方法 对照组健康体检者外周静脉血1 mL于含EDTA的3 mL抗凝管内,迅速放入-20℃冰箱保存以备提取基因组DNA。胃癌组样本为石蜡包埋组织,选取正常胃黏膜组织,每例切10 μm薄片3枚放入Eppendorf管中以提取基因组DNA。
1.2.2 判定标准 Mena蛋白的阳性染色主要定位于细胞浆,呈棕黄色颗粒状。在400倍镜下根据胃黏膜上皮或肿瘤细胞胞浆的染色程度进行分析评分。染色程度分为4级:基本不着色者为0分,着色浅者为1分,着色适中者2分,着色深者为3分;着色细胞占计数细胞百分率≤5%为0分、6%~25%为1分、26%~50%为2分、≥51%为3分。将着色程度与着色细胞百分率得分乘积,为其最后得分。0~1分为阴性(-),2~3分为弱阳性(+),4~6分为阳性(++),6分以上为强阳性(+++)。其中Mena(-)与(+)为低表达,(++)与(+++)为高表达。
1.2.3 引物及探针合成 选择Mena基因的5个SNPs位点即rs3795443,rs113170551,rs113271908,rs7598 6582,rs75136619,利用Primer3.0在线设计引物,同时根据碱基互补配对原则设计每个SNP位点相对应的特异性探针,序列如下所示(表1~2)。
1.2.4 DNA提取及PCR-LDR 石蜡包埋组织基因组DNA提取和对照组全血基因组DNA的抽提按Dexpattm试剂盒说明进行。0.8%琼脂糖凝胶电泳检测基因组DNA多重PCR反应产物的完整性。PCR扩增SNP位点所在片段:95℃ 15 min,94℃ 30 s,59℃ 1 min,72℃ 1 min,72℃7 min,35个循环,3.0%琼脂糖凝胶,0.5×TBE电泳分析。

表1 Mena基因引物序列及PCR产物长度Table 1 Gene sequence of primers and PCR products of Mena

表2 Mena基因LDR反应探针及连接产物长度Table 2 LDR reaction probe and the length of the connecting product of the Mena gene
1.2.5 PCR产物的连接酶检测反应(LDR) 取1 μL LDR连接产物与1 μL ABI GS-500 ROX荧光标记分子和去离子甲酰胺上样液混合,95℃加热变性2 min,冰中骤冷,于5%聚丙烯酰胺和5 mol/L尿素中3 000 V电泳2.5 h,应用GeneScanTM672软件进行数据收集、泳道线校正、迁移片段大小测量和校正内在分子量标准;应用Genemapper软件进行数据分析和基因分型。测序仪测序检验PCR-LDR的试验结果。
1.3 统计学处理
应用SPSS 13.0软件包及SHEsis软件对检测结果进行统计学分析。以α=0.05为检验显著性水准。P<0.05为有统计学意义。
2 结果
2.1 Mena蛋白在胃癌组织中的表达
正常胃黏膜腺上皮不表达或呈弱阳性表达,肠型胃癌表达高于弥漫型胃癌(图1)。
与正常胃黏膜腺上皮相比,黏膜层胃癌组织Mena蛋白表达水平明显升高(P<0.01,表3)。与分化程度相关,肠型与混合型胃癌Mena的高表达率(73.46%,61.29%)明显高于弥漫型胃癌(33.69%,P<0.05),分化型腺癌Mena的高表达率(75.56%,75.31%和61.19%)明显高于黏液腺癌(含印戒细胞癌)(24.57%,P<0.01),贲门部胃癌的Mena表达明显高于胃窦部胃癌的表达(P<0.05),而胃体部胃癌的表达介于贲门部与胃窦部之间,肿瘤浸润至全层及发生淋巴结转移时Mena的表达明显降低(P<0.05),Mena表达与患者性别、年龄无关(P>0.05)。Mena蛋白表达水平不同其术后5年生存率差异明显(分别为-:16.76%,+:25.84%,++:44.58%,+++:47.69%),高表达者术后5年生存率明显高于低表达者(P<0.01,图2)。
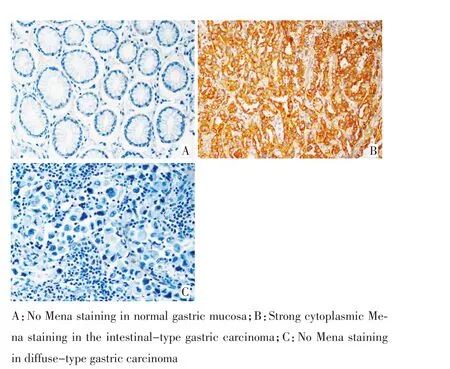
图1 Mena在正常胃黏膜和胃癌中的表达 (IHC×400)Figure 1 Mena expression in normal mucosa and gastric cacinoma(IHC×400)
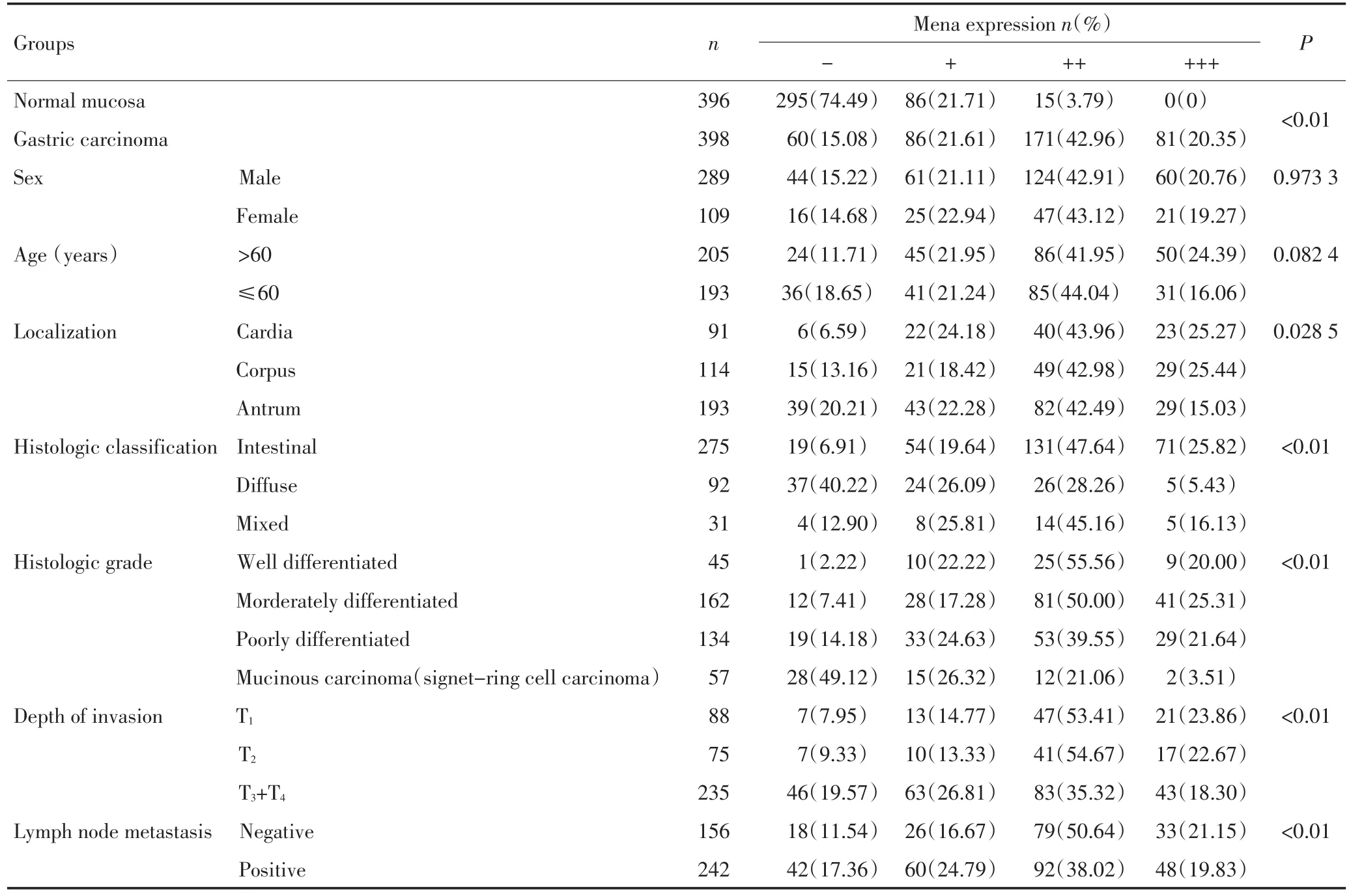
表3 正常胃黏膜与黏膜层胃癌组织中Mena蛋白的表达Table 3 Expression of Mena in gastric carcinoma mucosa and normal mucosa
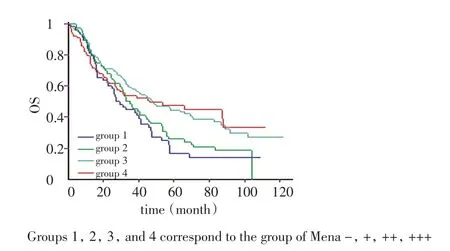
图2 黏膜层胃癌Mena表达分级与生存时间的关系Figure 2 Relationship of the Mena expression in gastric carcinoma in mucosa with the survival of gastric carcinoma patients
2.2 胃癌侵袭过程中Mena蛋白表达变化情况
进展期胃癌中,黏膜层、肿瘤中央区、侵袭前沿区和淋巴结转移灶4个部位胃癌组织Mena蛋白的表达情况见表4。随着胃癌侵袭深度的进展,Mena蛋白表达降低,而从侵袭前沿区转移到淋巴结时,Mena蛋白表达上升,但其差异无统计学意义。
2.3 Mena基因SNPs位点基因型和等位基因频率分布
188例中国福建普通人群Mena预筛选5个SNP位点,各等位基因频率和基因型分布频率见表5。其中Mena基因的3个位点rs113170551,rs113271908和rs75986582均为纯合子,在病例组和对照组中未见差异;位点rs75136619在病例组和对照组均出现A/G杂合子,对照组杂合子出现频率为4/188(2.1%),病例组杂合子出现频率为7/306(2.3%),差异未见统计学意义(P>0.05),故认为Mena基因位点rs75136619多态性与胃癌的遗传易感性无关。
位点rs3795443等位基因频率和基因型频率在福建汉族人群对照组和胃癌病例组间明显差异(P<0.01,表6),对照组等位基因A、G的频率为90.96%和9.04%,胃癌组等位基因A、G的频率为82.40%和17.60%,故认为胃癌组等位基因G的频率分布高于对照组,将具有Mena SNP位点rs3795443等位基因G视为暴露因素,则携带等位基因G的个体胃癌发病风险提高(OR=2.1489,95%CI:1.4607~3.1613)。
AA、A/G、GG的基因型频率在对照组分别为81.91%,18.09%,0,而在胃癌组为68.35%,28.09%,3.56%,胃癌病例组AA基因型分布频率下降,A/G、GG基因型分布频率上升,差异具有统计学意义(P<0.01)。故认为Mena SNP位点rs3795443的A/G、GG基因型的个体胃癌发病风险提高,未见rs3795443等位基因频率和基因型频率与胃癌临床病理学参数及预后间存在相关性。
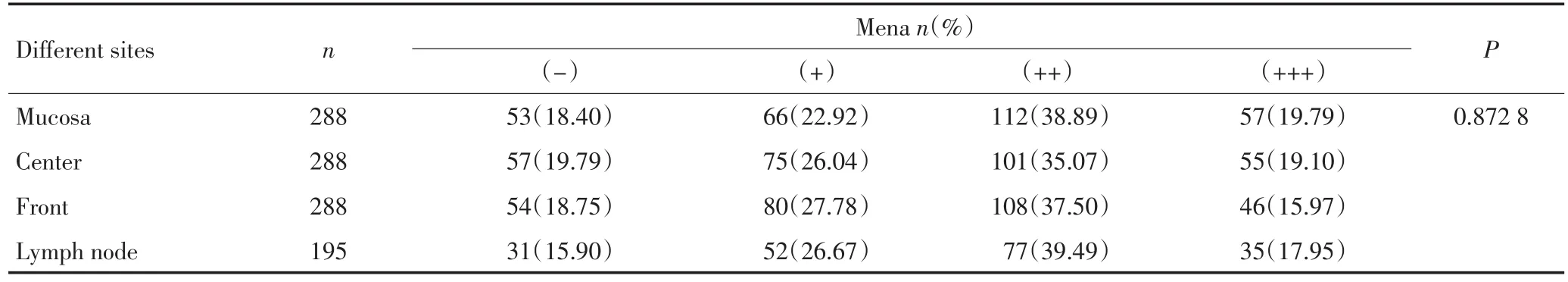
表4 胃癌侵袭转移过程Mena的表达变化Table 4 Expression of Mena in four sites of advanced gastric carcinoma
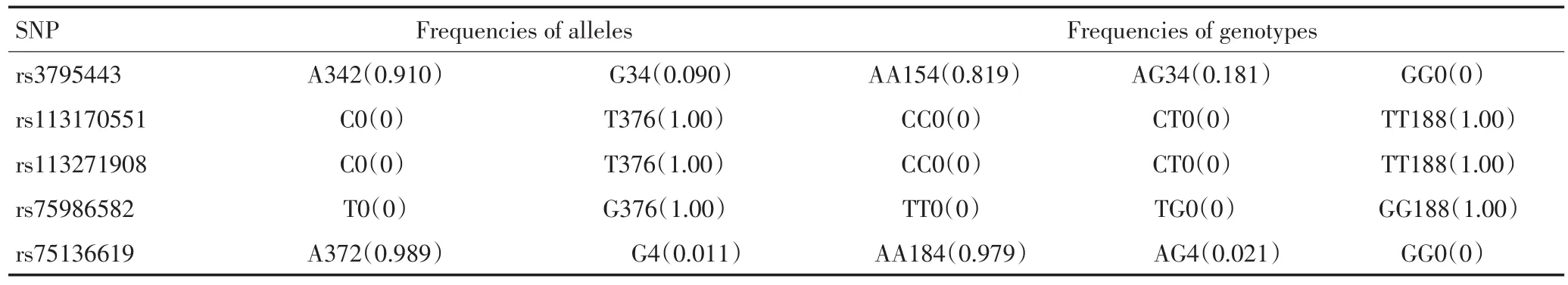
表5 中国福建普通人群Mena五个SNP位点的等位基因和基因型分布Table 5 Frequencies of the alleles and genotypes of the five SNPs loci in Mena in the general population in Fujian,China
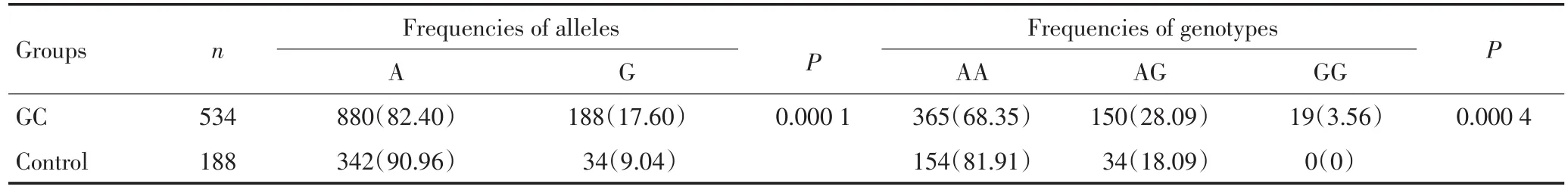
表6 rs3795443位点等位基因和基因型频率在福建人群对照组和病例组的频率分布(%)Table 6 Frequencies of alleles and genotypes at the Mena SNP rs3795443 locus between patients with gastric carcinoma and the control groups(%)
3 讨论
侵袭转移是胃癌患者的主要死亡原因,与肿瘤细胞的粘附力、运动能力、增殖能力、对周围基质的蛋白水解能力、以及肿瘤性血管形成能力有关。Mena表达与细胞运动性和粘附性的调节相关,与肿瘤的发生发展相关,但尚鲜有文献报道Mena表达与胃癌发生发展的关系。本文通过检测胃癌组织Mena表达变化情况,发现Mena表达参与胃癌的进展,并与预后有关,Mena基因多态性与胃癌患者遗传易感性相关。
3.1 Mena蛋白表达与胃癌生物学行为的关系
Mena蛋白定位于细胞间的黏着斑、板状伪足前沿,丝状伪足尖[6]以及细胞内动态的肌动蛋白区域,调控肌动蛋白细胞骨架动态改变过程,例如成纤维细胞的迁移,细胞的细菌样运动,轴突和树突的导向,Mena也与E-钙黏蛋白的大簇团共定位[7],提示参与黏着斑的组成,选择性地定位于细胞间的亚区。
Gurzu等[3]发现正常结直肠黏膜和无异形增生的息肉Mena阴性表达,伴异形增生的息肉Mena过表达;正常宫颈鳞状上皮中Mena未表达,但随着CIN级别的增加染色强度增强[4]。Di等[8]发现乳腺腺病、导管扩张、囊肿、纤维腺瘤和单纯性大汗腺化生的腺上皮Mena阴性染色,浸润性乳腺癌细胞表达上调。目前鲜见文献报道正常人胃黏膜腺上皮Mena的表达,本文发现正常胃黏膜腺上皮Mena大部分不表达,少部分胞浆弱阳性表达。
Di等[8]发现乳腺浸润性导管癌和导管原位癌Mena高表达,Gurzu等[3]发现结直肠腺上皮高级别异形增生时Mena高表达,未见与分化程度、侵袭、淋巴结转移存在相关性。Pino等[9]应用与本文相同的广谱抗Mena抗体对原发性胰腺癌和同时性转移性胰腺癌进行研究发现原发性和转移性胰腺癌均存在Mena过表达,并且在胰腺癌和乳腺癌细胞株的研究中发现Mena11a是癌细胞具有上皮表型的标记,而hMENAΔv6是癌细胞具有间叶表型的标记表达于具有更强侵袭力的癌细胞,提示Mena不同亚型的转换在癌细胞上皮间质转化中具有非常重要的作用[10]。Mena过表达被认为是异型增生和癌症发生的早期事件。本文发现胃癌Mena表达高于正常胃黏膜,肠型和混合型胃癌Mena表达高于弥漫型胃癌,表达程度与侵袭转移负相关,表达高者预后好于低表达者。Mena在肿瘤组织中的表达水平是评估肿瘤细胞能动性和肿瘤侵袭转移的一个有用的生物指标,乳腺癌、宫颈癌、结肠和胰腺癌原发瘤中Mena表达水平与转移相关[11]。
3.2 Mena基因SNPs与胃癌遗传易感性的关系
Mena基因即Ena位于1q42.12[12],其编码产物由541个氨基酸组成,与果蝇(Drosophila)的Ena相似,称为哺乳动物的 Ena(mammalian enabled,Mena)[13]。在脊椎动物,Ena/VASP蛋白包含VASP、Mena及Ena-VASP样蛋白(EVL),均具有同样的保守结构域,包括N-末端的EVH-1结构域、中间的多聚脯氨酸结构域(poly-proline region,PPR)和C-末端的EVH-2结构域[14]。
从Pubmed SNP数据库中可检索到Mena基因(ENAH基因)共有1364个SNP位点,其中在3个外显子中有7个非同义突变SNPs,外显子1有2个SNP位点[rs114476062(570 A>G),rs77211786(469 G>C)],外显子2有4个SNP位点[rs113170551(558 G>A),rs113271908(468 G>A),rs75986582(464 A>C),rs75136619(419 C>T)],外显子3有1个SNP位点[rs2785204(223 A>T)],位于编码区。Mena的SNPs与胃癌发病相关性研究尚鲜见报道。
本研究检测分析Mena基因外显子2的4个SNP位 点 rs113170551,rs113271908,rs75986582,rs 75136619和3’端非编码区的SNP位点rs3795443在中国胃癌高发区福建省汉族人群中胃癌组和健康对照组中的基因型分布频率,以确定是否与胃癌的遗传易感性相关。本文发现在福建省健康对照人群中,rs3795443位点稀有等位基因G频率为0.09,与NCBI报道的中国人群频率0.07相近(报道中国人群n=90);rs75986582稀有等位基因T的频率为0,与报道中显示的中国人群频率0.14有差异,考虑可能为标本来源区域差异及样本量过小所致(报道中国人群n=90)。rs113170551、rs113271908R稀有等位基因C、G均为,目前尚无这两位点的杂合度报道。
Mena SNP位点rs3795443等位基因频率和基因型频率在福建汉族人群对照组和胃癌病例组间差异显著。等位基因A的频率在正常对照组为90.96%,在胃癌病例组下降为82.40%,等位基因G的频率在正常对照组为9.04%,在胃癌病例组上升为17.60%,差异具有统计学意义。AA、A/G、GG的基因型频率在对照组分别为81.91%,18.09%,0,而在胃癌病例组为68.35%,28.09%,3.56%,胃癌病例组AA基因型分布频率下降,A/G、GG基因型分布频率上升,差别具有统计学意义。病例组等位基因G的频率分布高于对照组,提示具有rs3795443等位基因G视为暴露因素,则携带等位基因G的个体胃癌发病风险提高,A/G、GG基因型的个体胃癌发病风险提高。目前未见ENAH的rs3795443等位基因与肿瘤相关性的报告。
综上所述,本文发现Mena表达参与胃腺癌的发生,并与胃腺癌结构的维持和肿瘤的侵袭转移及预后有关。Mena基因SNPs位点rs3795443多态性与胃癌的遗传易感性相关。Mena基因SNPs位点rs75136619、rs11317 0551、rs113271908和rs75986582多态性与胃癌的遗传易感性无关。
1 Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
2 Philippar U,Roussos ET,Oser M,et al.A Mena invasion isoform potentiates EGF-induced carcinoma cell invasion and metastasis[J].Dev Cell,2008,15(6):813-828.
3 Gurzu S,Jung I,Prantner I,et al.The expression of cytoskeleton regulatory protein Mena in colorectal lesions[J].Rom J Morphol Embryol,2008,49(3):345-349.
4 Gurzu S,Jung I,Prantner I,et al.The immunohistochemical aspects of protein Mena in cervical lesions[J].Rom J Morphol Embryol,2009,50(2):213-216.
5 Bosman FT,Carneiro F,Hruban R,et al.WHO Classification of Tumours of the Digestive System[M].4th ed.IARC:Lyon,2010,45-58.
6 Di Modugno F,Bronzi G,Scanlan MJ,et al.Human Mena protein,a serex-defined antigen overexpressed in breast cancer eliciting both humoral and CD8+T-cell immune response[J].Int J Cancer,2004,109(6):909-918.
7 Scott JA,Shewan AM,den Elzen NR,et al.Ena/VASP proteins can regulate distinct modes of actin organization at cadherin-adhesive contacts[J].Mol Biol Cell,2006,17(3):1085-1095.
8 Di Modugno F,Mottolese M,Di Benedetto A,et al.The cytoskeleton regulatory protein hMena(ENAH)is overexpressed in human benign breast lesions with high risk of transformation and human epidermalgrowth factor receptor-2-positive/hormonalreceptor-negative tumors[J].Clin Cancer Res,2006,12(5):1470-1478.
9 Pino MS,Balsamo M,Di Modugno F,et al.Human Mena+11a isoform serves as a marker of epithelial phenotype and sensitivity to epidermal growth factor receptor inhibition in human pancreatic cancer cell lines[J].Clin Cancer Res,2008,14(15):4943-4950.
10 Di Modugno F,Iapicca P,Boudreau A,et al.Splicing program of human MENA produces a previously undescribed isoform associated with invasive,mesenchymal-like breast tumors[J].Proc Natl Acad Sci U S A,2012,109(47):19280-19285.
11 Gertler F,Condeelis J.Metastasis:tumor cells becoming MENAcing[J].Trends Cell Biol,2011,21(2):81-90.
12 Junnila S,Kokkola A,Karjalainen-Lindsberg ML,et al.Genome-wide gene copy number and expression analysis of primary gastric tumors and gastric cancer cell lines[J].BMC Cancer,2010,10:73.
13 Gertler FB,Niebuhr K,Reinhard M,et al.Mena,a relative of VASP and Drosophila Enabled,is implicated in the control of microfilament dy namics[J].Cell,1996,87(2):227-239.
14 Benz PM,Blume C,Seifert S,et al.Differential VASP phosphorylation controls remodeling of the actin cytoskeleton[J].J Cell Sci,2009,122(Pt 21):3954-3965.
15 Hahn WH,Suh JS,Cho BS,et al.The enabled homolog gene polymorphisms are associated with susceptibility and progression of childhood IgA nephropathy[J].Exp Mol Med,2009,41(11):793-801.
(2012-11-19收稿)(2013-06-14修回)
Relationship of Mena expression and SNP polymorphisms with the susceptibility and prognosis of gastric cancer
Mi WANG,Sheng ZHANG,Caihong REN,Xiangna CHEN,Xingfu WANG,Sanyan LI,Yupeng CHEN,Saifan ZENG
Sheng ZHANG;E-mail:zhgshg@126.com
Department of Pathology,The First Clinical Medical College of Fujian Medical University,Fujian Key Laboratory of Translational Cancer Medicine,Fuzhou 350005,China
Objective:To investigate the correlation of Mena protein expression with the invasion and metastasis of Mena SNPs with genetic susceptibility in gastric cancers(GC).Methods:A tissue microarray that simulates the invasion and metastasis process of GC was created,and immunohistochemistry was performed to detect the expression of Mena protein.The Mena gene 5 SNP loci genotypes of 188 healthy people and 389 GC patients were assayed using PCR-based LDR analysis.Results:The expression of Mena protein in GC was significantly upregulated and greatly increased in the intestinal-type and mixed-type GC than that in the diffuse-type and was negatively related to the invasion and metastasis of GC.Patients with Mena overexpression had better prognosis.The frequencies of the A and G alleles,as well as the AA,AG,and GG genotypes,at the Mena SNP rs3795443 locus were significantly different between patients with gastric carcinoma and the control groups(OR=2.1489,95%CI 1.4607~3.1613,P<0.01).The frequencies of these five Mena gene SNP loci were not significantly related with the survival of patients with gastric carcinoma.Conclusion:The upregulation of Mena expression is involved in maintaining the histological phenotype,invasion,metastasis,and prognosis of gastric adenocarcinoma.Individuals with GG and AG genotypes at the Mena rs3795443 locus have increased risk of gastric carcinoma,which suggests that screening for this genotype would be helpful in assessing the genetic susceptibility of gastric carcinoma.
gastric neoplasm;Mena expression;SNP;susceptibility;prognosis
10.3969/j.issn.1000-8179.20121718
福建医科大学第一临床医学院病理科,福建省肿瘤转化医学重点实验室(福州市350005)
*本文课题受福建医科大学学科带头人基金(编号:JXK 200724)资助
张声 zhgshg@126.com
This work was supported by the Fujian Medical University Leading Scientist Foundation(No.JXK 200724)
(本文编辑:周晓颖)

