氯喹促进顺铂诱导胃癌SGC7901细胞凋亡及其机制*
张慧卿 方 念 芦 珊 何 波 万以叶
氯喹促进顺铂诱导胃癌SGC7901细胞凋亡及其机制*
张慧卿①方 念②芦 珊①何 波①万以叶①
目的:研究自噬对顺铂(cisplatin,DDP)诱导的胃癌SGC7901细胞凋亡的影响,并初步探讨其可能机制。方法:DDP和(或)氯喹处理胃癌SGC7901细胞,MTT法检测细胞增殖,流式细胞术检测细胞凋亡,MDC染色后荧光显微镜观察自噬囊泡,Western Blot检测自噬和凋亡相关蛋白。结果:5 mg/L的顺铂作用于胃癌SGC7901细胞24 h,细胞凋亡率为21.07%±2.12%,同时观测到自噬囊泡增多和LC3-Ⅱ蛋白表达升高;氯喹特异性抑制自噬活性后,提高了顺铂诱导的细胞凋亡率(30.16%±3.54%,P<0.05);检测到凋亡相关蛋白Caspase-3和P53表达增加,Bcl-2蛋白表达下降。结论:自噬在顺铂诱导胃癌SGC7901细胞凋亡的过程中起保护作用,氯喹抑制自噬后,可能通过激活P53蛋白及灭活Bcl-2蛋白的表达来促进细胞凋亡,联合应用顺铂和氯喹有望成为胃癌治疗的新策略。
自噬 顺铂 氯喹 凋亡 胃癌
化疗是治疗胃癌的主要方法之一。顺铂作为传统的化疗药,贯穿在胃癌化疗的不同时段,如辅助化疗的ECF方案,姑息化疗的DCF方案和分子靶向治疗的PF+曲妥珠单抗方案,在NCCN指南中都被作为Ⅰ类证据推荐使用[1-3]。研究表明,方案含顺铂的晚期胃癌患者更能从化疗中获益,生存期更长[4]。目前认为,化疗药主要通过诱导细胞凋亡实现对肿瘤的杀伤作用。自噬是真核生物分割降解细胞内蛋白、脂质和细胞器的过程,维持着细胞代谢的平衡,在肿瘤的发展和治疗中起重要作用[5-6]。新近报道,顺铂在诱导肺腺癌A549细胞凋亡的同时,也引起了自噬的发生,最终导致肿瘤细胞存活[7]。然而,顺铂是否诱导胃癌细胞发生自噬,以及自噬对细胞凋亡的影响,国内外鲜见报道。本研究旨在观察顺铂作用于胃癌SGC7901细胞前后自噬的变化,以及联合自噬抑制剂氯喹对细胞凋亡产生的影响,并初步探讨其相关机制。
1 材料与方法
1.1 细胞培养
人胃癌细胞株SGC7901购自于中山大学实验动物中心。用含10%胎牛血清、双抗(100 U/mL青霉素及0.1 mg/mL链霉素)的DMEM完全培养基(Gibco公司),接种于37℃,5%CO2,饱和湿度的孵箱中培养。
1.2 细胞分组与药物处理
实验细胞共分为4组:对照组(control)、氯喹组(chloroquine,CQ)、顺铂组(cisplatin,DDP)和联合组(CQ+DDP)(氯喹和顺铂均为美国Sigma-Aldrich公司产品)。对照组药物为零剂量,氯喹组只用20 μmol/L的氯喹;顺铂组加入5 mg/L DDP;联合组先用20 μmol/L的氯喹处理细胞,1 h后加入5 mg/L的DDP。各组细胞于药物处理后24 h进行观察和检测。
1.3 MTT法检测细胞活力
取对数生长期细胞接种于96孔板,培养24 h后加入既定浓度的DDP和(或)氯喹,每组设9个复孔,每孔终体积为200 μL,作用24 h后加入20 μL MTT溶液(3 g/L),将细胞移入培养箱继续培养6 h。吸去培养基,每孔内加入150 μL DMSO,振荡摇匀,用酶标仪于490 nm波长条件下测定吸光度值。
1.4 AnnexinⅤ-FITC/PI双染色流式细胞仪检测细胞凋亡
取对数生长期细胞接种于6孔板,加入既定浓度的DDP和(或)氯喹。24 h后收集对照组和处理组细胞,用不含EDTA的胰蛋白酶消化、收集总细胞,PBS洗涤2次,弃上清。加入400 μL结合缓冲液使细胞重悬,再加6 μL AnnexinⅤ-FITC,4 μL PI,室温避光孵育15 min。采用激发波长488 nm,分别以红色和绿色荧光通道检测细胞凋亡。
1.5 MDC染色并荧光显微镜定性检测自噬
将对数生长期的细胞接种于培养瓶内,待细胞贴壁且生长密度达80%~90%时弃去培养瓶内原培养液,PBS溶液洗涤。对各组细胞进行相应处理,在5%CO2、37℃饱和湿度下培养24 h后,加入0.05 mmol/L的MDC溶液孵育60 min,PBS清洗4次,于倒置荧光显微镜下进行观察和摄片(激发波长380 nm,发射波长525 nm)。
1.6 Western blot检测自噬和凋亡相关蛋白
分别收集对照组和处理组细胞,加入120 μL RIPA裂解液,EP管收集后进行超声,超声后14×103r/min离心30 min,取上清液,采用Bradford方法进行蛋白定量。上样前煮沸5 min,冰上冷却后10×103r/min离心30 s,吸取上清进行SDS-PAGE(200 V,45 min),100 V转膜1 h,0.5%(W/V)脱脂牛奶室温封闭PVDF膜1 h,一抗4℃孵育过夜,0.1%(V/V)TBST洗膜2次后,二抗室温孵育1 h,洗膜3次后采用ECL法显色。
1.7 统计学方法
2 结果
2.1 顺铂和氯喹对SGC7901细胞活力的影响
药物作用24 h后(即实验进行至48 h),氯喹组细胞形态未见变化,DDP组和联合组观察到明显的细胞皱缩,脱离贴壁等现象。药物处理前,各组细胞增殖速率无明显差异(P>0.05),药物处理24 h后(实验进行至48 h),氯喹组与对照组仍无显著性差异,但DDP组和联合组细胞增殖下降,显著低于对照组,而且联合组明显低于顺铂单药组(图1)。
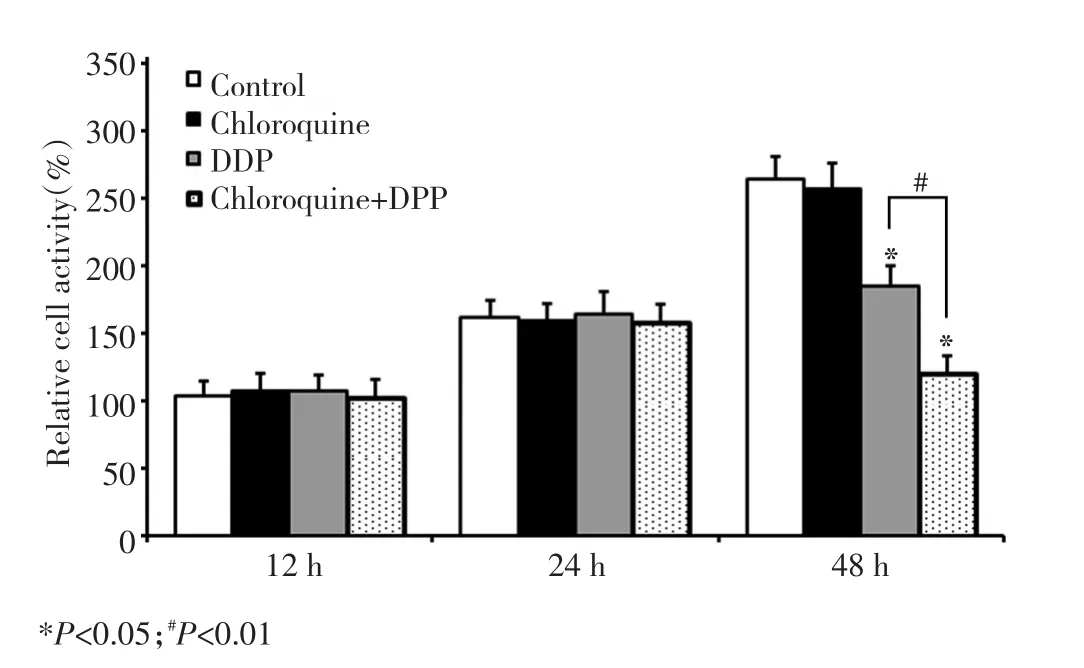
图1 药物处理后胃癌SGC7901细胞的增殖活力Figure 1 Effects of DDP and chloroquine on cell viability of SGC7901 cells
2.2 顺铂诱导SGC7901细胞发生自噬
细胞自噬被激活的典型形态学特征之一是细胞质内出现大量的酸性自噬囊泡(autophagic vacuole),而单丹磺酰戊二胺(monodansylcadaverin,MDC)可被细胞吸收并选择性聚集于自噬囊泡中。本研究在MDC染色后,通过倒置荧光显微镜观察到,药物处理24h时,与对照组(图2A)比较,DDP组(图2B)的自噬囊泡显著增多,联合自噬抑制剂氯喹后(图2C),自噬囊泡明显减少(核周的点状荧光结构即为自噬囊泡)。Western blot的结果显示,与对照组(图3A)相比,氯喹组(图3B)自噬蛋白的表达无显著性差异(P>0.05);实验浓度的DDP(图3C)作用于SGC7901细胞24 h时,Beclin-1和LC3-Ⅱ蛋白表达升高,LC3-Ⅱ/Ⅰ比值显著增加(P<0.01),联用氯喹后(图3D),LC3-Ⅱ/Ⅰ比值出现下降(P<0.01,图3)。
2.3 氯喹促进顺铂诱导SGC7901细胞凋亡
药物作用于胃癌SGC7901细胞24h后,与对照组相比,氯喹组细胞凋亡率无明显差异(1.53%±0.95%vs.1.67%±0.88%,P>0.05);DDP组(图4A)和联合组(图4B)的凋亡率均有升高,并且联合组的凋亡率(30.16%±3.54%)显著高于DDP组(21.07%±2.12%)(P<0.05,图4)。
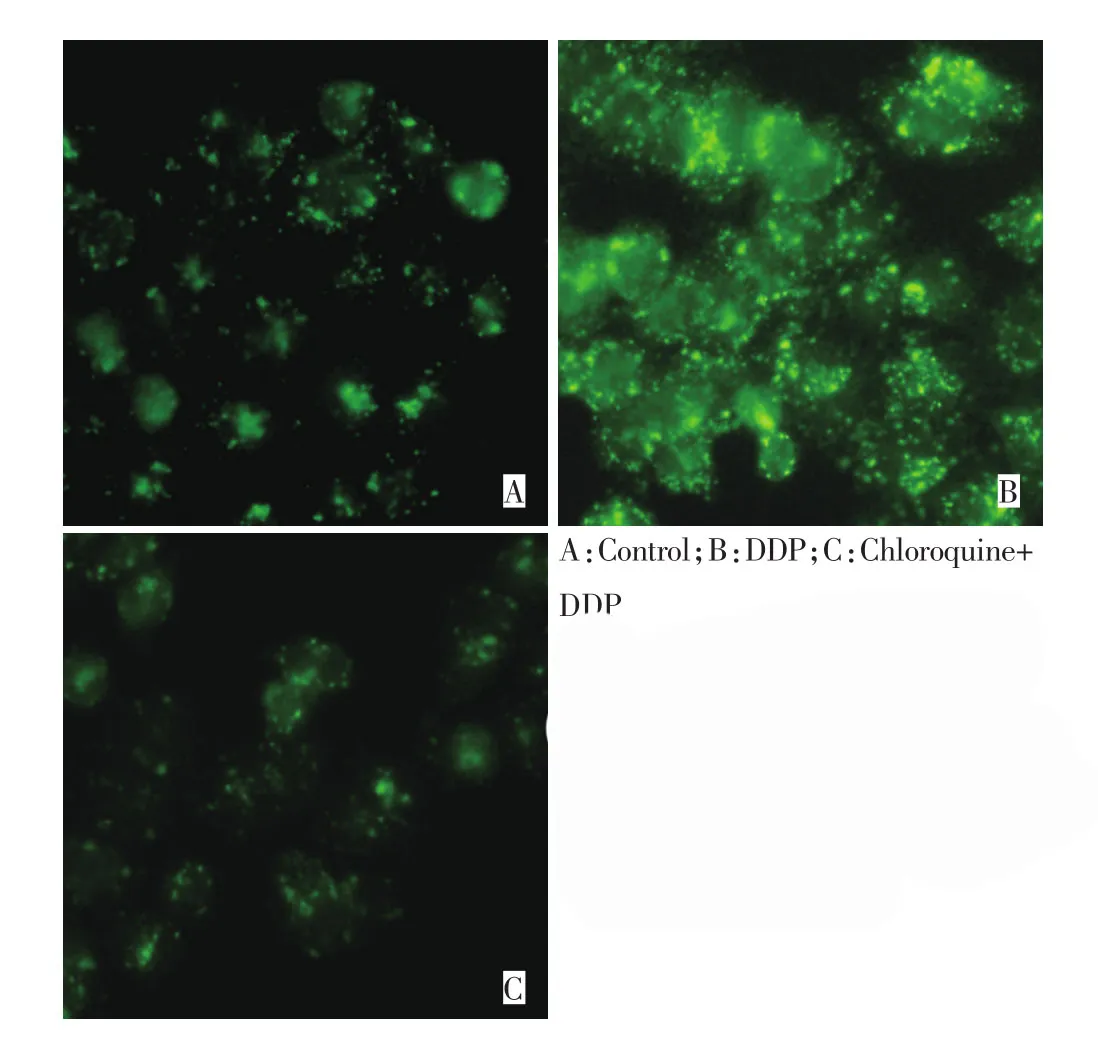
图2 荧光显微镜观察胃癌SGC7901细胞自噬囊泡(×400)Figure 2 Autophagy vesica observed by fluorescence microscopy(MDC staining,×400)
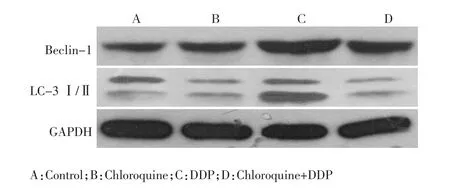
图3 Western blot检测SGC7901细胞自噬蛋白的表达Figure 3 Expression of proteins in SGC7901 cells by Western blot
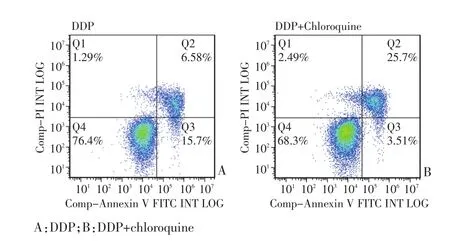
图4 AnnexinⅤ-FITC/PI双染检测SGC7901细胞凋亡Figure 4 Apoptotic rate of SGC7901 cells detected by Annexin V-FITC/PI double-staining
2.4 氯喹影响顺铂诱导的SGC7901细胞凋亡相关蛋白的表达
药物处理24 h后,与对照组相比,氯喹组凋亡相关蛋白的表达无明显差异(P>0.05);与顺铂组比较,联合组Caspase-3和P53蛋白的表达升高,Bcl-2蛋白的表达减少,均差异有统计学意义(P<0.05),但P62蛋白水平未见明显改变(P>0.05)。
3 讨论
近年来,世界大部地区胃癌发病率呈下降趋势,但权威数据表明,2008年全球仍有738 000例患者死于胃癌,在肿瘤相关性死亡中排第二位[8]。化疗是治疗胃癌的三大手段之一,顺铂作为经典有效的化疗药物,在胃癌术后辅助化疗和姑息化疗中均起着举足轻重的作用[1-3]。遗憾的是,多数患者最终因耐药而导致化疗失败,晚期胃癌的中位生存时间仍然徘徊在9.2~13.8个月[2-3]。研究表明,化疗药物和自噬调节剂的联合可以改善肿瘤患者的预后,逆转耐药、细胞自噬已经成为化疗耐药的研究热点[9-10]。Sotelo等[11]开展的Ⅱ期临床随机试验表明,与安慰剂相比,在传统的化放疗基础上,给胶质母细胞瘤术后患者每天口服氯喹150 mg,为期12个月,在一定程度上延长了患者的中位生存期。
1962年Ashford通过电子显微镜观察到了自噬现象,1963年,诺贝尔生理奖获得者Christian de Duve第一次提出了自噬的概念[12-13]。自噬(autophagy)又称为Ⅱ型程序性细胞死亡,是真核细胞通过溶酶体降解其自身的细胞质和细胞器,实行“自我消化”的一系列生化过程[14]。在这个过程中,首先是细胞质和细胞器被双层膜包裹形成自噬泡,然后再与溶酶体融合形成自噬溶酶体,最终使被包裹的细胞质和细胞器降解。自噬对肿瘤具有保护和杀伤的双重作用,但在绝大多数情况下,自噬可能起着维持肿瘤细胞生存,逃避细胞凋亡的作用[15]。
目前,自噬的检测方法主要有以下3种:电子显微镜下观察自噬体形态结构、自噬体标记蛋白LC3的检测和基于自噬性降解的“自噬潮”动态分析[16]。微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,Agt8/LC3)是自噬体膜上的标记蛋白。细胞内存在两种形式的LC3蛋白:LC3-Ⅰ和LC3-Ⅱ。LC3蛋白在合成后其C端即被Atg4蛋白酶切割变成LC3-Ⅰ,LC3-Ⅰ散在分布于细胞浆内。当自噬体形成后,LC3-Ⅰ和磷脂酰乙醇胺(phosphatidylethanolamine,PE)偶联形成LC3-Ⅱ并定位于自噬体内膜和外膜。与其他一些定位于自噬性结构膜上的Atg蛋白不同,与溶酶体融合前LC3-Ⅱ始终稳定地保留在自噬体膜上,因此被用来作为自噬体的标记,且LC3-Ⅱ的水平在某种程度上反映了自噬体的数量[17]。Ren等[7]报道,顺铂在诱导肺腺癌A549细胞凋亡的同时,也引起了自噬的发生,从而导致肿瘤细胞存活。顺铂是否能诱导胃癌细胞发生自噬,国内外鲜见报道。本研究表明5 mg/L的顺铂作用于胃癌SGC7901细胞24 h,观察到细胞增殖活力下降,细胞凋亡增加,也发现自噬囊泡明显增多,Beclin-1和LC3-Ⅱ蛋白表达显著上调。这些结果一致证实,顺铂在诱导胃癌SGC7901细胞调亡的同时,也诱导了细胞自噬的发生。
氯喹是一种自噬特异性抑制剂,具有弱化溶酶体内酸性环境,稳定溶酶体膜的功能,它能增强多种化疗药物对肿瘤细胞的杀伤作用[10,18]。在本实验中,与空白对照组相比,氯喹组自噬囊泡明显减少,LC3-Ⅱ/Ⅰ比值降低,细胞的增殖和凋亡无明显变化,提示20 μmol/L的氯喹抑制了胃癌SGC7901细胞的自噬活性,但氯喹本身不能抑制细胞生长。单独加入化疗药顺铂,诱发了胃癌SGC7901细胞自噬,在联合氯喹后,自噬活性明显下降,细胞凋亡显著增加。这些结果说明,顺铂引起的自噬是保护性自噬,部分拮抗了顺铂诱导的胃癌细胞凋亡,氯喹通过抑制自噬活性促进顺铂诱导细胞凋亡的能力。这与Li等[19]有关3-MA和苦参碱作用于胃癌细胞的研究结果相类似。本研究还发现,在顺铂联合氯喹组,Caspase-3和P53蛋白的表达上调,而凋亡抑制蛋白Bcl-2表达下降,提示氯喹特异性抑制自噬后可能通过激活P53蛋白以及灭活Bcl-2蛋白来诱导胃癌细胞启动程序性的细胞死亡,引起Caspase蛋白依赖的细胞凋亡,从而增加顺铂对胃癌SGC7901细胞的化疗敏感性。
总之,顺铂作为胃癌化疗的常用药物,在诱导胃癌SGC7901细胞凋亡的同时,也诱发了保护性自噬,加入自噬抑制剂氯喹能增强顺铂对胃癌细胞的杀伤作用,提高化疗敏感性。因此,氯喹和化疗药物的联合应用有望成为胃癌治疗的新策略,值得更进一步研究其体内作用和临床疗效。
1 Cunningham D,Allum WH,Stenning SP,et al.Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer[J].N Engl J Med,2006,355(1):11-20.
2 Van Cutsem E,Moiseyenko VM,Tjulandin S,et al.PhaseⅢstudy of docetaxel and cisplatin plus fluorouracil compared with cisplatin and fluorouracil as first-line therapy for advanced gastric cancer:a report of the V325 Study Group[J].J Clin Oncol,2006,24(31):4991-4997.
3 Bang YJ,Van Cutsem E,Feyereislova A,et al.Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer(ToGA):a phase 3,open-label,randomised controlled trial[J].Lancet,2010,376(9742):687-697.
4 Pasini F,Fraccon AP,DE Manzoni G.The role of chemotherapy in metastatic gastric cancer[J].Anticancer Res,2011,31(10):3543-3554.
5 Levine B,Kroemer G.Autophagy in the pathogenesis of disease[J].Cell,2008,132(1):27-42.
6 White E.Deconvoluting the context-dependent role for autophagy in cancer[J].Nat Rev Cancer,2012,12(6):401-410.
7 Ren JH,He WS,Nong L,et al.Acquired cisplatin resistance in human lung adenocarcinoma cells is associated with enhanced autophagy[J].Cancer Biother Radiopharm,2010,25(1):75-80.
8 Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
9 Chen S,Rehman SK,Zhang W,et al.Autophagy is a therapeutic target in anticancer drug resistance[J].Biochim Biophys Acta,2010,1806(2):220-229.
10 Levy JM,Thorburn A.Targeting autophagy during cancer therapy to improve clinical outcomes[J].Pharmacol Ther,2011,131(1):130-141.
11 Sotelo J,Briceño E,López-González MA.Adding chloroquine to conventional treatment for glioblastoma multiforme:a randomized,double-blind,placebo-controlled trial[J].Ann Intern Med,2006,144(5):337-343.
12 Ashford TP,Porter KR.Cytoplasmic components in hepatic cell lysosomes[J].J Cell Biol,1962,12:198-202.
13 Klionsky DJ.Autophagy revisited:a conversation with Christian de Duve[J].Autophagy,2008,4(6):740-743.
14 Levine B,Klionsky DJ.Development by self-digestion:molecular mechanisms and biological functions of autophagy[J].Dev Cell,2004,6(4):463-477.
15 Mathew R,Karantza-Wadsworth V,White E.Role of autophagy in cancer[J].Nat Rev Cancer,2007,7(12):961-967.
16 Klionsky DJ,Abdalla FC,Abeliovich H,et al.Guidelines for the use and interpretation of assays for monitoring autophagy[J].Autophagy,2012,8(4):445-544.
17 Kimura S,Fujita N,Noda T,et al.Monitoring autophagy in mammalian cultured cells through the dynamics of LC3[J].Methods Enzymol,2009,452:1-12.
18 Kimura T,Takabatake Y,Takahashi A,et al.Chloroquine in cancer therapy:a double-edged sword of autophagy[J].Cancer Res,2013,73(1):3-7.
19 Li Y,Zhang J,Ma H,et al.Protective role of autophagy in matrine induced gastric cancer cell death[J].Int J Oncol,2013,42(4):1417-1426.
(2013-03-29收稿)
(2013-06-01修回)
Chloroquine promotes DDP-induced apoptosis in human gastric cancer cell line SGC7901
Huiqing ZHANG1,Nian FANG2,Shan LU1,Bo HE1,Yiye WAN1
Huiqing ZHANG;E-mail:hqzhang888@sina.com
1The Third Department of Medical Oncology,Jiangxi Provincial Tumor Hospital,Nanchang 330029,China
2Gastrointestinal Department of Internal Medicine,The FourthAffiliated Hospital of Nanchang University,Nanchang,330006,China
Objective:To investigate the mechanism and effects of autophagy on cisplatin(DDP)-induced apoptosis in human gastric cancer cell line SGC7901.Methods:Cell proliferation was determined by an MTT assay after the SGC7901 cells were treated with DDP and/or chloroquine.Cell apoptosis was determined by flow cytometry.Autophagy and related protein expressions were detected by Western blot.Autophagy was quantitatively analyzed by fluorescence microscopy after monodansylcadaverine staining was performed.Results:The cells were treated with 5 mg/L of DDP for 24 h,the rate of cell apoptosis was(21.07±2.12)%.Autophagy,characterized by an increase in the number of autophagic vesicles and LC3-II protein level,was observed in DDP-treated cells.After autophagy was inhibited by chloroquine,the rate of cell apoptosis was increased to(30.16±3.54)%.In addition,caspase-3 and P53 protein levels were increased,but Bcl-2 protein was decreased.Conclusion:Autophagy protected human gastric cancer cell line SGC7901 from DDP-induced apoptosis.In addition,the inhibition of autophagy could promote apoptosis.The combined therapy of DDP and chloroquine may be a promising therapeutic strategy for gastric cancer.
autophagy,cisplatin,chloroquine,apoptosis,gastric cancer
10.3969/j.issn.1000-8179.20130507
①江西省肿瘤医院内三科(南昌市330029);②南昌大学第四附属医院消化内科
*本文课题受江西省青年自然基金项目(编号:20122BAB215029)资助
张慧卿 hqzhang888@sina.com
This study was supported by the Jiangxi Province Youth Science Foundation(No.20122BAB215029)
(本文编辑:周晓颖)

