pH值和Fe、Cd处理对水稻根际及根表Fe、Cd吸附行为的影响
刘丹青,陈 雪,杨亚洲,王 淑,李玉姣,胡 浩,张春华,葛 滢,*
(1.南京农业大学资源与环境科学学院,南京 210095;2.中国科学院南京土壤研究所,土壤与农业可持续发展国家重点实验室,南京 210008;3.南京农业大学生命科学实验中心,元素与生命科学研究合作示范试验室,南京 210095)
控制稻田土壤Cd污染、减少土壤中Cd向水稻体内的迁移一直以来是国内外学者研究的热点问题。降低水稻根际Cd活性是解决稻田Cd污染物进入水稻体内的重要途径之一。以往研究表明,土壤pH值、Eh值、有机质、微生物、其他重金属离子及根系分泌物等因素对土壤及水稻根际Cd的有效性具有重要影响[1-3]。例如,Chuan等研究表明污染土壤中的重金属Pb、Cd和Zn的溶解性受土壤pH值和Eh值影响显著,碱性土壤(pH值=8.0)条件下重金属溶解度降低,而在酸性土壤(pH值=5.0、pH值=3.3)中,重金属可溶性增加;并且随着氧化势的降低,重金属可溶性也增强[4]。Kashem等在研究肥料施用对土壤重金属Cd、Ni、Zn的可溶性和生物有效性时发现,增施有机肥可显著降低土壤pH值,增强土壤溶液中重金属可溶性,促进可溶性重金属进入植株体内,但其效应随土壤、植株类型和重金属含量的不同而不同[5]。
除此之外,长期处于淹水条件下的水稻根系表面形成的大量铁膜也是影响水稻Cd有效性的重要因素之一,并且根系氧化作用和根际Fe(II)浓度是水稻根表铁膜形成的两个重要条件[6-7]。铁膜与水稻对Fe、Cd的吸收密切相关,但在不同条件下其影响并不一致。例如,在水培试验中,刘敏超等发现,不同水稻基因型根膜Fe含量与Fe膜富集的Cd含量、根部和地上部Cd含量显著正相关,说明根表Fe膜可以促进Cd的吸收[8];而Liu等研究则发现Fe膜可以减少根部Cd含量,但Fe膜富集的Cd含量较低,因此阻挡作用有限,根部组织是富集Cd的主要器官[9]。在土培试验中,有研究表明水稻根表形成的铁膜会成为土壤Cd进入水稻根系的重要屏障,进而减少地上部对Cd的吸收[10];而也有研究表明根表铁膜对水稻根部和地上部Cd吸收的影响很小[11]。Weiss等、纪雄辉等、陈莉娜等的试验结果表明,植物根表吸附沉积Fe(即根表Fe膜)的组成和数量与根际土壤Eh、pH值有显著的相关性[12-14],根表Fe膜对Cd的吸附也与根际pH值显著相关[14]。由此看来,在水稻基因型、根际Eh、pH值条件、以及Fe2+浓度等因素的影响下,水稻根表铁膜对水稻根系Cd吸附和吸收的影响可以表现为促进、抑制或者影响不大,但是产生这些不同效应的具体机制仍需深入探讨。
因此,本试验采用蛭石-营养液联合培养,利用蛭石模拟水稻根际环境,测定并分析Fe、Cd在水稻根表、蛭石表面的形态分布与含量,研究不同pH值及Fe、Cd处理下,水稻根系和蛭石表面对Fe、Cd的吸附以及水稻对Fe、Cd吸收的规律,并比较蛭石表面吸附与水稻根表吸附机制的差异,以期阐明水稻根际性状对Fe、Cd有效性的影响机理。
1 材料与方法
1.1 试验材料
供试品种为嘉兴市农业科学院培育的粳稻品种N07-63。
1.2 试验设计
晒种后选取健康饱满的种子用15%H2O2溶液消毒30 min,用自来水和去离子水充分洗净浸泡24 h后,平铺于塑料框中并置于盛去离子水的中转箱上。38℃破胸20 h,32℃催芽。待芽鞘长至2 cm左右时,开始光照(日12 h,32℃;夜12 h,27—28℃)。两周左右后转移到温室培养,等水稻苗长至4叶期时将其转移至营养液-蛭石联合培养的塑料盆钵内培养两周。盆钵中部为尼龙网袋(300目),内装200 g蛭石代表根际,网袋外为营养液,代表非根际。为探讨不同pH值和Fe、Cd浓度对根表铁膜形成及铁膜对Fe、Cd吸附吸收的影响,设对照、增Cd和增Fe 3组处理:
(1)对照 pH 值 4.5、5.0、5.5、6.0、6.5、7.0、7.5 的完全营养液+Cd1+Fe1
(2)增 Cd pH 值 4.5、5.5、6.5、7.5 的完全营养液+Cd2+Fe1
(3)增 Fe pH 值 4.5、5.5、6.5、7.5 的完全营养液+Cd1+Fe2
其中Fe1和 Fe2为30 mg/L和50 mg/L FeSO4溶液,Cd1和Cd2为0.5 mg/L和0.9 mg/L CdCl2溶液。完全营养液成分(单位mg/L)为:Ca(NO3)2·4H2O 20;KH2PO410;K2SO420;CaCl2·2H2O 40;MgSO4·7H2O 40;MnCl2·4H2O 0.5;(NH4)6·Mo7O24·4H2O 0.05;H3BO30.2;ZnSO4·7H2O 0.01;CuSO4·5H2O 0.01;Fe-Na2EDTA 2.0;Na2SiO3·9H2O 0.1。每个处理3个重复,处理过程中每隔2d换1次营养液。在每次换营养液前后,记录下每个盆钵的重量,计算蒸腾量。加Fe处理1周后进行Cd处理。Cd处理1周后收获样品并进行相关指标测定。
1.3 测定项目与方法
1.3.1 根际环境指标及水稻生物量测定
水稻样品收获前测定蛭石内的pH值和Eh。pH值和Eh值用复合电极和铂电极-甘汞电极在PHS-3C型酸度计测定,每次pH值和Eh测定前,先用pH值标准溶液校正仪器,同时对铂电极作脱膜处理,再用新鲜配制的zorbell溶液对电极进行校正,测定时将电极插入蛭石-水体系中平衡20 min,待读数稳定后再取测定值。样品收获后,一部分测定水稻地上部和根部的鲜重、根长、株高,另一部分在90℃下杀青15 min,70℃下烘干至恒重,计算根部和地上部的含水率。
1.3.2 蛭石表面Fe、Cd分级提取及含量测定
将水稻收获后的蛭石混匀,取1.0 g左右的蛭石于100 mL离心管中。形态提取方法是在参照Weiss等[15]和Salirian等[16]的方法基础上有所改进,采用表1中所列提取条件进行Fe、Cd交换态、非晶态和晶态3种形态的逐级提取。振荡条件均设为125 r/min、30 min,离心条件为2500 r/min、20 min。Fe、Cd含量采用ICP-AES(Perkin Elmer Optimal 2100 DV)测定。
1.3.3 水稻根表Fe、Cd分级提取及含量测定
取1.0 g左右的水稻根(生物量较少的取0.5 g左右)于100 mL离心管中,采用表1中所列的提取条件进行Fe、Cd交换态和非晶态两种形态的逐级提取。振荡条件设为125 r/min、30 min,离心条件为2500 r/min、20 min。Fe、Cd含量采用ICP-AES(Perkin Elmer Optimal 2100 DV)测定。
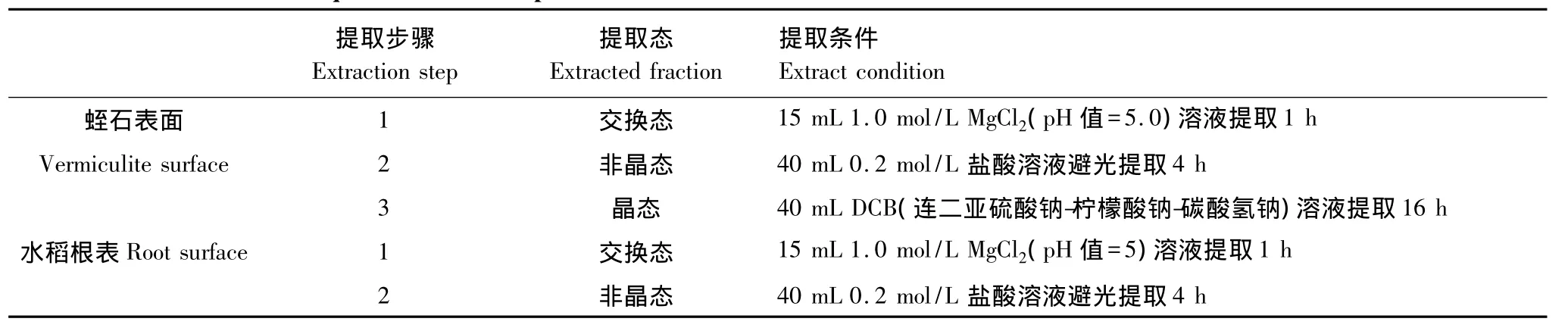
表1 蛭石表面和水稻根表Fe、Cd连续提取步骤Table1 Sequential extraction procedures for Fe and Cd on the surface of vermiculite and rice root surface
1.3.4 水稻根部和地上部的Fe、Cd含量测定
将水稻根部和地上部在90℃下杀青15 min,70℃下烘干至恒重,剪碎。称0.100 g左右干样粉末于消煮管内,加2 mL浓硝酸,采用微波内插管法进行消煮。Fe、Cd含量采用ICP-AES(Perkin Elmer Optimal 2100 DV)测定。
1.4 数据分析
采用SPSS13.0统计分析软件进行数据分析及差异显著性检验,采用SigmaPlot10.0进行数据分析与绘图。
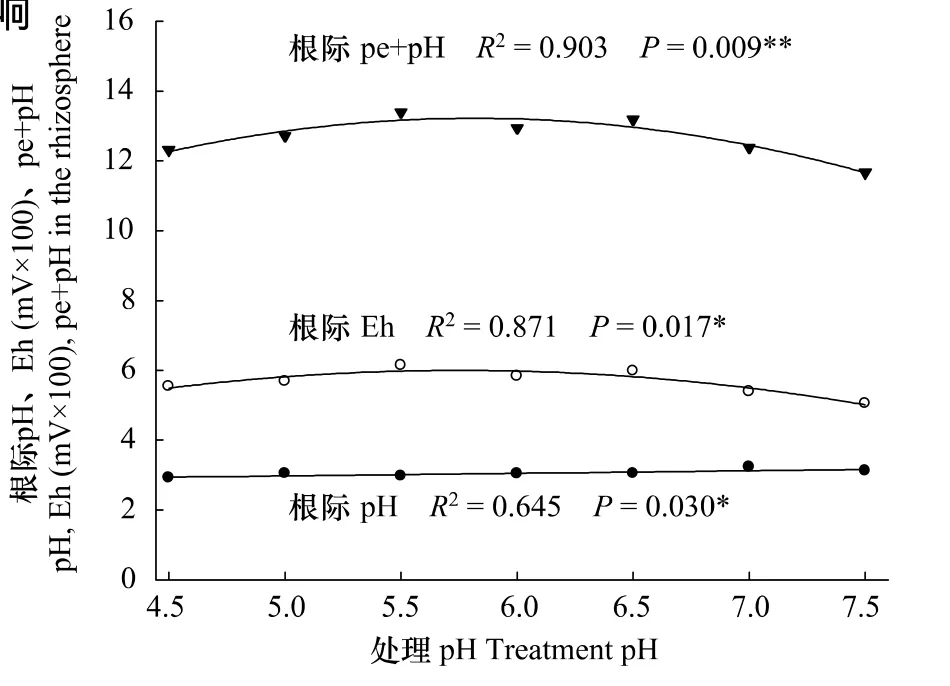
图1 不同pH值对水稻根际pH值、Eh和pe+pH的影响Fig.1 Effects of pH on pH,Eh and pe+pH in the rhizosphere of rice
2 结果与分析
2.1 不同处理对水稻根际氧化还原状况及幼苗生长的影响
水稻根系分泌的有机酸和新生态氧通过改变根际pH值、Eh、pe+pH值而影响根际氧化还原状况。图1表明,根际pH值与处理pH值间有显著的线性关系。当处理pH值由4.5上升到7.5时,水稻根际pH值由2.92上升到3.12,各处理间差异在 P< 0.05的置信区间内不显著(P=0.595)。由此说明在水稻培养期,水稻根际酸度比培养液酸度更强。除此之外,根际Eh、pe+pH与处理pH值间存在显著的二次回归关系。当处理pH值从4.5上升到5.5或6.5时,Eh由550 mV左右上升到610 mV左右,pe+pH由13.8上升到14.8左右;随pH值值继续增大,Eh和pe+pH逐渐下降到500 mV和13.1。这说明水稻根际泌氧在 pH值为5.5—6.5时最多。
营养液中的Fe、Cd浓度也影响着水稻根际pH值、Eh和pe+pH。由村料与方法中可知,增Cd和增Fe处理分别设置了4个pH值,但是由于pH值对水稻的生长效应影响并不显著(P>0.05),而增Cd,增Fe的效应比较显著,表2中所列的对照,增Cd和增Fe处理下各指标值是4.5,5.5,6.5,7.5这4个pH值下观测值的平均值。表2表明,与对照相比,增Cd可以降低水稻根际Eh和提高根际pH值,但差异不显著;增Fe可以极显著地提高水稻根际Eh和降低根际pH值。与对照相比,增Cd和增Fe处理后,水稻株高、地上部干重、地下部干重和蒸腾量均有所降低。这说明在水稻正常养分供应水平上,不同pH值处理下,增加Fe、Cd浓度均会对水稻生长产生胁迫作用。
2.2 不同处理对蛭石Fe、Cd吸附的影响
蛭石是具有表面电荷的硅酸盐矿物,有着良好的离子吸附性和交换性。图2表明,蛭石表面吸附有晶态Fe、非晶Fe、交换Fe及非晶Cd、交换Cd,与此同时,晶态Fe、交换Fe、非晶Cd和交换Cd既与溶液pH值有显著的二次回归关系,又与水稻根际Eh间存在相应的线性回归和二次回归关系。
蛭石表面吸附的晶态Fe含量在13.38—16.11 mg/kg之间,在处理pH值6.0时最低,在处理pH值7.5时最高,占蛭石吸附Fe总量的78%—87%,并与根际pe+pH有显著的相关性(r=0.753*)。pH值越趋近于6.0,晶态Fe和交换Fe含量越低;而非晶Fe含量越高。
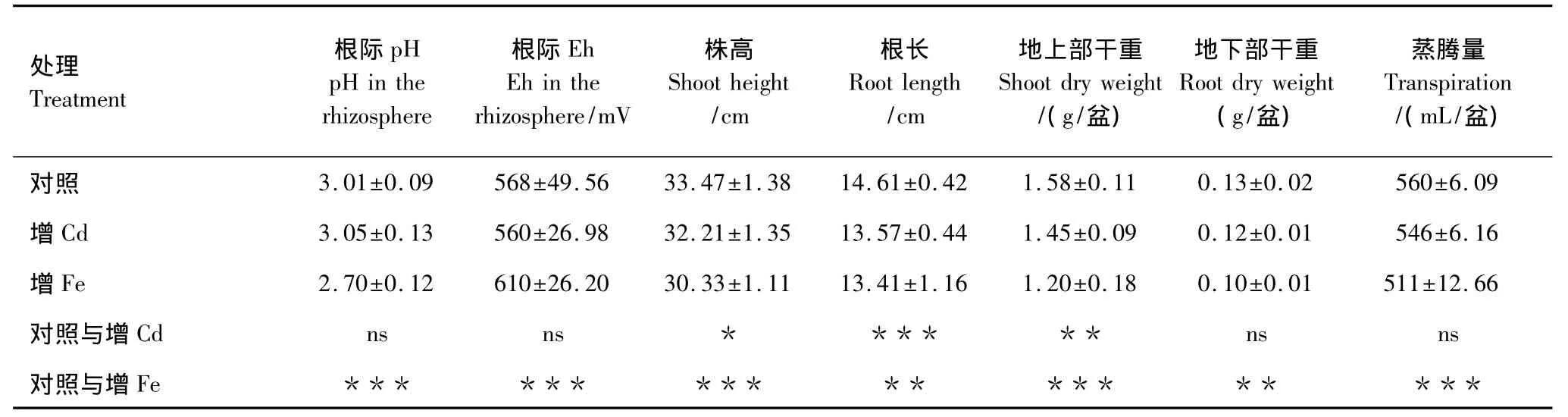
表2 培养液不同Cd,Fe处理对水稻根际pH值,Eh及生长效应的比较Table2 Comparisons of different Cd,Fe concentration treatment effects on pH,Eh in the rhizosphere and plant growth
蛭石表面没有吸附晶态Cd,非晶Cd含量在5.83—7.70 mg/kg之间,在处理pH值5.5时最低,在处理pH值7.5时最高,占沉淀Cd总量的93%—98%。它与非晶态Fe不一样,与处理pH值、Eh都有较好的相关性,它们可能是一些吸附较弱的M(OH)2、MCO3化合物。
蛭石表面的交换 Fe含量为0.102—0.203 g/kg之间,约占总 Fe量的0.6%—1.1%;交换 Cd含量为0.096—0.603 g/kg之间,约占总Cd量的1.6%—7.3%。它们与处理pH值都有很好的相关性(pFe=0.002,pCd=0.023),由于它们同与根际Eh显著相关,由此看来,交换Fe和交换Cd除受蛭石表面的电性引力吸附外,还可能受表面氧化Fe吸附沉积的影响。

图2 不同处理pH值对蛭石Fe、Cd吸附的影响Fig.2 Effects of pH on the Fe,Cd adsorption on the surfaces of vermiculite
不同Fe、Cd浓度对蛭石表面Fe、Cd吸附也有一定的影响。如表3所示,与对照相比,增Cd处理后蛭石表面交换态Cd,占主要形态的非晶态Cd和总Cd含量均降低,其中非晶态Cd和总Cd含量下降显著(P<0.05);增Fe处理后蛭石表面交换态Fe,非晶态Fe均增加,而晶态Fe、总Fe和总Cd含量稍有减少。由于营养液增Cd处理的0.9 mg/L Cd浓度高于原始浓度0.5 mg/L的4/5,增Fe处理的50 mg/L Fe浓度高于原始浓度30 mg/L的2/3,而固体表面对溶液离子的吸附数量在一定范围内随溶液浓度增加而增高,直至两者达到平衡为止,因此增Fe、增Cd后蛭石中减少的吸附量可能一部分被根表所截获,另一部分被水稻所吸收。
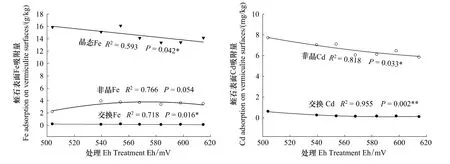
图3 不同处理Eh对蛭石Fe、Cd吸附的影响Fig.3 Effects of Eh on the Fe,Cd adsorption on the surface of vermiculite
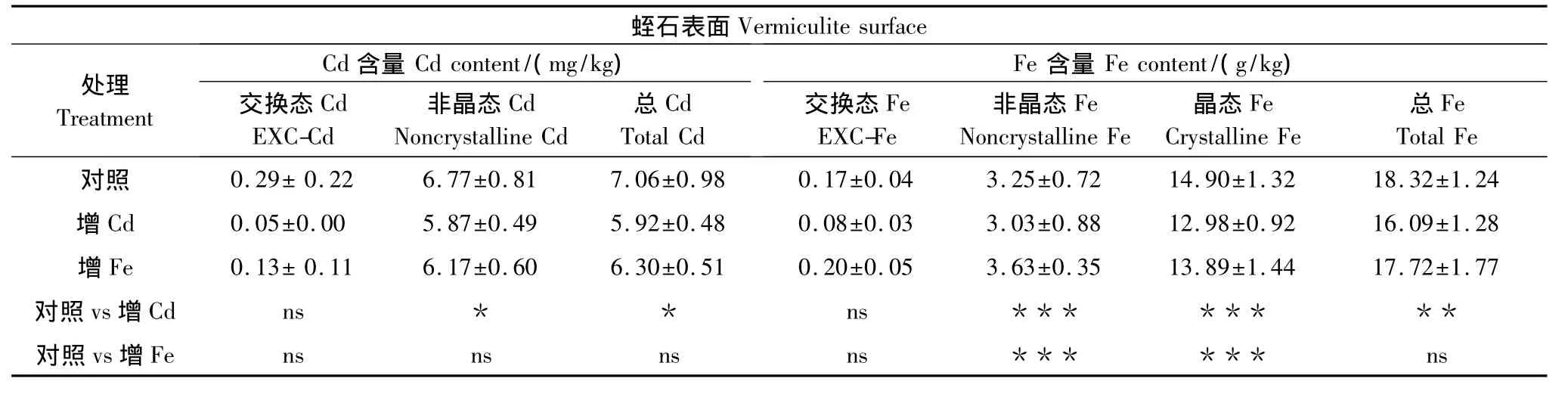
表3 Cd、Fe处理对蛭石表面Cd、Fe吸附的影响Table3 Effects of Cd,Fe addition on Cd,Fe adsorption on vermiculite surfaces
2.3 不同处理对水稻根系表面Fe、Cd吸附的影响
图4显示了不同处理pH值、Eh下水稻对根表Fe、Cd吸附的影响。试验表明,水稻根表吸附沉积有交换Fe、非晶Fe和交换Cd。其中,非晶Fe含量为35.07—47.65 g/kg,约占根表吸附总Fe量的90%—95%,它在处理pH值4.5时含量最高,在处理pH值6.0时含量最低;同时它与处理pH值间有显著的二次曲线相关,与Eh间有很好的线性关系。这些相关关系与蛭石表面吸附的晶态Fe一样,表明根表吸附的非晶Fe也是一种氧化沉积。根表交换Fe含量为2.41—5.05 g/kg,交换Cd含量为52.97—94.59 mg/kg,它们与处理pH值间也有显著的回归关系,说明它们也是根表的电性吸附。对比水稻根表与蛭石表面的Fe、Cd吸附行为,就不难看出两者间有着类似的机制,同受根际氧化还原状况和pH值影响。不过,与蛭石表面不同的是根系表面上没有晶态Fe和非晶Cd的沉积,根表交换Fe和交换Cd也与根际Eh没有显著相关性,这些不同显然与根系表面的生物学性质及功能有关。
不同Fe、Cd浓度对水稻根表Fe、Cd吸附的影响见表4。与对照相比,培养液增Cd处理可显著增加根表交换态Cd,增Fe处理可显著增加根表交换态Fe,降低非晶Fe,总Fe和交换态Cd含量。这些差异反映了根际Eh、pH值对Fe、Cd浓度的影响。由于培养液的Fe、Cd离子是随质流经过氧化态根际(Eh在558 mV以上),然后再在根表富集,与对照比较,增Cd处理使根际 Eh降低,pH值增高,蛭石表面总Cd吸附量减少;增Fe处理使Eh升高,pH值降低,蛭石表面总Fe吸附量减少(表2,表3)。前者可降低根际溶液Cd浓度并增加根表Cd的吸附量,对溶液Fe浓度和根表吸附量影响不大;后者可增加溶液Fe浓度,而降低根表吸附量。这些结果反映了Fe、Cd胁迫作用下水稻的应对机理。
3 讨论
在水稻培养期,水稻根际酸度比培养液酸度更强,这与前人所报道的相一致。如,陈莉娜等水稻水培试验表明,不同pH值处理下降低的根际pH值达1.5—4.3个单位,增加的Eh可多达100 mV以上[14]。影响植株根际酸化的原因可能有3个:(1)植物根系对阴阳离子的吸收速率有差异;(2)根系呼吸产生CO2;(3)有机酸、H+、氨基酸等物质的分泌[17-19]。大量水培和土培试验表明,植物根系会分泌大量的低分子量有机酸,如苹果酸、柠檬酸和草酸等[20-21]。这些有机酸将有利于植株对营养元素的吸收(如Fe,P等元素)和重金属解毒(如Al),有利于缓解植株根系环境的厌氧胁迫,有利于增加矿化和微生物富集[22-24]。
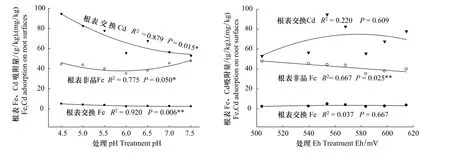
图4 不同p H值、Eh对根表Fe、Cd吸附的影响Fig.4 Effects of p H,Eh on Fe,Cd adsorption on root surfaces

表4 Cd、Fe处理对根系表面Cd、Fe吸附的影响Table4 Effects of Cd,Fe addition on their adsorption on root surfaces
从根系与蛭石两表面吸附行为的比较中可以看出,根系表面对Fe、Cd的吸附作用与矿物表面物化反应类似,吸附物的组分和数量既受根际Eh、pH值制约,又受根际Fe、Cd浓度的影响。蛭石对根际溶液Fe的吸附是一种物理化学吸附,它与蛭石表面电化学性质及溶液离子的化学性质有关。结合表3、4、5可知,非晶态Fe是蛭石和根系表面吸附的主要形态,增Cd,增Fe处理对蛭石表面非晶态Fe的影响显著高于根系表面;而pH处理对根系表面交换态Fe,交换态Cd的影响显著高于其对蛭石表面的影响。这些不同反映了两个表面性质的差异。根系表面能分泌有机酸和新生态氧,不同处理影响着分泌物的成分和数量,由此影响着根际溶液的Eh、pH值(图1),继而影响根际Fe、Cd浓度,所以说,两个表面间的溶液Fe、Cd浓度和Eh、pH值都是由根系表面控制。同时,溶液浓度与表面吸附量依存于吸附平衡的关系,这样,处于同一根际的两个表面,就会因为吸附性质的不同而带来吸附组分和数量的差别,也就导致增Cd和增Fe效应产生明显的差异。
蛭石表面是含铁镁硅酸盐矿物断面,对溶液Fe、Cd离子有高的吸附结合能,因此在它的表面上能形成紧密吸持的晶态Fe和吸附态非晶态Cd,而这些组分没有在根表生成。有研究表明水稻根系有泌氧和泌酸的能力,在根际微区域可形成一个氧化态根圈,由此带来根际溶液的pe+pH高于土壤溶液,而pH值则低于土壤溶液[25]。因此可以推测,本实验中模拟根际环境的蛭石表面氧化势和酸度也始终低于根表面,且离根表越远降低程度越大。这就导致与蛭石表面吸附作用平衡的溶液Fe、Cd浓度(活度)低于根表溶液浓度(活度)。
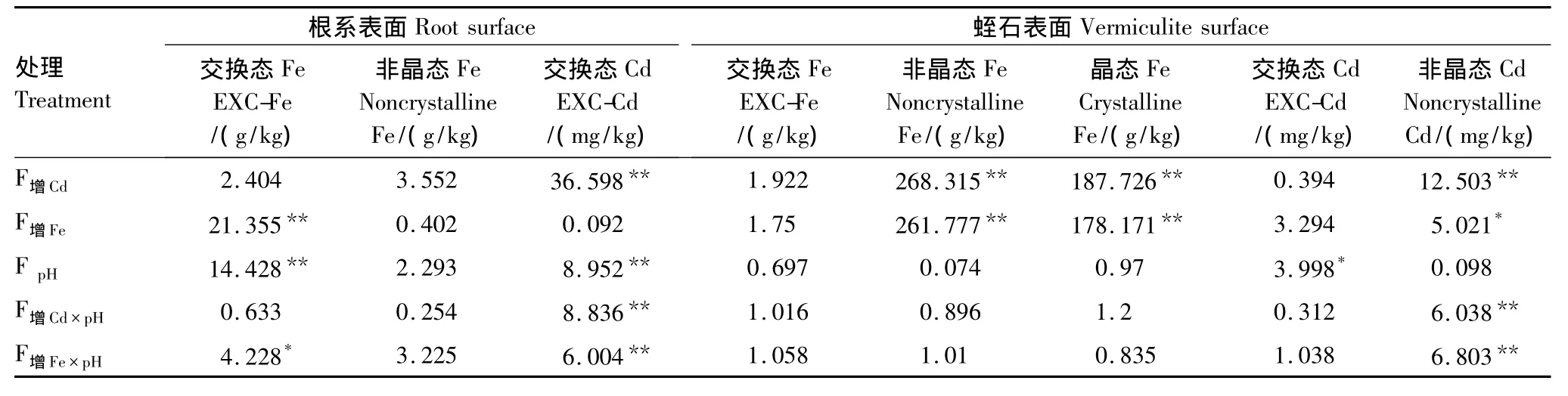
表5 不同处理对根表和蛭石表面的Fe、Cd吸附影响的比较Table5 Comparisons of different treatment effects on Fe,Cd adsorption to rice root and vermiculite surfaces
根表面由根表皮细胞组成,细胞壁上有多种官能团,细胞膜上则有养分通道,故根表面兼有养分吸附和吸收的双重功能。水稻为应对不同的根际环境,可在不同Fe、Cd浓度处理下,通过根系分泌物改变根际Eh、pH值和调控溶液Fe、Cd浓度,使溶液Fe、Cd既可在氧化势和酸度较强的根表吸附沉积,又能随质流进入根内。对照中水稻地上部和根内 Fe积累量分别为(5.79±0.48)、(7.47±0.58)mg/盆,增 Cd 处理分别为(4.48±1.25)、(7.05±1.03)mg/盆,增 Fe 处理分别为(3.98±0.79)、(6.73±0.41)mg/盆。对照中水稻地上部和根内 Cd 积累量分别为(12.09±1.18)、(2.88±0.37)μg/盆,增Cd 处理分别为(11.76±1.28)、(2.71±0.59)μg/盆,增 Fe处理分别为(8.66±0.96)、(1.64±0.14)μg/盆。结合根表吸附数据(表 4)可知,增 Cd 处理比对照增加了Cd、Fe在根表的吸附、并减少Cd、Fe的摄入;增Fe处理则在降低根表面Fe、Cd吸附的同时减少Fe、Cd吸收。这些结果与水稻根表面应对Fe、Cd胁迫的功能有关。
4 结论
4.1 水稻根际pH值,Eh和pe+pH与处理pH值间分别存在显著的线性和二次回归关系。处理pH值在5.5—6.5时,Eh和pe+pH分别达到600 mV和14.8的最高值,氧化性最强。营养液不同Fe、Cd浓度也影响着根际的pH值、Eh,与对照相比,增Cd处理可降低Eh和提高pH值,增Fe处理可增加Eh和降低pH值。
4.2 根表与蛭石对Fe、Cd的吸附机制不同。蛭石表面吸附Fe以晶形Fe为主,占到总沉积Fe的73%—87%,水稻根表沉积Fe以非晶Fe为主,占总沉积Fe的91%—95%,它们与处理pH值、根际Eh和pe+pH均有显著的二次或线性线回归关系。
4.3 不同浓度处理通过根际Eh、pH值的升降来影响根表Fe、Cd吸附。与对照相比,增Fe和增Cd处理都对水稻生长产生胁迫。增Cd处理表现为降低根际Eh和升高pH值来降低溶液Cd浓度,在增加根表Cd吸附量的同时减少Cd的吸收;增Fe处理升高根际Eh和降低pH值,虽带来溶液Fe、Cd浓度的增加,但由于H+的竞争作用,根表Fe、Cd吸附量和水稻Fe、Cd的吸收量都有所减少。这是水稻应对Fe、Cd浓度胁迫的生理反应。
[1] Zheng SJ,Hu A T.Effects of flooding on the transformation of cadmium fractions in contaminated soils.Acta Scientiae Circumstantiae,1995,15(2):142-147.
[2] Wei SQ,Qing CL,Mu Z J.Transport of cadmium in purple soil under simulated submerging conditions and the influencing factors.Acta Scientiae Circumsantiae,2002,22(6):600-700.
[3] Ge Y,Li Y C,Zhou CS,Zong L G.Preliminary investigation on adsorption and desorption of Cd in soil with different reduction states.Ecology and Environment,2006,15(4):73-734.
[4] Chuan M C,Shu G Y,Liu JC.Solubility of heavy metals in a contaminated soil:effects of redox potential and pH.Water,Air,and Soil Pollution,1996,90(3/4):543-556.
[5] Kashem M A,Singh B R.The effect of fertilizer additions on the solubility and plant-availability of Cd,Ni and Zn in soil.Nutrient Cycling in Agroecosystems,2002,62(3):287-296.
[6] Crowder A A,Macfis SM.Seasonal deposition of ferric hydroxide plaque on roots of wetland plants.Canadian Journal of Botany,1986,64(9):2120-2124.
[7] Fu Y Q,Yu Z W,Cai K Z,Shen H.Mechanisms of iron plaque formation on root surface of rice plants and their ecological and environmental effects:a review.Plant Nutrition and Fertilizer Science,2010,16(6):1527-1534.
[8] Liu M C,Li H F,Xia L J,Yang L S.Differences of cadmium uptake by rice genotypes and relationship between the iron oxide plaque and cadmium uptake.Acta Scientiae Circumstantiae,2000,20(5):592-596.
[9] Liu H J,Zhang J L,Zhang F S.Role of iron plaque in Cd uptake by and translocation within rice(Oryza sativa L.)seedlings grown in solution culture.Environmental and Experimental Botany,2007,59(3):314-320.
[10] Liu JG,Cao CX,Wong M H,Zhang Z J,Chai Y H.Variations between rice cultivars in iron and manganese plaque on roots and the relation with plant cadmium uptake.Journal of Environmental Sciences,2010,22(7):1067-1072.
[11] Liu H J,Zhang JL,Peter C,Zhang F S.Influence of iron plaque on uptake and accumulation of Cd by rice(Oryza sativa L.)seedlings grown in soil.Science of the Total Environment,2008,394(2/3):361-368.
[12] Weiss JV,Emerson D,Megonigal J P.Rhizosphere iron(III)deposition and reduction in a Juncus effusus L.-dominated wetland.Soil Science Society of America Journal,2005,69(6):1861-1870.
[13] Ji X H,Liang Y C,Lu Y H,Liao Y L,Nie J,Zheng SX,Li Z J.The effect of water management on the mechanism and rate of uptake and accumulation of cadmium by rice growing in polluted paddy soil.Acta Ecologica Sinica,2007,27(9):3930-3939.
[14] Chen L N,Ge Y,Zhang C H,Zhou Q S.Effect of submergence on the bioavailability of Cd in a Red Soil.Journal of Agro-Environment Science,2009,28(11):2333-2337.
[15] Weiss JV,Emerson D,Megonigal JP.Geochemical control of microbial Fe(III)reduction potential in wetlands:comparison of the rhizosphere to non-rhizosphere soil.FEMSMicrobiology Ecology,2004,48(1):89-100.
[16] Salirian R C,Leigh A S,Edward DB,Richard T B.A sequential extraction procedure for acid sulfate soils:partitioning of iron.Geoderma,2010,155(3/4):224-230.
[17] Tao S,Chen Y J,Xu F L,Cao J,Li B G.Changes of copper speciation in maize rhizosphere soil.Environmental Pollution,2003,122(3):447-454.
[18] Song A L,Li Z J,Zhang J,Xue G F,Fan F L,Liang Y C.Silicon-enhanced resistance to cadmium toxicity in Brassica chinensis L.is attributed to Si-suppressed cadmium uptake and transport and Si-enhanced antioxidant defense capacity.Journal of Hazardous Materials,2009,172(1):74-83.
[19] Zeng F R.Physiological and Molecular Mechanisms of Chromium Stress and Tolerance in Rice[D].Zhejiang:Zhenjiang University,2010.
[20] Ma JF,Zheng SJ,Matsumoto H.Specific secretion of citric acid induced by al stress in Cassia tora L.Plant Cell Physiology,1997,38(9):1019-1025.
[21] Zhu X F,Zheng C,Hu Y T,Jiang T,Liu Y,Dong N Y,Yang J L,Zheng SJ.Cadmium-induced oxalate secretion from root apex is associated with cadmium exclusion and resistance in Lycopersicon esulentum.Plant Cell and Environment,2011,34(7):1055-1064.
[22] David L J.Organic acids in the rhizosphere-a critical review.Plant and Soil,1998,205(1):25-44.
[23] Felix D D,Donald A P.Root exudates as mediators of mineral acquisition in low-nutrient environments.Plant and Soil,2002,245(1):35-37.
[24] Uren N C.Types,Amounts,and Possible Functions of Compounds Released into the Rhizosphere by Soil-Grown Plants.The Rhizosphere:CRC Press,2007:1-21.
[25] Li Q K.Paddy Soils in China.Beijing:Science Press,1992:413-421.
参考文献:
[1] 郑绍建,胡霭堂.淹水对污染土壤镉形态转化的影响.环境科学学报,1995,15(2):142-147.
[2] 魏世强,青长乐,木志坚.模拟淹水条件下紫色土镉的释放特征及影响因素.环境科学学报,2002,22(6):600-700.
[3] 葛滢,李义纯,周权锁,宗良纲.淹水还原作用下土壤Cd的吸附与解吸特征的初步探讨.生态环境,2006,15(4):73-734.
[7] 傅友强,于智卫,蔡昆争,沈宏.水稻根表铁膜形成机制及其生态环境效应.植物营养与肥料学报,2010,16(6):1527-1534.
[8] 刘敏超,李花粉,夏立江,杨林书.不同基因型水稻吸镉差异及其与根表铁氧化物胶膜的关系.环境科学学报,2000,20(5):592-596.
[13] 纪雄辉,梁永超,鲁艳红,廖育林,聂军,郑圣先,李兆军.污染稻田水分管理对水稻吸收积累镉的影响及其作用机理.生态学报,2007,27(9):3930-3939.
[14] 陈莉娜,葛滢,张春华,周权锁.淹水还原作用对红壤Cd生物有效性的影响.农业环境科学学报,2009,28(11):2333-2337.
[19] 曾凡荣.水稻铬毒害和耐性的生理与分子机理研究[D].浙江:浙江大学,2010.
[25] 李庆逵.中国水稻土.北京:科学出版社,1992:413-421.

