粪便基因型检测幽门螺杆菌对克拉霉素耐药性的研究*
秦幼娟 周晓颖 赵 冰 刘 伟 潘晓林 张国新
南京医科大学第一附属医院消化科(210029)
幽门螺杆菌(Hp)是慢性胃炎、消化性溃疡的重要致病因子,与胃癌、胃黏膜相关淋巴样组织淋巴瘤的发生密切相关,1994年世界卫生组织国际癌症研究机构将Hp定为Ⅰ类致癌原[1]。含克拉霉素的三联或四联疗法是目前最常用的Hp根除方案,但随着抗菌药物的广泛使用,Hp耐药日趋严重,对克拉霉素耐药是Hp根除失败的主要原因之一。选择快速、敏感、价廉的耐药检测方法对根除Hp具有重要意义。近年来分子生物学技术广泛用于Hp耐药基因的检测,有研究[2]表明Hp对克拉霉素耐药与Hp 23S rRNA V区点突变有关。本研究通过评价检测粪便Hp基因突变对诊断克拉霉素耐药的有效性,并探讨cagA基因与耐药的相关性,旨在探索一种快速、简便的Hp耐药检测方法。
对象与方法
一、研究对象
选取2012年1~10月南京医科大学第一附属医院经13C-尿素呼气试验证实Hp感染的患者74例,其中男36例,女38例;年龄25~72岁,平均(49.4±5.6)岁;慢性胃炎50例、胃十二指肠球部溃疡18例、胃癌6例。74例患者均来自南京地区。排除标准:①过去4周内曾服用抗菌药物、铋剂、质子泵抑制剂、H2受体拮抗剂;②胃、十二指肠球部溃疡出血、穿孔;③妊娠或哺乳期妇女;④以往接受过Hp根除治疗。采集患者新鲜粪便,2 h内进行检测或-80℃保存待测。本研究方案经南京医科大学第一附属医院伦理委员会批准,所有入选者均签署知情同意书。
二、研究方法
1.DNA提取:取适量粪便标本,采用粪便基因组DNA快速提取试剂盒(离心柱型)(北京百泰克生物技术有限公司)提取DNA,具体操作步骤参照说明书进行。以Hp标准菌株悉尼菌株(上海市消化疾病研究所惠赠)作为阳性对照,以去离子水作为阴性对照。
2.巢式PCR法扩增:①第一轮扩增Hp 23S rRNA V区493 bp:Hp 23S rRNA 1835F:5’-GGT CTC AGC AAA GAG TCC CT-3’(1835 ~ 1854),2327R:5’-CCC ACC AAG CAT TGT CCT-3’(2327 ~ 2310)。PCR 反应体系 50 μL,包括25 mmol/L MgCl24 μL、10 × PCR 缓冲液5 μL、上下游引物各1 μL、dNTPs 1 μL、Taq 酶 3 μL、模板 DNA 2 μL 以及无菌去离子水33 μL。反应条件:95℃预变性2 min;94℃变性30 s,57 ℃ 退火 37 s,72 ℃ 延伸 30 s,5 个循环;94 ℃ 变性15 s,57 ℃ 退火15 s,72 ℃延伸20 s,30 个循环。
②第二轮扩增Hp 23S rRNA V区367 bp:Hp 23S rRNA 1942F:5’-AGG ATG CGT CAG TCG CAA GAT-3’(1942 ~1962),2308R:5’-CCT GTG GAT AAC ACA GGC CAG T-3’(2308~2287)。PCR反应体系50 μL,包括第一轮扩增产物2 μL、25 mmol/L MgCl24 μL、10 × PCR 缓冲液 5 μL、上下游引物各1 μL、dNTPs 1 μL、Taq 酶 3 μL 等。反应条件:95 ℃预变性2 min;94℃变性10 s,63℃退火20 s,72℃延伸20 s,25个循环;72℃延伸7 min。PCR产物行1.5%琼脂糖凝胶电泳。所有阴性标本加入β-actin引物扩增838 bp片段,反应体系同上,反应条件:95℃预变性1 min;95℃变性1 min,60℃退火1 min,72℃延伸1 min,35个循环;72℃延伸7 min。PCR产物行1.5%琼脂糖凝胶电泳。
3.PCR-RFLP检测:取8 μL第二轮PCR产物分别加入限制性内切酶BbsⅠ、BceAⅠ[纽英伦生物技术(北京)有限公司],37℃孵育24 h;取8 μL第二轮PCR产物加入限制性内切酶BsaⅠ[纽英伦生物技术(北京)有限公司],50℃孵育24 h。酶切后取5 μL反应产物行1.5%琼脂糖凝胶电泳,若存在A2142G、A2142C、A2143G突变,突变位点即可分别被BbsⅠ、BceAⅠ、BsaⅠ酶切为两个片段。
4.DNA测序:根据PCR-RFLP酶切结果,随机选取2例野生型(未被酶切)和8例突变型(被酶切)标本的PCR产物,由华大基因有限公司纯化后测序。
5.PCR 扩增 cagA 349 bp:cagA F:5’-GAT AAC AGG CAA GCT TTT GAG G-3’,R:5’-CTG CAA AAG ATT GTT TGG CAG A-3’。PCR反应体系同步骤①。反应条件:95℃预变性5 min;94℃变性1 min,59℃退火1 min,72℃延伸1 min,40个循环;72℃延伸7 min。取5 μL PCR产物行2%琼脂糖凝胶电泳。
三、统计学分析
应用SPSS 17.0统计软件,所得数据以百分率表示,组间比较采用χ2检验,P<0.05为差异有统计学意义。
结 果
一、Hp 23S rRNA PCR扩增结果
74例Hp阳性患者的粪便标本中,49例经PCR扩增得到Hp 23S rRNA 493 bp片段,扩增率为66.2%,60例扩增得到Hp 23S rRNA 367 bp片段,扩增率为81.1%。阴性标本加入β-actin引物后均扩增出838 bp片段。
二、Hp 23S rRNA PCR-RFLP检测结果
对60例Hp 23S rRNA扩增阳性产物进行酶切,结果显示17例(28.3%)被 BsaⅠ酶切(见图 1),60例均未被BbsⅠ、BceAⅠ酶切。阳性对照均未被 BsaⅠ、BbsⅠ、BceAⅠ酶切。
三、cagA PCR扩增结果
60例Hp 23S rRNA扩增阳性标本中,46例cagA阳性表达,阳性率为76.7%,其中13例被 BsaⅠ酶切,突变率为28.3%;14例cagA阴性表达,其中4例被BsaⅠ酶切,突变率为28.6%,cagA阳性、阴性表达的突变率相比差异无统计学意义(χ2=0.01,P=0.98)。
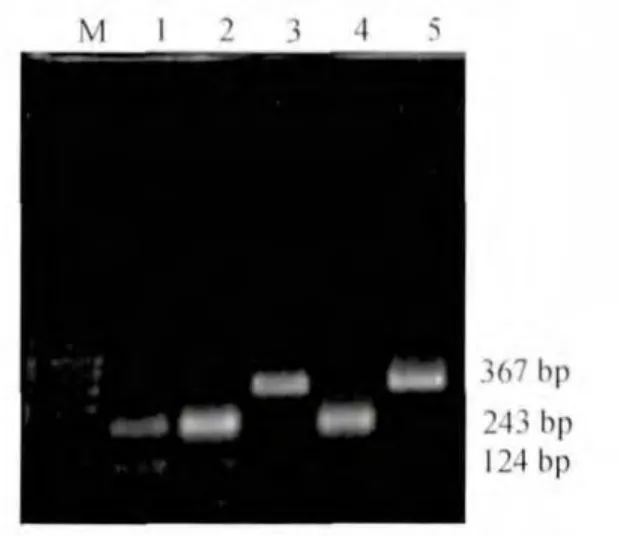
图1 BsaⅠ酶切Hp 23S rRNA产物图
四、DNA测序
随机选取的2例野生型和8例突变型标本的测序分析结果与基因组数据库NCBI的Hp26695株(NC-000915)23S rRNA基因序列进行比较,结果显示被酶切开的标本发生A2143G突变。
讨 论
克拉霉素属于大环内酯类,是根除Hp的有效抗菌药物之一,其抗菌机制为药物进入细胞内与核糖体紧密结合,作用于23S rRNA的多肽转移环,抑制多肽转移酶,阻止肽链延长,从而抑制蛋白质合成。克拉霉素耐药严重影响Hp根除疗效,而根除失败亦可导致克拉霉素耐药率增加。因此,临床上亟需一种快速、准确诊断Hp对克拉霉素耐药的方法。
Hp对克拉霉素耐药与其23S rRNA V区点突变有关,在此基础上开展快速、准确的Hp耐药检测可用于指导临床治疗,提高Hp根除疗效。目前发现的Hp 23S rRNA突变类型包括 A2143G、A2142G、A2142C、A2142T、A2143C、G2115A、G2141A,其中A2143G突变最为常见且稳定,占所有突变的45.1% ~82.1%,亦 存 在 A2143G+A2142G、A2143G+A2142C双重突变[3]。Hp对克拉霉素耐药的分子学检测方法主要立足于检测其23S rRNA点突变,基因测序是最准确的方法,但费时费力。目前应用最多的是PCR-RFLP检测,此方法检测点突变较为敏感,且简便易行,是检测A-G突变的基本方法,最早于1996年Versalovic等[2]应用此方法检测到Hp 23S rRNA A2142G、A2143G 突变。Ménard等[4]的研究发现,应用限制性内切酶BceAⅠ对PCR产物进行酶切,可检测23S rRNA A2142C突变。
Hp对克拉霉素的敏感性检测应本着可靠、简单、便于实施和推广的原则。粪便取材方便且无痛苦、无创伤、经济成本低。Hp定居于胃黏膜上皮细胞表面,可随胃黏膜上皮细胞更新脱落伴粪便排出。1994年Kelly等[5]从消化不良患者的粪便中分离出Hp。1995年Namavar等[6]应用16S rDNA PCR和DNA杂交技术从粪便中检测到Hp。1997年Kurokawa等[7]应用细菌培养和PCR两种方法检测粪便中Hp,发现PCR敏感性较细菌培养高,但粪便中Hp含量较低,杂菌较多,尤其是粪便中的胆红质、胆盐以及重金属离子等可抑制Taq DNA聚合酶活性,去除上述干扰因素是实验成功的关键。
本研究采用粪便基因组DNA快速提取试剂盒提取粪便DNA,PCR扩增率为81.1%,在研究中为避免假阴性,对所有阴性标本加入β-actin进行第二次扩增,均得到了838 bp的产物,说明此试剂盒能快速提取高质量DNA,不存在抑制物造成的假阴性。同时,本研究采用巢式PCR法行两次PCR扩增,克服了扩增平台期效应的限制,从而提高了PCR扩增敏感性,并由于模板和引物的改变,降低了非特异性反应放大的可能性,保证了反应的特异性。此外,本研究缩短了扩增时间,使检测更迅速。
本研究对60例Hp 23S rRNA阳性扩增产物进行酶切,17例可被BsaⅠ酶切,但均未被BbsⅠ、BceAⅠ酶切,提示与克拉霉素耐药有关的23S rRNA V区发生A2143G突变,不存在A2142G、A2142C突变。同时随机抽取2例野生型和8例突变型标本检测23S rRNA序列,结果证实对克拉霉素耐药的标本均存在A2143G突变。综合PCR-RFLP检测结果和基因序列比对结果,提示江苏地区Hp对克拉霉素的耐药机制主要为23S rRNA A2143G突变。
cagA是Hp的重要毒力因子,可作为评价Hp毒力的指标。根据是否表达cagA可将Hp分为Ⅰ型菌株(表达cagA基因)、Ⅱ型菌株(不表达cagA基因),Ⅰ型菌株产细胞毒素,为高毒力Hp菌株。本研究60例Hp 23S rRNA扩增阳性标本中46例cagA阳性表达,阳性率为76.7%,Hp感染以cagA基因阳性菌株为主,但cagA阳性、阴性表达者的突变率相比差异无统计学意义,提示cagA基因与Hp对克拉霉素耐药不相关。
综上所述,粪便取材方便、无痛苦、无创伤,用巢式PCR法提取粪便DNA,扩增Hp 23S rRNA,并检测Hp感染以及23S rRNA点突变是判断Hp对克拉霉素耐药的有效方法,尤其适用于流行病学调查研究。未来有待进一步研究以建立Hp耐药的流行病学资料,指导临床合理用药根除Hp。
1 Lai CH,Kuo CH,Chen PY,et al.Association of antibiotic resistance and higher internalization activity in resistant Helicobacter pylori isolates[J].J Antimicrob Chemother,2006,57(3):466-471.
2 Versalovic J,Shortridge D,Kibler K,et al.Mutations in 23S rRNA are associated with clarithromycin resistance in Helicobacter pylori [J].Antimicrob Agents Chemother,1996,40(2):477-480.
3 de Francesco V,Margiotta M,Zullo A,et al.Primary clarithromycin resistance in Italy assessed on Helicobacter pylori DNA sequences by TaqMan real-time polymerase chain reaction[J].Aliment Pharmacol Ther,2006,23(3):429-435.
4 Ménard A,Santos A,Mégraud F,et al.PCR-restriction fragmentlength polymorphism can also detectpoint mutation A2142C in the 23S rRNA gene,associated with Helicobacterpyloriresistance to clarithromycin[J].Antimicrob Agents Chemother, 2002, 46 (4):1156-1157.
5 Kelly SM,Pitcher MC,Farmery SM,et al.Isolation of Helicobacter pylori from feces of patients with dyspepsia in the United Kingdom[J].Gastroenterology,1994,107(6):1671-1674.
6 Namavar F,Roosendaal R,Kuipers EJ,et al.Presence of Helicobacter pylori in the oral cavity,oesophagus,stomach and feces of patients with gastritis[J].Eur J Clin Microbiol Infect Dis,1995,14(3):234-237.
7 Kurokawa M,Minamide M,Nukina M,et al.Usefulness of Helicobacter pylori detection from feces specimens of the patients with peptic ulcer by polymerase chain reaction[J].Kansenshogaku Zasshi,1997,71(11):1168-1171.

