Periostin过表达诱导人胃癌细胞化疗耐药性的机制研究
李 滨 汪丽燕 蒋欢欢
桂林医学院附属医院消化内科(534001)
Periostin又称成骨细胞特异性因子2(osteoblast-specific factor 2,OSF-2),是一种基质特异性细胞黏附分子,其cDNA最初是在小鼠成骨细胞株MC3T3-E1中被克隆和鉴定的[1]。既往研究发现periostin过表达与多种恶性肿瘤,如乳腺癌、肺癌、结直肠癌、胰腺癌、卵巢癌、前列腺癌、头颈部鳞癌的发生、发展有关[2]。除促进细胞黏附外,periostin还具有调控肿瘤细胞生长、增殖、迁移、侵袭、血管生成等作用,并与肿瘤细胞的化疗耐药有关[3~9]。顺铂(cisplatin)和5-氟尿嘧啶(5-fluorouracil,5-Fu)为常用胃癌化疗药物[10~12],然而由于肿瘤细胞化疗耐药性的获得[13],相当一部分胃癌患者化疗效果不甚理想。因此,探讨胃癌化疗耐药的产生机制对提高化疗效果、延长患者生存期具有重要意义。有研究显示periostin与受体结合后,可通过PI3K/Akt通路发挥其生物学效应[2],另有研究发现基因突变或缺失所致的p53失活是胃癌细胞化疗耐药的重要机制之一[14]。本课题组前期研究[15]发现 periostin过表达可增强人胃癌细胞株SGC-7901对顺铂和5-Fu诱导的细胞凋亡的抵抗能力,诱导胃癌细胞产生化疗耐药,本研究对periostin过表达是否系通过激活Akt通路抑制p53表达而诱导人胃癌细胞对顺铂和5-Fu的耐药性进行了探讨。
材料与方法
一、细胞株和主要试剂、仪器
人胃癌细胞株SGC-7901(American Type Culture Collection),表达人periostin全长序列的重组质粒pcDNA3.1-periostin(哈尔滨医科大学附属第四医院消化内科构建、保存[16])。顺铂、5-Fu(Sigma-Aldrich Co.),Akt特异性抑制剂 MK-2206(Selleck Chemicals),兔抗人Akt多克隆抗体、兔抗人磷酸化Akt(p-Akt)多克隆抗体、小鼠抗人p53单克隆抗体、小鼠抗人 β-actin单克隆抗体、兔 IgG-HRP、小鼠IgG-HRP(Santa Cruz Biotechnology,Inc.),Amersham ECL Plus蛋白质印迹法检测试剂盒(Life Sciences,GE Healthcare),BD PharmingenTMAnnexin V∶FITC凋亡检测试剂盒(BD Biosciences)。Tanon-4100全自动数码凝胶图像分析系统(上海天能科技有限公司),EPICS®ALTRATM流式细胞仪(Beckman Coulter,Inc.)。
二、方法
1.细胞培养:SGC-7901细胞使用RPMI1640完全培养基,于37℃、5%CO2培养箱内培养,每2~3 d换液一次。细胞生长至70% ~80%融合时,按1∶3的比例进行传代。取对数生长期细胞进行实验。
2.稳转细胞株的构建:稳定转染 pcDNA3.1-periostin重组质粒和稳定转染 pcDNA3.1空载体SGC-7901细胞株的构建步骤参照本课题组前期研究[16]。
3.细胞处理:periostin稳转组和空载体稳转组SGC-7901细胞分别以5 μmol/L顺铂或10 μmol/L 5-Fu处理24 h或不予化疗药物处理,其中periostin稳转组在化疗药物处理前可接受或不接受1 μmol/L MK-2206(Akt特异性抑制剂)预处理30 min。同时设置未予转染、亦未予化疗药物处理和未予转染、但予化疗药物处理的对照组。
4.蛋白质印迹法检测总Akt、p-Akt、p53蛋白表达:将各组细胞按5×105/孔接种于12孔板并予相应处理,细胞密度达到70% ~80%时收集细胞,加入适量细胞裂解液,冰上裂解30 min,4℃ 14 000×g离心15 min,吸取上清液,液氮速冻,-80℃保存备用。BCA法蛋白定量,取20 μg总蛋白上样,10%SDS-PAGE电泳1.5 h,转移至 PVDF膜,5%脱脂奶粉室温封闭1 h,加入一抗(1∶1000)室温孵育2 h,1×TBST洗膜10 min×3次,加入HRP标记的二抗(1∶2000)室温孵育 1 h,1×TBST洗膜 10 min×3次,按Amersham ECL Plus蛋白质印迹法检测试剂盒说明书进行显影、定影操作,凝胶图像分析系统扫描、观察。
5.流式细胞术检测细胞凋亡:将经相应处理的各组细胞制成1×106/mL的细胞悬液,取100 μL移入流式细胞仪专用试管,预冷PBS洗涤3次,300×g离心10 min,弃上清液,按 BD PharmingenTMAnnexin V∶FITC凋亡检测试剂盒说明书进行操作,染色完毕后立即上流式细胞仪检测。激发波长488 nm,发射波长525 nm(Annexin V-FITC染色阳性细胞)和620 nm(PI染色阳性细胞)。Annexin VFITC染色阳性为早期凋亡细胞,PI染色阳性为坏死细胞,两者均阳性为晚期凋亡细胞,两者均阴性为正常活细胞。
三、统计学分析
结 果
一、Periostin过表达激活SGC-7901细胞的Akt通路
蛋白质印迹法检测显示,periostin稳转组SGC-7901细胞p-Akt蛋白表达明显高于空载体稳转组和未予转染的对照组,三组间总Akt蛋白表达无明显差异(见图1),表明periostin过表达可诱导 SGC-7901细胞Akt磷酸化水平增加,激活Akt通路。
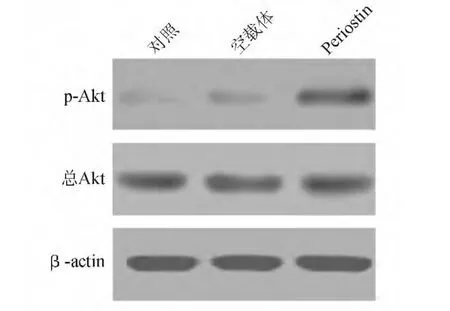
图1 各组 SGC-7901细胞总 Akt、p-Akt蛋白表达比较(蛋白质印迹法)

图2 各组经顺铂或5-Fu处理的SGC-7901细胞p53蛋白表达比较(蛋白质印迹法)
二、Periostin通过激活Akt通路抑制SGC-7901细胞p53表达
蛋白质印迹法检测显示,在经顺铂或5-Fu处理的各组SGC-7901细胞中,periostin稳转组p53蛋白表达明显低于空载体稳转组和未予转染的对照组,而经Akt特异性抑制剂MK-2206预处理的periostin稳转组细胞,p53蛋白表达下调有所逆转(见图2),表明抑制Akt可在一定程度上逆转periostin对p53表达的抑制作用,periostin至少部分是通过激活Akt通路抑制SGC-7901细胞的p53表达。
三、Akt通路对periostin在SGC-7901细胞中抗凋亡活性的作用
流式细胞分析显示,在经顺铂或5-Fu处理的各组SGC-7901细胞中,periostin稳转组细胞凋亡率显著低于空载体稳转组和未予转染的对照组,而经Akt特异性抑制剂MK-2206预处理的periostin稳转组细胞,细胞凋亡率降低有所逆转(见图3),表明抑制Akt可在一定程度上逆转periostin诱导的凋亡保护效应,Akt通路活化对periostin在SGC-7901细胞中的抗凋亡活性具有重要意义。

图3 各组SGC-7901细胞顺铂或5-Fu诱导的细胞凋亡率比较(流式细胞分析)
讨 论
肿瘤细胞耐药性的获得是肿瘤治疗失败的主要原因之一,最终导致肿瘤复发和死亡。尽管围绕胃癌耐药机制的研究已取得一定进展,但其确切机制迄今尚未完全阐明。本课题组前期研究[15]探讨了periostin基因对胃癌化疗敏感性的调控作用,结果显示过表达外源性periostin可增强人胃癌细胞株SGC-7901对顺铂和5-Fu诱导的细胞凋亡的抵抗能力,伴线粒体细胞色素C释放、凋亡效应分子caspase-3激活及其底物PARP剪切减少,以及促凋亡蛋白Bax表达下调、抗凋亡蛋白Bcl-2表达上调、肿瘤抑制蛋白p53表达下调(部分研究结果未发表)。因此,periostin过表达可能为人胃癌细胞产生化疗耐药的原因之一。本研究在前期研究的基础上探讨了periostin过表达诱导人胃癌细胞化疗耐药性的可能机制。
PI3K/Akt通路活化对于肿瘤细胞抵抗凋亡刺激而存活具有重要意义。Akt由PI3K激活后,可直接影响凋亡机制,或影响凋亡刺激引起的转录因子活性改变[17]。有研究[18]发现结肠癌中过表达的periostin可激活Akt/PKB通路,进而促进细胞存活和肿瘤转移性生长。同样,在非小细胞肺癌中,缺氧引起的periostin过表达可通过激活Akt/PKB通路促进肿瘤细胞在低氧环境中存活[19]。本研究结果显示periostin过表达可诱导SGC-7901细胞Akt磷酸化水平增加,但对总Akt无明显影响,表明periostin过表达可激活人胃癌细胞的Akt通路。进一步检测Akt通路活化在periostin抑制p53表达中的作用,发现在经顺铂或5-Fu处理的SGC-7901细胞中,periostin可抑制化疗药物诱导的p53表达上调,而Akt特异性抑制剂预处理可在一定程度上逆转periostin对p53表达的抑制作用,表明periostin至少部分是通过激活Akt通路抑制人胃癌细胞的p53表达。最后,本研究探讨了periostin的抗凋亡活性是否依赖于激活Akt通路,结果显示periostin可抑制顺铂和5-Fu诱导的SGC-7901细胞凋亡,而Akt特异性抑制剂预处理可在一定程度上逆转periostin诱导的凋亡保护效应,表明Akt通路活化对periostin在人胃癌细胞中的抗凋亡活性具有重要意义。
p53是细胞信号转导网络中的重要节点分子,其活化后可经由广泛的信号网络诱导凋亡相关靶基因转录,通过外源性死亡受体途径和内源性线粒体途径诱导细胞凋亡;在特定条件下,p53还能通过非转录依赖性机制促进细胞凋亡[20]。而激活Akt通路能增强MDM2对p53活性的抑制能力,通过影响p53家族活性而发挥抗凋亡作用[17,20]。本研究发现,在人胃癌细胞中,过表达外源性periostin可致Akt通路活化,而Akt特异性抑制剂MK-2206可部分逆转periostin抑制化疗药物诱导的p53表达上调和肿瘤细胞凋亡的作用,证实Akt为p53的上游调控因子。
Periostin与Akt通路的相关性在其他细胞背景中亦有报道,如periostin可通过Akt通路诱导胆管癌细胞侵袭[21]、参与急性心肌梗死时活化成纤维细胞的募集以促进修复[22]等;在颈动脉损伤时以及体外培养的血管平滑肌细胞中,periostin表达上调系由PI3K/Akt依赖性通路所介导,进而促进血管平滑肌细胞迁移[23]。综合上述研究发现以及本研究结果,periostin多种生物学功能的发挥与Akt通路有关,通过激活Akt通路抑制p53表达可能是periostin过表达诱导人胃癌细胞化疗耐药性的机制之一,有望作为胃癌治疗的潜在靶点。
1 Takeshita S,Kikuno R,Tezuka K,et al.Osteoblast-specific factor 2:cloning of a putative bone adhesion protein with homology with the insect protein fasciclinⅠ[J].Biochem J,1993,294(Pt 1):271-278.
2 Ruan K,Bao S,Ouyang G.The multifaceted role of periostin in tumorigenesis[J].Cell Mol Life Sci,2009,66(14):2219-2230.
3 Erkan M,Kleeff J,Gorbachevski A,et al.Periostin creates a tumor-supportive microenvironment in the pancreas by sustaining fibrogenic stellate cell activity[J].Gastroenterology,2007,132(4):1447-1464.
4 Tai IT,Dai M,Chen LB.Periostin induction in tumor cell line explants and inhibition of in vitro cell growth by antiperiostin antibodies[J].Carcinogenesis,2005,26(5):908-915.
5 Gillan L,Matei D,Fishman DA,et al.Periostin secreted by epithelial ovarian carcinoma is a ligand for alpha(Ⅴ)beta(3)and alpha(Ⅴ)beta(5)integrins and promotes cell motility[J]. CancerRes, 2002, 62 (18):5358-5364.
6 Sun C,Zhao X,Xu K,et al.Periostin:a promising target of therapeutical intervention for prostate cancer[J].J Transl Med,2011,9:99.
7 Kudo Y,Ogawa I,Kitajima S,et al.Periostin promotes invasion and anchorage-independent growth in the metastatic process of head and neck cancer[J].Cancer Res,2006,66(14):6928-6935.
8 Siriwardena BS,Kudo Y,Ogawa I,et al.Periostin is frequently overexpressed and enhances invasion and angiogenesis in oral cancer[J].Br J Cancer,2006,95(10):1396-1403.
9 Shao R,Bao S,Bai X,et al.Acquired expression of periostin by human breast cancers promotes tumor angiogenesis through up-regulation of vascular endothelial growth factor receptor 2 expression[J].Mol Cell Biol,2004,24(9):3992-4003.
10 Park JS,Lim JY,Park SK,et al.Prognostic factors of second and third line chemotherapy using 5-fu with platinum,irinotecan,and taxane for advanced gastric cancer[J].Cancer Res Treat,2011,43(4):236-243.
11 Matt P,van Zwieten-Boot B,Calvo Rojas G,et al.The European Medicines Agency review of Tegafur/Gimeracil/Oteracil(TeysunoTM)for the treatment of advanced gastric cancer when given in combination with cisplatin:summary of the Scientific Assessment of the Committee for medicinal products for human use(CHMP)[J].Oncologist,2011,16(10):1451-1457.
12 Pera M,Gallego R,Montagut C,et al.PhaseⅡ trial of preoperative chemoradiotherapy with oxaliplatin,cisplatin,and 5-FU in locally advanced esophageal and gastric cancer[J].Ann Oncol,2012,23(3):664-670.
13 Kim HK,Choi IJ,Kim CG,et al.A gene expression signature of acquired chemoresistance to cisplatin and fluorouracil combination chemotherapy in gastric cancer patients[J].PLoS One,2011,6(2):e16694.
14 Kamoshida S,Suzuki M,Shimomura R,et al.Immunostaining of thymidylate synthase and p53 for predicting chemoresistance to S-1/cisplatin in gastric cancer[J].Br J Cancer,2007,96(2):277-283.
15 汪丽燕,李滨,郑清华.Periostin基因过表达对顺铂和5-氟尿嘧啶诱导人胃癌细胞凋亡的影响[J].胃肠病学,2013,18(10):596-599.
16 汪丽燕,李滨,刘艳华.上调Periostin基因表达对人胃癌细胞增殖的影响[J].胃肠病学,2013,18(9):526-529.
17 Downward J.PI 3-kinase,Akt and cell survival[J].Semin Cell Dev Biol,2004,15(2):177-182.
18 Bao S,Ouyang G,Bai X,et al.Periostin potently promotes metastatic growth of colon cancer by augmenting cell survival via the Akt/PKB pathway[J].Cancer Cell,2004,5(4):329-339.
19 Ouyang G,Liu M,Ruan K,et al.Upregulated expression of periostin by hypoxia in non-small-cell lung cancer cells promotes cell survival via the Akt/PKB pathway[J].Cancer Lett,2009,281(2):213-219.
20 Haupt S,Berger M,Goldberg Z,et al.Apoptosis-the p53 network[J].J Cell Sci,2003,116(Pt 20):4077-4085.
21 Utispan K,Sonongbua J,Thuwajit P,et al.Periostin activates integrin α5β1 through a PI3K/AKT dependent pathway in invasion of cholangiocarcinoma[J].Int J Oncol,2012,41(3):1110-1118.
22 Shimazaki M,Nakamura K,Kii I,et al.Periostin is essentialfor cardiac healing after acute myocardial infarction[J].J Exp Med,2008,205(2):295-303.
23 Li G,Oparil S,Sanders JM,et al.Phosphatidylinositol-3-kinase signaling mediates vascular smooth muscle cell expression ofperiostin in vivo and in vitro [J].Atherosclerosis,2006,188(2):292-300.

