表皮生长因子及其受体对结肠癌干细胞的增殖调控*
冯燕君 刘 倩 方 一 宋荣峰 万以叶刘建胜 王海伟 杜艳芝 张 济 夏 璐&
上海交通大学医学院附属瑞金医院消化内科1(200025) 江西省肿瘤医院肿瘤内三科2中国科学院上海生命科学研究院/上海交通大学医学院健康科学研究所基因组学3
传统理论认为肿瘤是均一的细胞团体,是所有肿瘤细胞共同增殖的结果,而肿瘤干细胞(cancer stem cells,CSCs)假说认为肿瘤为一异质体,其中存在一小部分干细胞特性的肿瘤干细胞,具有自我更新、多向分化以及高度增殖能力,是肿瘤生长、复发、转移、耐药的根源[1]。目前,已在急性髓细胞样白血病、乳腺癌、头颈部癌、胰腺癌、结直肠癌等多种肿瘤中分离、鉴定出 CSCs[2~6]。肿瘤细胞生长需特定微环境,细胞因子在其中发挥重要作用。肠道干细胞在增殖过程中,可通过分泌生长因子如表皮生长因子(EGF)、血管内皮生长因子(VEGF)等,维持自身生长并抑制凋亡[7,8]。已知 EGF对 CSCs生长具有一定调控作用,Soeda等[9]的研究显示,EGF可促进脑CSCs增殖。然而,关于EGF对结肠癌干细胞增殖的影响尚未见报道。本研究通过探讨EGF及其受体(EGFR)在结肠癌干细胞增殖调控中的作用,以期为结肠癌的治疗提供新思路。
材料与方法
一、细胞株、实验动物和主要试剂
结肠癌细胞株HT29、HCT116(中国科学院上海生命科学研究院健康科学研究所基因实验室保存);健康清洁级雄性BALB/c(nu/nu)小鼠6只(复旦大学上海医学院动物实验室提供)。RPMI1640、DMEM/F12、4%BSA、0.05%EDTA-胰酶、Trizol试剂(Gibco公司);B27、胰岛素样生长因子(IGF)、MTT、DMSO(Sigma公司);EGF、碱性成纤维细胞生长因子(bFGF)(PeproTech公司);吉非替尼(Tocris Bioscience公司);PD153035(Merck公司);Annexin VFITC/PI凋亡检测试剂盒(BD公司);鼠抗兔Ki67单克隆抗体(Santa Cruz Biotechnology公司);Real-Time PCR试剂盒(Qiagen公司)。
二、方法
1.细胞株和细胞球培养:结肠癌细胞株HT29、HCT116传代培养于含10%胎牛血清的RPMI1640培养基中。取对数生长期细胞,以1×103/mL接种于由 DMEM/F12(1∶1)、B27(1∶50)、4%BSA(1∶10)、EGF(20 ng/mL)、bFGF(20 ng/mL)组成的无血清培养基(SFM)中培养。
2.生长因子干预细胞:取HT29、HCT116细胞在SFM中形成的细胞球,以0.05%EDTA-胰酶消化,制成单细胞悬液。将细胞以1×103/mL接种于96孔板,分别以20 ng/mL EGF、bFGF、IGF 干预,同时设立空白对照组。5~7 d后显微镜下计数每孔细胞球数。
3.MTT法检测细胞增殖抑制:取HCT116细胞球,制成单细胞悬液,以1×106/mL接种于96孔板,分别加入不同浓度(0、0.01、0.1、1、10、20 μmol/L)EGFR抑制剂吉非替尼,于5%CO2、37℃条件下培养72 h,加入5 mg/mL MTT 20 μL,继续培养 4 h,终止培养,弃MTT溶液,加入DMSO 20 μL溶解紫色结晶,以酶标仪行分光光度检测,于570 nm波长处测定各孔吸光度(A)值,绘制生长曲线并计算半数抑制浓度(IC50)。
4.体外增殖实验检测细胞球形成抑制:取HCT116细胞球,制成单细胞悬液,以1×103/mL接种于96 孔板,分别加入不同浓度(0、1、5、10、15、20 μmol/L)吉非替尼,另一96孔板加入EGFR抑制剂PD153035(浓度同吉非替尼),于5%CO2、37℃条件下培养72 h,显微镜下计数每孔细胞球数。
5.流式细胞术检测细胞凋亡:取HCT116细胞球,制成单细胞悬液,分别加入不同浓度(0、1、5、10、15 μmol/L)吉非替尼,培养 72 h,加入 Annexin V-FITC和PI染色液,混匀后室温避光静置15 min,上流式细胞仪检测。
6.小鼠体内成瘤实验检测细胞成瘤能力:取HCT116细胞球和RPMI1640培养基中贴壁生长的HCT116细胞,制成单细胞悬液,小鼠右侧腋窝皮下接种由细胞球制成的单细胞悬液(1×105个细胞),同只小鼠左侧腋窝皮下接种由细胞株制成的单细胞悬液(1×105个细胞),观察小鼠两侧成瘤率以及皮下移植瘤生长速度,瘤体直径≥5 mm起开始测量移植瘤体积,体积=长径×短径2/2,绘制移植瘤生长曲线。
取小鼠皮下移植瘤行HE染色、免疫组化SABC法染色。肿瘤组织石蜡包埋、切片,脱蜡至水,以3%H2O2室温孵育,5%山羊血清封闭,室温孵育,加入鼠抗兔Ki67单克隆抗体(1∶1000),4℃孵育过夜,PBS冲洗,加入生物素标记的二抗(1∶10 000),37℃孵育30 min,PBS冲洗,加入HRP标记的链霉卵白素(1∶10 000),37℃孵育30 min,PBS冲洗,DAB或AEC显色,自来水冲洗,复染,封片,摄片。
7.Real-time PCR:参考 Barker 等[10]、Kayahara等[11]、Chan 等[12]的研究,检测干细胞标记 LGR5、Musashi-1和分化标记CK20在HCT116细胞球和细胞株中的表达。取 HCT116细胞球和贴壁细胞,Trizol法提取RNA,逆转录合成cDNA。LGR5引物上游:5’-CTC CCA GGT CTG GTG TGT TG-3’,下游:5’-GTG AAG ACG CTG AGG TTG GA-3’;Musashi-1引物上游:5’-GGA CTC AGT TGG CAG ACT ACG-3’,下游:5’-CTG GTC CAT GAA AGT GAC GAA-3’;CK20引物上游:5’-ATG GAT TTC AGT CGC AGA AGC-3’,下游:5’-CTC CCA TAG TTC ACC GTG TGT-3’;GAPDH 引物上游:5’-GAA GGT GAA GGT CGG AGT C-3’,下游:5’-GAA GAT GGT GAT GGG ATT TC-3’。参照Real-Time PCR试剂盒说明书进行操作。反应体系总体系10 μL,反应条件:95℃ 60 s;95℃ 15 s,60℃ 15 s,72℃45 s,共 40 个循环;最后 72 ℃ 延伸 5 min。2-ΔΔCt法计算目的基因相对表达量。
三、统计学分析
结 果
一、生长因子对结肠癌细胞球形成的影响
在无血清培养基中,HCT116、HT29细胞均能形成细胞球(见图1A、1B)。HCT116细胞球数量在空白对照组、EGF组、bFGF组、IGF组分别为(25.30±2.14)/孔、(41.78 ± 2.75)/孔、(26.33 ± 1.66)/孔、(27.22 ±2.66)/孔,EGF 组较其余各组显著升高(P<0.05)(见图1C)。HT29细胞球数量在四组间差异无统计学意义(P>0.05)(见图1D)。
二、EGFR抑制剂抑制结肠癌细胞球细胞增殖
MTT 法检测结果显示,不同浓度(0、0.01、0.1、1、10、20 μmol/L)吉非替尼作用于 HCT116 细胞球细胞后,细胞增殖受抑,增殖率随药物浓度增加而降低,浓度达1 μmol/L后,增殖抑制尤为明显(见图2)。IC50值为(12.5 ±0.48)μmol/L。

图1 生长因子对结肠癌细胞球形成的影响
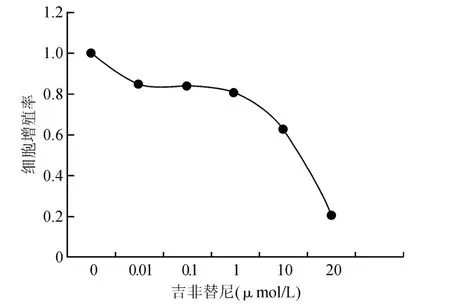
图2 吉非替尼抑制HCT116细胞球细胞增殖
三、EGFR抑制剂抑制结肠癌细胞球形成
体外增殖实验结果显示,吉非替尼对HCT116细胞球形成具有抑制作用,作用随药物浓度增加而增强,浓度为15 μmol/L时抑制效应最大(见图3A)。PD153035的抑制作用与吉非替尼相似,浓度为20 μmol/L时抑制效应最大(见图3B)。
四、EGFR抑制剂诱导结肠癌细胞球细胞凋亡
流式细胞分析结果显示,不同浓度(0、1、5、10、15 μmol/L)吉非替尼作用于 HCT116细胞球细胞后,细胞凋亡率随药物浓度增加而增加,1 μmol/L与15 μmol/L组间差异显著(P <0.05)(见图4)。

图3 EGFR抑制剂抑制HCT116细胞球形成

图4 吉非替尼诱导HCT116细胞球细胞凋亡
五、结肠癌细胞球和细胞株体内成瘤能力
小鼠体内成瘤实验结果显示,HCT116细胞球成瘤时间较HCT116细胞株显著缩短,接种18 d后,细胞球成瘤体积显著大于细胞株(P<0.05)(见图5)。
HCT116细胞球和细胞株移植瘤HE染色、免疫组化染色结果显示,两种移植瘤的肿瘤细胞排列、核异型性和Ki67表达无明显差异(见图6)。

图5 HCT116细胞球和细胞株体内成瘤能力比较
六、结肠癌细胞球和细胞株干细胞标记、分化标记表达
Real-time PCR检测结果显示,干细胞标记LGR5、Musashi-1在HCT116细胞球中的表达显著高于HCT116细胞株,而分化标记CK20在细胞株中的表达显著高于细胞球(P<0.05)(见图7)。

图6 HCT116细胞球和细胞株移植瘤HE染色和免疫组化染色

图7 HCT116细胞球和细胞株干细胞标记、分化标记表达比较
讨 论
既往对于肿瘤来源的研究多集中于癌细胞基因突变或表达异常,但肿瘤基因具有结构不稳定性、时间、空间依赖性以及个体差异性等特点,寻找具有肿瘤共性和特异性的基因难度较大。随着科学的发展,研究人员发现肿瘤细胞在增殖、分化方面与干细胞极为相似,提出肿瘤可能是一种干细胞疾病的理论[13]。
CSCs、肿瘤前体细胞和分化的肿瘤细胞是一个处于动态平衡的共存体。目前无血清培养法是经典的体外富集CSCs的方法,无血清环境能有效抑制细胞分化,使肿瘤细胞维持于CSCs状态。CSCs的“干”性主要表现为表达干细胞标记分子、启动肿瘤发生和参与肿瘤形成,即致瘤性。致瘤性的鉴定主要通过将细胞接种于免疫缺陷小鼠体内,观察一定时间内其在小鼠体内形成移植瘤的情况,此方法是鉴别CSCs的金标准。本研究体内成瘤实验结果显示,HCT116细胞球在体内形成移植瘤的能力明显强于HCT116细胞株。进一步对两种细胞形成的移植瘤进行HE染色和免疫组化染色,发现两种移植瘤的肿瘤细胞排列、核异型性和Ki67表达无明显差异,提示HCT116细胞球和细胞株形成的移植瘤均来源于HCT116干细胞。细胞球形成的移植瘤体积显著大于细胞株,说明细胞株的结肠癌干细胞数量少于细胞球。此外,干细胞标记鉴定结果显示,HCT116细胞球中的LGR5、Musashi-1表达水平显著高于HCT116细胞株,故推测无血清培养获得的肿瘤细胞球是CSCs的聚集体。
EGF是一种作用十分广泛的生长因子,通过与EGFR结合而发挥作用。研究[7]显示EGF等生长因子能促进肠道干细胞增殖,抑制肠道祖细胞凋亡。在CSCs的培养中,EGF、bFGF等生长因子已作为常规物质添加至培养基中。对头颈部癌、前列腺癌的研究[14,15]证实,EGF、EGFR 在调节 CSCs 增殖过程中发挥重要作用。
EGFR是细胞表面ErbB受体家族中的一员,参与细胞增殖、生长、迁移、浸润等过程。研究[16]发现EGFR能通过唾液酸化作用调节EGF介导的结肠癌细胞增殖以及对吉非替尼的耐药性。本研究结果显示EGF对结肠癌干细胞增殖具有促进作用;证实EGF参与了结肠癌干细胞的增殖调控。进一步采用EGFR抑制剂吉非替尼、PD153035处理无血清培养条件下形成的HCT116细胞球,结果发现两者对细胞球形成具有明显抑制作用,同时发现EGFR抑制剂系通过诱导细胞凋亡而发挥增殖调控作用。Bae等[17]的研究发现,EGFR抑制剂可通过诱导结肠癌细胞表达UL16结合蛋白1(ULBP1),增强其对自然杀伤(NK)细胞的敏感性。本研究结果显示,EGFR抑制剂对HCT116细胞球的增殖抑制和诱导凋亡作用可能与调节LGR5、Musashi-1和CK20表达有关。Zvibel等[18]的研究发现,培养于肝细胞外基质(hECM)中的具有高转移能力的结肠癌细胞,其干细胞标记LGR5表达显著升高。Walker等[19]的研究显示,结肠癌细胞敲除LGR5基因后,其克隆增殖、侵袭以及成瘤能力显著降低。
综上所述,本研究结果证实EGF对结肠癌细胞株HCT116、HT29形成细胞球具有促进作用;EGFR抑制剂可抑制结肠癌细胞球增殖并诱导细胞凋亡,相关作用可能与调控干细胞标记LGR5、Musashi-1和分化标记CK20表达有关。对结肠癌干细胞有待作更深入的研究,以明确其生物学功能,为结肠癌的治疗提供新思路。
1 Reya T,Morrison SJ,Clarke MF,et al.Stem cells,cancer,and cancer stem cells[J].Nature,2001,414(6859):105-111.
2 Bonnet D,Dick JE.Human acute myeloid leukemia is organized as a hierarchy that originates from a primitive hematopoietic cell[J].Nat Med,1997,3(7):730-777.
3 Al-Hajj M,Wicha MS,Benito-Hernandez A,et al.Prospective identification of tumorigenic breast cancer cells[J].Proc Natl Acad Sci U S A,2003,100(7):3983-3988.
4 Allegra E,Trapasso S.Cancer stem cells in head and neck cancer[J].Onco Targets Ther,2012,5:375-383.
5 Li C,Lee CJ,Simeone DM.Identification of human pancreatic cancer stem cells[J].Methods Mol Biol,2009,568:161-173.
6 Dalerba P,Dylla SJ,Park IK,et al.Phenotypic characterization of human colorectal cancer stem cells[J].Proc Natl Acad Sci U S A,2007,104(24):10158-10163.
7 Suzuki A,Sekiya S,Gunshima E,et al.EGF signaling activates proliferation and blocks apoptosis of mouse and human intestinal stem/progenitor cells in long-term monolayer cell culture[J].Lab Invest,2010,90(10):1425-1436.
8 Herbst RS.Review of epidermal growth factor receptor biology[J].Int J Radiat Oncol Biol Phys,2004,59(2 Suppl):21-26.
9 Soeda A,Inagaki A,Oka N,et al.Epidermal growth factor plays a crucial role in mitogenic regulation of human brain tumor stem cells[J].J Biol Chem,2008,283(16):10958-10966.
10 Barker N,Ridgway RA,van Es JH,et al.Crypt stem cells as the cells-of-origin of intestinal cancer[J].Nature,2009,457(7229):608-611.
11 Kayahara T,Sawada M,Takaishi S,et al.Candidate markers for stem and early progenitor cells,Musashi-1 and Hes1,are expressed in crypt base columnar cells of mouse small intestine[J].FEBS Lett,2003,535(1-3):131-135.
12 Chan CW,Wong NA,Liu Y,et al.Gastrointestinal differentiation marker Cytokeratin 20 is regulated by homeobox gene CDX1[J].Proc Natl Acad Sci U S A,2009,106(6):1936-1941.
13 Aguilar-Gallardo C,Simón C.Cells,stem cells,and cancer stem cells[J].Semin Reprod Med,2013,31(1):5-13.
14 Abhold EL,Kiang A,Rahimy E,et al.EGFR kinase promotes acquisition of stem cell-like properties:a potential therapeutictargetin head and neck squamous cell carcinoma stem cells[J]. PLoS One, 2012, 7(2):e32459.
15 Mimeault M,Johansson SL,Batra SK.Pathobiological implications of the expression of EGFR,pAkt,NF-κB and MIC-1 in prostate cancer stem cells and their progenies[J].PLoS One,2012,7(2):e31919.
16 Park JJ,Yi JY,Jin YB,et al.Sialylation of epidermal growth factorreceptorregulatesreceptoractivity and chemosensitivity to gefitinib in colon cancer cells[J].Biochem Pharmacol,2012,83(7):849-857.
17 Bae JH,Kim SJ,Kim MJ,et al.Susceptibility to natural killer cell-mediated lysis of colon cancer cells is enhanced by treatment with epidermal growth factor receptor inhibitors through UL16-binding protein-1 induction[J].Cancer Sci,2012,103(1):7-16.
18 Zvibel I,Wagner A,Pasmanik-Chor M,et al.Transcriptional profiling identifies genes induced by hepatocyte-derived extracellular matrix in metastatic human colorectal cancer cell lines[J].Clin Exp Metastasis,2013,30(2):189-200.
19 Walker F,Zhang HH,Odorizzi A,et al.LGR5 is a negative regulator of tumourigenicity,antagonizes Wnt signalling and regulates cell adhesion in colorectal cancer cell lines[J].PLoS One,2011,6(7):e22733.

