宣肺化痰活血法对哮喘大鼠气道重塑及TGF-β1/Smad信号通路的影响*
林晓冰 刘小虹 许丽梅 单丽囡 陈文桂 刘 琼 广州中医药大学(广州 510006)
气道重塑是气道炎症慢性化发展的必然结果,是哮喘的一个主要特征。由于气道长期持续性的炎症反复发作,反复修复,导致组织增生而发生重塑。其主要病理学改变包括基底膜(Basement Membrane,BM)增厚、胶原沉着、平滑肌细胞(Airway Smooth Muscle Cell,ASMC)增生/肥大、血管增生、粘液腺(Mucous Gland)增生等[1]。能够导致气道高反应性(Airway Hyperresponsiveness,AHR)和气道狭窄。一般认为,气道重塑在哮喘发病初期就已经开始,导致临床表现复杂多样,增加治疗的难度。目前多项研究提示TGF-β1可能参与哮喘气道重塑,Smads家族是TGF-β1下游信号通路的关键元件,TGF-β1对气道重塑的生物学活性可以通过其下游蛋白Smads信号转导途径来实现。从祖国医学角度来说,痰、瘀是哮喘气道重塑中两个重要的病理因素。本实验借助哮喘气道重塑模型,旨在探讨宣肺化痰活血法对哮喘大鼠气道重塑和TGF-β1/Smad信号通路的影响,现报道如下。
1 材料与方法
1.1 主要试剂与仪器 美国sigma公司进口分装卵清蛋白(OVA)由北京索来宝科技有限公司提供,批号A2512;TGF-β1兔多抗、Smad3兔多抗、Smad7兔多抗、免疫组化试剂盒由北京博奥森生物技术有限公司提供;EasyScript First-Strand cDNA Synthesis SuperMix 、TransStart TM Green qPCR Super-Mix由北京全式金生物技术有限公司提供。鱼跃402AI超声雾化器医用雾化器由江苏鱼跃医疗设备股份有限公司生产;LEICAEG1140H石蜡包埋机、LEICA RM2255全自动轮转切片机由德国莱卡仪器有限公司生产;3K30型冷冻离心机由美国Sigma公司生产;Bio-RADiCycler实时荧光定量PCR仪由美国bio-rad公司生产。
1.2 实验动物与分组 6周龄SPF级SD大鼠72只,体重150±20g,由广州中医药大学动物实验中心提供。适应喂养1周后,随机分为A组(空白组)、B组(模型组)、C组(中药高剂量组)、D组(中药中剂量组)、E组(中药低剂量组)、F组(地塞米松组),每组12只。
1.3 药物制备 宣肺化痰活血中药组成:炙麻黄、射干、地龙、北杏仁、法半夏、桔梗、细辛、桃仁等药物组成,加水煎煮,水浴浓缩成含生药量4g/mL。对照药物醋酸地塞米松片由广东华南药业集团有限公司提供,批号091004。
1.4 动物模型复制及给药方法 除A组,其余各组参照文献在第l、8天腹腔注射lmL OVA/AL(OH)3混合液(含OVA l0mg和AI(OH)3200mg)致敏,第15天开始应用超声雾化器于自制简易雾化箱中以一定浓度的OVA生理盐水溶液雾化激发,每次20min,隔日1次,持续8周。激发浓度分别为第1、2周1%,第3、4周1.5%,第5、6周2%,第7、8周2.5%[2]。C、D、E组于第15天开始每次雾化前0.5h按40g/kg、20g/kg、10g/kg剂量给与中药灌胃。F组则于第15天开始每次雾化前0.5h给予0.5mg/kg地塞米松灌胃。A组不造模,给予等量生理盐水代替药物。
1.5 取材及检测方法 末次给药后2h,用10%水合氯醛350mg/kg腹腔注射麻醉,腹主动脉抽血后处死,开胸结扎,迅速取左肺中叶组织块置于冻存管中-80℃冻存,用于RNA抽提;取出右肺,用4%多聚甲醛灌注及固定,石蜡包埋,用于HE染色及免疫组化检查。
1.5.1 大鼠肺组织:HE染色评定肺组织病理形态学改变:将固定好的大鼠右肺组织切成0.2cm厚的组织块,常规脱水、透明,石蜡包埋、切片,切片厚度为4μm,行HE染色,经烘片、脱蜡、染色、脱水、封固后,将肺组织标本切片在光学显微镜放大100倍下找到完整的细支气管横断面,每张切片选取3支,采用图像采集软件采集图像,评定肺组织病理形态学改变。再用图像分析软件测量分析,分别测算支气管内管壁(横断面)面积(WAi)、平滑肌(横断面)面积(WAm)、基底膜周长(Pbm),用基底膜周长对测定的内管壁面积和平滑肌面积测量值进行标准化,得出WAi/Pbm和WAm/Pbm,此数值可以一定程度反映内管壁和平滑肌厚度的变化。
1.5.2 免疫组化法检测肺组织 TGF-β1、Smad3、Smad7蛋白表达。将固定好的大鼠右肺组织切成0.2cm厚的组织块,常规脱水、透明,石蜡包埋、切片,切片厚度为4μm,常规脱蜡、水化,进行免疫组化染色。滴加一抗、4℃过夜,滴加生物素化二抗、链霉素化亲和素试剂、DAB显色、脱水、透明、封片、镜检。用PBS代替一抗作为阴性对照。每一标本取1张切片,每张切片随机取3个视野,用图像分析系统检测各指标PU值。
1.5.3 荧光定量PCR检测 TGF-β1、Smad3、Smad7mRNA相对表达。将50mg肺组织放入EP管中冰上剪碎,加入1mL TransZol试剂用电动匀浆器中对组织进行匀浆裂解,经分离、沉淀、洗涤、溶解等步骤将提取的总RNA保存于-80℃。每例RNA溶液各取0.5μL稀释250倍后测定提取的RNA样品在波长260nm和280nm处的OD值,各组随机挑选6个OD值介于1.6-1.8样品进行逆转录。随后将得到的cDNA进行PCR扩增。所用引物:TGF-β1上游引物序列(5’→3’)TGAGTGGCTGTCTTTTGACG,下游引物序列 (5’→ 3’)ACTTCCAACCCAGGTCCTTC,产物大小350bp[3];Smad3上游引物序列(5’→3’)CAGGGCTTTGAGGCTGTCTA,下游引物序列(5’→ 3’)CTGGCATCTTCTGTGGTTTC,产物大小357 bp;Smad7上游引物序列(5’→3’)CAGGGCTTTGAGGCTGTCTA,下游引物序列(5’→ 3’)CTGGCATCTTCTGTGGTTTC,产物大小256bp[4];Actb上游引物序列(5’→ 3’)GACCTTCAACACCCCAGC,下游引物序列(5’→3’)ACGCACGATTTCCCTCTC,产 物 大 小 256bp[5]。 反 应 条 件 为:95℃预变性2min;95℃变性20sec,55℃退火25sec,72℃延伸30sec进行40cycles。β-actin扩增作为参照。采用qRT-PCR法计算各组中目的mRNA的相对表达量,PCR表达结果用2-▲CT进行统计分析。
1.6 统计方法 数据用stata10.0分析软件进行统计分析,计量资料用表示,当方差齐性时各组处理效应差异用单因素方差分析,组间两两比较用scheffe法;当方差不齐时用Kruskal-Wallis检验,组间两两比较用Nemenyi法,P<0.05为有统计学意义。
2 结果及分析
2.1 大鼠肺组织气道学改变 B组气道上皮细胞脱落,杯状细胞增多气道粘膜水肿明显,气道粘膜层、粘膜下层以及血管周围组织可见有大量的炎性细胞浸润,以浆细胞、淋巴细胞和嗜酸性粒细胞为主。气道管腔缩小,甚至完全闭塞,气道腔内可见大量粘液,气管平滑肌增厚,个别肺泡出现融合现象。C、D、E、F组明显减轻,气道上皮不完整,气道粘膜轻度水肿,气道粘膜层、粘膜下层以及血管周围组织可见有少量的炎性细胞浸润,部分气道管腔缩小,气道腔内可见少量粘液,气管平滑肌轻度增厚(图1)。图像分析结果显示,与A组相比,B组WAm/Pbm、WAi/Pbm明显增加(P<0.01);与B组相比,C、D、E、F组明显减小(P<0.01)(表1)。
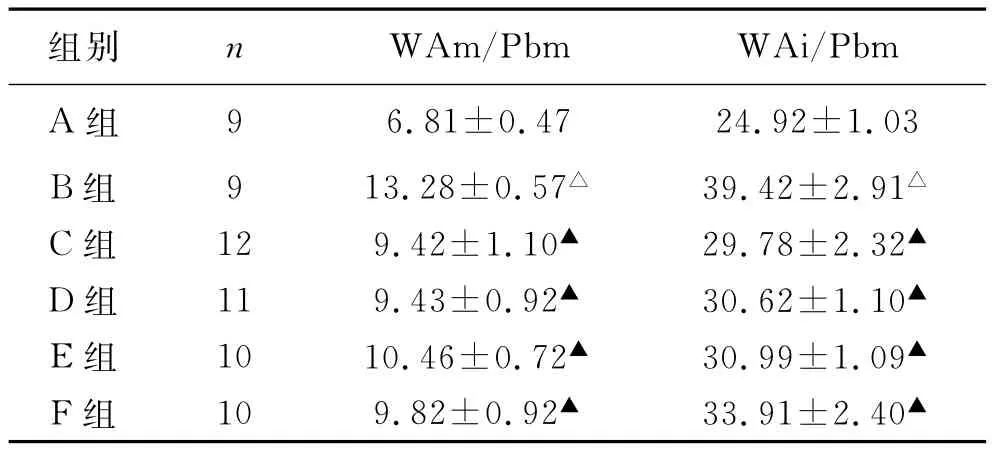
表1 肺组织形态学比较
2.2 肺组织 TGF-β1、Smadm3、Smad7蛋白表达 免疫组化结果显示,A组TGF-β1、Smad3在肺组织气道周围少量的阳性着色;与A组相比,B组表达明显增强(P<0.01),主要表达于胞质,主要分布于气道上皮;与B组相比,C、D、F组表达明显减轻(P<0.01)。A组Smad7蛋白在肺组织气道壁周围有较多阳性着色;与A组相比,B组表达明显减弱(P<0.01);与B组相比,C、D、E、F表达明显增强(P<0.01)(表2)。
2.3 肺组织 TGF-β1、Smad3、Smad7mRNA 相对表达与B组相比,C、F组TGF-β1相对表达量都明显下调(P<0.01),D组也有所下调(P<0.05),E组虽有所下调,但无统计学意义(P>0.05)(图2-a)。与B组相比,C、E 组Smad3表达明显下调(P<0.01),D组也有所下调(P<0.05),F组虽有所下调,但无统计学意义(P>0.05)(图2-b)。与B组相比,C、D组Smad7表达有所上调(P<0.05),E、F组虽有所上调,但无统计学意义(P>0.05)(图2-c)。×100
表2 大鼠肺组织TGF-β1、Smad3、Smad7蛋白表达比较(PU值)()
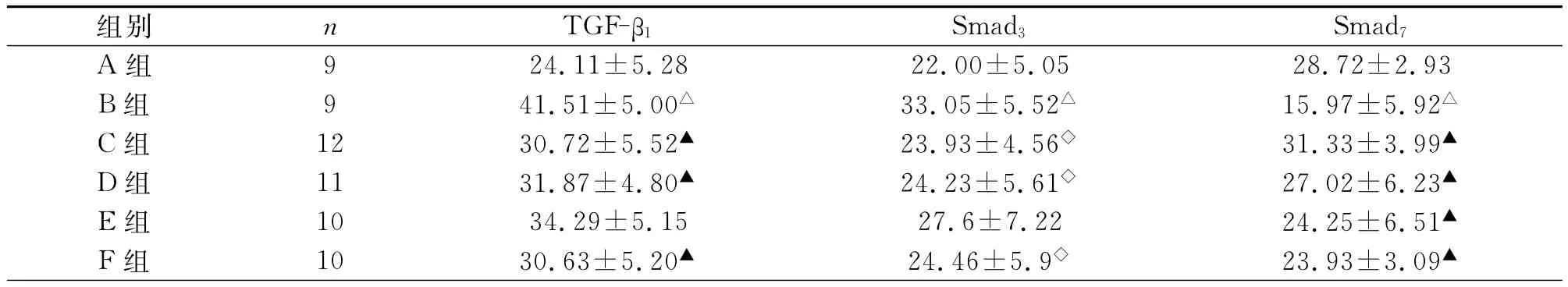
表2 大鼠肺组织TGF-β1、Smad3、Smad7蛋白表达比较(PU值)()
注:与A组相比,▲P<0.01。与B组相比,▲P<0.01,◇P<0.05
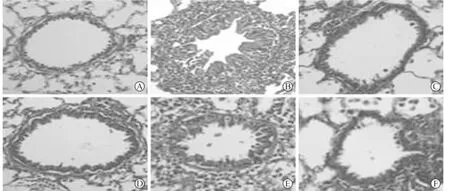
图1 大鼠肺组织病理形态学比较(HE染色 )
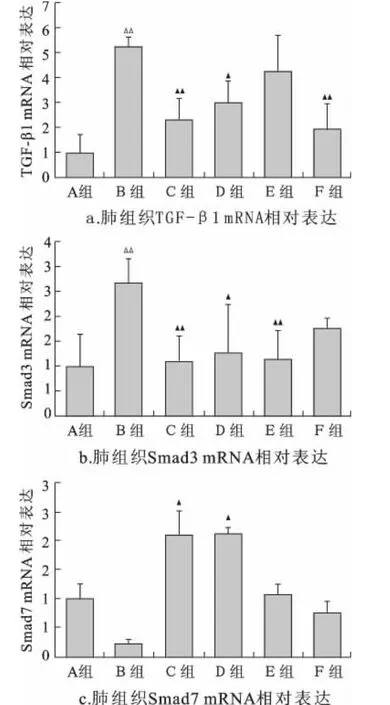
图2 大鼠肺组织 TGF-β1、Smad3、Smad7mRNA 表达比较
3 讨 论 哮喘发生时,气道壁的各个组分都会出现异常改变包括上皮细胞脱落、平滑肌肥大和增生、粘膜下胶原纤维沉积导致的基质成分增加、粘液腺增生肥大、新血管增生等,这些都可以导致气道壁面积的增大。祖国医学认为,各种慢性炎症反应导致的组织增生,属于痰、瘀范畴。哮喘气道厚度的改变(气道平滑肌增生、粘液腺增生、胶原沉着、基底膜增厚)属于中医无形之痰和血瘀相兼为病范畴。痰与瘀属于人体常见的病理产物,常常相兼为病,互相影响。究其原因,痰瘀同属阴津为病的不同表现。祖国医学认为,津血同源。津和血均源于饮食水谷精微,同属人体的阴液。二者在生理上互相转化,互相作用,参与体液调节,在病理上亦互相影响。故《景岳全书》云:“津凝血败,皆化为痰”。现代研究亦发现,支气管哮喘病人急性发作期全血粘度(高、中、低切变率)、血浆粘度、红细胞聚集指数均明显高于缓解期与对照组。哮喘缓解期血浆粘度、RAI恢复至接近正常对照组水平,但各切变率下的全血粘度仍高于正常对照组(P<0.05)。表明支气管哮喘病人急性发作期和缓解期存在不同程度的高粘滞血症[6]。宣肺化痰活血中药是在射干麻黄汤基础上加减而成,前期的研究发现能够改善哮喘的症状,能调节免疫、拮抗炎性介质、能够减少过敏性哮喘豚鼠电镜下肺部胶原纤维,改善毛细血管增厚的基底膜[7-11]。该方着眼于伏藏于肺络的痰和瘀,运用射干、椒目降气平喘,麻黄、细辛辛温解表散寒,宣泄肺之郁气,再加上半夏、桔梗等祛痰,地龙、桃仁活血通络。诸药合用,直达病所,达到改善气道重塑的目的。
TGF-β家族包括数种异构体,是细胞增殖、分化、细胞外基质合成和凋亡的主要调节者之一。巨噬细胞、上皮细胞、成纤维细胞和嗜酸性粒细胞都能够产生TGF-β1。TGF-β1是目前发现的刺激细胞外基质沉积活性最强的细胞因子。活化的TGF-β1能使Smad2/3磷酸化,并进入细胞核,调控相应的基因表达,重组细胞骨架成分,诱导其向肌成纤维细胞转化。肌成纤维细胞具有平滑肌和纤维细胞两种特性,能合成、分泌细胞外基质成分,特别是胶原纤维,是细胞外基质增厚的重要原因。研究发现,相对于正常人,中重度哮喘患者TGF-β1mRNA表达增加,且其表达量和上皮下纤维化直接相关[12-13]。在哮喘患者的气道中,平滑肌细胞分泌大量的 TGF-β1,分泌出的 TGF-β1反过来又促进平滑肌细胞和杯状细胞增生肥大,增加胶原和纤维连接蛋白合成,并促进其在细胞外基质沉积,导致管腔狭窄和不可逆的肺功能改变。TGF-β1能够通过减少MMPs的表达、促进PAI-1和TIMPs的合成来减少ECM的降解。还可以通过刺激ECM受体的合成,使整合素的合成增加而影响ECM的产生。
Smad蛋白为TGF-β1信号通路的下游信号关键传导分子,可将信号从胞膜直接传至胞核,介导TGF-β1胞内信号传导。Smad3是R-Smad蛋白家族成员,具有通路特异性;Smad7是ISmads蛋白家族成员,能抑制R-Smad的信号传递。Smad2和Smad3直接被TGF-βRI磷酸化,使得构象发生改变从而从受体复合物中释放出来。Smad7能通过与丝氨酸/苏氨酸激酶受体相 关 蛋 白 (serine-thre-onine kinase receptor-associated protein,STRAP)作用,与R Smads竞争TβRI,启动抑制功能。研究发现,在健康肺组织中几乎不能检测到Smad3表达,而在哮喘小鼠组Smad3表达水平显著上调[14]。Smad7与活化的TGF-β1I型受体结合就会阻止Smad2与I型受体结合和磷酸化,从而抑制TGF-β1信号传导,在哮喘机体起到拮抗气道重塑的作用[15]。
本研究通过免疫组化法和qRT-PCR方法检测肺组织TGF-β1、Smad3、Smad7的蛋白和 mRNA 的表达,结果发现,蛋白和基因表达两个侧面都显示B组大鼠肺组织TGF-β1、受体调节型蛋白Smad3表达水平均较A组大鼠明显升高(P<0.01),抑制转录型蛋白Smad7的蛋白表达有所减少(但P>0.05),说明哮喘气道重塑大鼠肺组织中TGF-β1/Smad信号通路处于激活状态,从而使胶原纤维合成增加,导致ECM进行性积聚。哮喘Smad7mRNA水平应该表达明显减少,此次虽然没有能够发现Smad7减少的表达与A组相比有统计学意义,但因为多组资料的非参数检验的两两比较方法比较保守,因此,B组中Smad7mRNA水平升高仍然值得关注。
与B组相比,C、D组TGF-β1、Smad3的蛋白和 mRNA的表达都明显减少(p<0.05),C、D组Smad7的蛋白和mRNA的表达明显增加(p<0.05),表明宣肺化痰活血法对 TGF-β1/Smad信号通路有抑制作用,其作用靶点可能是通过直接下调TGF-β1、Smad3的表达,同时也可能通过大量表达Smad7,从而与RSmads竞争TβR1,减少Smad3/Smad4异聚体的形成,抑制对TGF-β1在胞浆内的信号转导,减少胶原纤维沉着和气道上皮纤维化,从而改善气道重塑。
综上所述,宣肺化痰活血法可改善哮喘大鼠气道重塑,其机制可能与通过调节TGF-β1/Smad信号通路有关。
[1]Bousquet J,Jeffery PK,Busse WW,et al.Asthma:From bronchoconstriction to airways inflammation and remodeling[J].Am.J.Respir.Crit Care Med,2000,161:1720-45.
[2]吴银跟,王丽新.基质金属蛋白酶及其抑制剂在哮喘气道重塑中的作用及止喘胶囊的干预[J].中西医结合学报,2004,2(6):435-439.
[3]龚作炯,宋仕玲,阮 鹏,等.血管紧张素转换酶抑制剂对肝纤维化大鼠TGFb,TGFR II,Smad3,7表达的影响[J].世界华人消化杂志,2004,12(5):1132-1135.
[4]LIANG Tie-jun,YUAN Jun-hua,TAN Yan-rong,et al.Effect of ursodeoxycholic acid on TGF beta1/Smad signaling pathway in rat hepatic stellate cells[J].Chinese Medical Journal,2009,122(10):1209-1213.
[5]Li Rongping,Xi Yebin,Liu Xiuzhi,et al.Expression of IL-1α,IL-6,TGF-βFasL and ZNF265During Sertoli Cell Infection by Ureaplasma Urealyticum[J].Cellular & Molecular Immunology,2009,(3):215-221.
[6]刘 军,姒 惠,金桂玲.支气管哮喘患者血液流变学指标分析[J].中国血液流变学杂志,2004,2(2):261-262.
[7]刘小虹,钟亮环,单丽囡.射麻止喘方对哮喘急性发作期(寒哮)患者外周血IL-5、IL-8水平的影响[J].新中医,2006,8(8期):46-47.
[8]王 鹏.射麻止喘方对哮喘急性发作期患者外周血Th1/Th2偏移的影响及临床观察[D].广州中医药大学,2005.
[9]黄真炎,杨冬娣,昊玲霓,等.加味射干麻黄汤对过敏性哮喘豚鼠肺超微结构变化的电镜观察[J].中医药研究,1998,14(2):27-28.
[10]刘 琼,梁直英,陈芝喜,等.射麻止喘液对过敏性哮喘豚鼠的作用[J],广州中医药大学学报,2000,3(1):24-26.
[11]刘小虹,廖慧丽,梁直英,等.射麻止喘液对哮喘模型大鼠环核苷酸变化的影响[J].广州中医药大学学报,2001(04):339-341.
[12]Minshall EM,Leung DY,Martin RJ,et al.Eosinophil-associated TGF-Β1mRNA expression and airwaysfibrosis in bronchial asthma[J].Am J Respir Cell MolBiol,17:326-333,1997.
[13]Ohno I,Nitta Y,Yamauchi K,et al.Transforming growth factorβ1(TGFβ1)gene expression by eosinophils in asthmatic airway inflammation.[J]Am J Respir Cell Mol Biol,15:404-409,1996.
[14]Rosendahl AD,Checchin TE,Fehniger P,et al.Sideras.2001.Activation of the TGF-beta/activin-Smad2 pathway during allergic airway inflammation[J].Am.J.Respir.Cell Mol.Biol,25:60-68.
[15]Nakao A,Sagara H,Setoguchi Y,et al.Expression of Smad7in bronchial epithelial cells is inversely correlated to basement membrane thickness and airway hyperresponsiveness in patients with asthma[J].J Allergy Clin Immunol,2002,110(6):873-8.

