磁共振扩散加权成像检测值与慢性肾脏病滤过功能及病理的相关性研究
李 成,罗丹丹,龚良庚,曾 磊,周国盛,樊 烨,徐高四,涂卫平,房向东
慢性肾脏病 (chronic kidney disease,CKD)是威胁全球公共健康的主要疾病之一,肾脏病变严重程度与CKD临床诊治密切相关。目前,判断CKD病变程度的金标准是肾脏病理活检,虽有助于临床医生判断CKD的进展及预后,但却具有创伤性,且不便于病情的动态观察。99Tcm-二乙基三胺五乙酸 (DTPA)肾动态显像测定的分肾肾小球滤过率(SKGFR)具有一定的放射性,且空间分辨能力差,不利于观察肾脏的病理改变。磁共振 (MR)扩散加权成像 (diffusion weighted imaging,DWI)能敏感地检测活体水分子弥散运动,通过测量表观弥散系数 (apparent diffusion coefficient,ADC)值可反映病变内部结构及组织成分[1-2]。本研究旨在研究CKD患者的肾皮质和肾髓质ADC值与SKGFR及病理改变的相关性,探索DWI在CKD患者肾功能评估中的应用价值。
1 资料与方法
1.1 临床资料 收集2012年2—12月在南昌大学第二附属医院肾内科就诊的CKD患者50例 (100个肾脏)为CKD组,其中男29例,女21例;年龄24~66岁,平均45岁。均符合美国肾脏病基金会颁布的肾脏病生存质量指导 (K/DOQI)中关于CKD的定义[3],均为双肾弥漫性病变患者。排除双/单侧肾脏明显萎缩或合并肾脏其他疾病,如肾结石、肾积水、多发性肾囊肿等。其中18例患者行右肾穿刺活检,并对肾脏病理损伤程度进行了评分。另选取同时期体检健康志愿者20例 (40个肾脏)为对照组,其中男12例,女8例;年龄25~64岁,平均41岁。纳入标准:(1)临床没有肾脏疾病病史;(2)目前没有肾脏疾病的临床表现;(3)与肾功能有关的各项实验室检查指标均正常;(4)检查前先进行MR常规T1、T2加权扫描提示肾脏正常者;(5)最近没有服用有明显肾毒性的药物。
1.2 MR检查方法 采用GE Singa HDXT GE3.0 T磁共振扫描机。行常规 T1WI、T2WI肾脏扫描后,进行肾脏DWI成像。DWI采用单次激发回波平面 (SS-EPI)序列,重复时间 (TR)6 316 ms,回波时间 (TE)63.1 ms,矩阵 96×180,视野(FOV)340 mm ×240 mm,激励次数(NEX)8次,b值取800 s/mm2;以肾脏中心层面为扫描中心层面,层数6层,层厚8 mm,采用表面相控线圈,使用呼吸门控。应用空间预饱和技术抑制腹部脂肪信号,以减少化学位移伪影的影响。
DWI图像采用GE ADW 4.4工作站的Fuctool 9.4.05a软件包对扫描数据进行后处理,工作站软件系统自动生成彩色ADC图。在 DWI图上绘制感兴趣区(ROI),ROI均在肾门中心水平肾皮质、肾髓质分界清楚的区域选择,肾皮质ROI用自由线勾画出轮廓,注意避开T2WI上确认的肾囊肿等肾脏病变;肾髓质ROI用圆形工具在肾脏前、中、后份勾勒3个圆形区域,面积15~25 mm2,求其平均值作为每侧肾皮质和肾髓质的ADC值。
1.3 SKGFR测定 在MR检查前后1周内用99Tcm-DTPA肾动态显像测定SKGFR,仪器为美国GE公司生产的Infinia vc Hawkeye4双探头单光子发射计算机断层仪 (SPECT),检查时受检者取卧位,探头贴近后腰部,视野包括双侧肾,“弹丸”式静脉注射99Tcm-DTPA后即刻进行动态采集,计算SKGFR。目前,国际并未制定SKGFR的分级标准,结合国际公认的临床总肾小球滤过率 (GFR)分级标准[3],参考既往文献的报道[4]和我院核医学的参考范围对肾脏功能受损程度进行分组,将CKD组分为3组:肾功能正常组 (36个):GFR≥40 ml/min;肾功能轻度受损组 (44个):20 ml/min≤GFR<40 ml/min,肾功能中度受损组(20个):GFR<20 ml/min。
1.4 病理检测 用10%中性甲醛固定肾组织标本,经脱水、石蜡包埋制片 (1 μm),行常规苏木素-伊红染色、糖原染色、Masson染色及碘酸六胺银染色。免疫病理:选用快速敏感的直接免疫法。肾脏病理损伤程度采用Katafuchi肾病评分系统[5]:总分27分,包括肾小球积分1~12分,肾小管-间质积分0~9分,血管积分0~6分。病理损害积分为其三者相加。
1.5 统计学方法 采用SPSS for Windows 16.0统计软件包分析数据。计量资料以(±s)表示,多组间比较采用方差分析,两组间比较采用t检验;相关关系采用Pearson相关分析法。以P<0.05为差异有统计学意义。
2 结果
2.1 对照组与不同肾功能CKD组肾皮质和肾髓质ADC值比较 对照组及不同肾功能CKD组患者肾皮质ADC值均大于肾髓质,差异有统计学意义 (P<0.05);对照组与不同肾功能CKD组肾皮质和肾髓质ADC值比较,差异有统计学意义(P<0.05);其中肾功能正常组、肾功能轻度受损组、肾功能中度受损组肾皮质和肾髓质ADC值较对照组降低,肾功能轻度受损组、肾功能中度受损组较肾功能正常组降低,肾功能中度受损组较肾功能轻度受损组降低,差异均有统计学意义 (P<0.05,见表1)。
2.2 CKD患者肾皮质和肾髓质ADC值与肾脏滤过功能的相关性 CKD组肾皮质ADC值与SKGFR呈正相关(r=0.697,P<0.01,见图1);肾髓质ADC值与SKGFR呈正相关 (r=0.800,P<0.01,见图2)。
2.3 CKD患者肾皮质和肾髓质ADC值与病理损害程度的相关性 CKD患者肾皮质ADC值与病理损害积分呈负相关 (r=-0.814,P<0.01,见图3);肾髓质ADC值与病理损害积分呈负相关 (r=-0.800,P <0.01,见图4)。

图1 CKD患者肾皮质ADC值与SKGFR的相关性Figure 1 Correlation between cortical ADC values and GFR in CKD patients
表1 对照组与不同肾功能CKD组肾皮质和肾髓质ADC值比较 (±s)Table 1 Comparison of cortical and medullary ADC values between the control group and the CKD group

表1 对照组与不同肾功能CKD组肾皮质和肾髓质ADC值比较 (±s)Table 1 Comparison of cortical and medullary ADC values between the control group and the CKD group
注:与对照组比较,*P<0.05;与肾功能正常组比较,△P<0.05;与肾功能轻度受损组比较,▲P<0.05
?

图2 CKD患者肾髓质ADC值与SKGFR的相关性Figure 2 Correlation between medullary ADC values and GFR in CKD patients
3 讨论

图3 肾皮质ADC值与病理损害积分的相关性Figure 3 Correlation between cortical ADC values and scores of pathological lesion in CKD patients
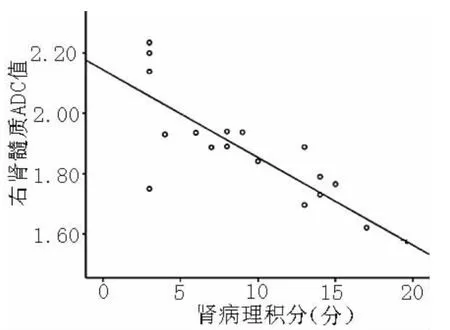
图4 肾髓质ADC值与病理损害积分的相关性Figure 4 Correlation between medullary ADC values and scores of pathological lesion in CKD patients
DWI是一种对水分子扩散运动敏感的成像技术,反映组织内分子活动的自由度,间接反映组织的结构特点。CKD患者的肾脏功能受损时,常引起肾小球硬化、间质炎症和纤维化、肾小管萎缩和增生,使得肾小球血流动力学改变、肾小管和间质水的转运功能减轻,这一系列变化都可影响水分子的扩散运动,从而表现出与正常人不同的ADC值。ADC值由代表DWI的扩散敏感度的b值计算得出,大b值反映水分子的扩散,小b值主要反映组织灌注和水分子扩散的综合情况。当b值取值较大时测得的ADC值能较真实地反映扩散情况,但过大的b值又会使图像的信噪比下降[6]。为了兼顾扩散成像质量和弥散强度,本研究将b值定为800 s/mm2。
3.1 ADC值在CKD患者肾功能评价中的价值 以往多个研究结果均证实CKD患者肾脏ADC值较正常人显著降低[7-8],但部分研究因所得图像中肾脏成像比较差,故采用测量整个肾脏ADC值的方法,且大部分研究并未深入探讨DWI在不同分期患者之间的应用价值。本研究采用3.0 T磁共振,可获得高分辨率的DWI图像,能够更清晰地显示皮髓质分界,进而可以分别测量肾皮质和肾髓质的ADC值。结果表明,对于CKD患者,肾皮质和肾髓质ADC值显著低于健康人,且随着肾功能水平的下降,肾皮质和肾髓质ADC值均呈下降的趋势,与以往研究结果一致[4,8]。本研究结果显示,对照组和不同肾功能CKD组肾皮质和肾髓质ADC值均存在差异,表明在采用大 b值条件下,ADC值对不同分期的鉴别具有一定的诊断效能。此外,Heyman等[9]的研究显示肾脏还受年龄因素的影响,随着年龄的增加,肾小球开始不断硬化,肾血流量及GFR降低,以致肾脏ADC值也随之发生变化。本研究中CKD组与对照组在年龄方面基本匹配,避免了年龄差异可能带来的影响。
3.2 肾皮质和肾髓质ADC值与SKGFR的相关性 多个研究小组证实肾脏ADC值与GFR之间存在相关性。Carbone等[10]认为CKD患者的肾ADC值与eGFR呈正相关,Xu等[4]同样得出类似结论,报道了肾脏ADC值与单侧肾脏的GFR间相关系数为0.70。本研究结果表明CKD患者肾皮质和髓质的ADC值均与SKGFR呈正相关。分析其原因可能是由于肾间质在肾髓质内占有的体积比皮质大,大量临床及病理研究认为肾间质病变的严重程度与GFR的下降密切相关,决定着肾脏疾病的预后[11-12];即使肾小球严重病变,若尚未伴随明显的肾间质损伤,也不会出现GFR明显下降。因此,肾髓质ADC值对滤过功能的改变较敏感,在一定程度上能更好地反映肾功能的水平。同时,本研究结论也与 Toya等[13]研究得出的肾脏ADC与eGFR之间相关性很差的结论相悖,分析可能与b值的选择和ROI的定位不同有关。
3.3 肾皮质和肾髓质ADC值与病理损害积分的相关性 肾穿刺活检目前是评价肾脏病变严重程度的金标准,但为有创性检查,有一定的风险,且不便于病情的动态观察。寻求一种无创检查来评价肾功能变化及病理损害程度是临床工作亟待解决的问题。本研究中活检病理组织内可见不同程度的肾小球硬化,小球系膜增生;肾间质单核细胞浸润及灶状纤维化,这些病理损害均引起了肾小球及肾小管含水量的减少以及细胞外水分子的弥散受限,在DWI上表现为肾实质ADC值的降低,因此,ADC值能够反映肾实质的病理损害程度,值得深入研究。Inoue等[14]检测的37例无糖尿病合并症并经肾穿刺活检的CKD患者的肾皮质ADC值,结果表明随着肾间质纤维化程度的加重,肾皮质ADC值有减小趋势,国内学者李琼等[15]也得出相同的结论。本研究结果显示肾皮质和肾髓质ADC值与病理损害积分呈负相关,但相关系数均不是太高,分析可能与收集的肾穿刺活检病理患者较少有关。本研究中另外一项有意义的发现是有3例轻度病理损害患者ADC值高于对照组,分析其原因可能与CKD早期存在代偿机制,使得肾血流灌注增加、肾小球肥大,导致肾含水量和细胞外水分子扩散运动增加有关。
本研究还存在一些问题和不足:(1)本研究搜集的病例有限,尤其是穿刺活检病例相对较少,因此并未对不同病理类型的CKD患者的ADC值变化规律分别进行分析;(2)本研究采用的是单个b值,不同b值对肾ADC值的影响还需进一步研究。
综上所述,DWI测量的ADC值是评估CKD患者肾脏功能的有效方法,CKD患者肾皮质和肾髓质ADC值降低,与肾脏滤过功能及病理损害积分之间存在相关性。作为无创性功能成像技术,DWI能够在分子水平反映肾脏的功能状态,为临床评价CKD及其功能变化提供一种新的方法。
1 Bruegel M,Holzapfel K,Gaa J,et al.Characterization of focal liver lesions by ADC mesurements using a respiratory triggered diffusionweighted single-shot echo-planar MR imaging technique[J].Eur Radiol,2008,18(3):477-485.
2 Nikken JJ,Krestin GP.MRI of the kidney -state of the art[J].Eur Radiol,2007,17(11):2780-2793.
3 National Kidney Foundation.K/DOQI clinical practice guidelines for chronic kidney disease:evaluation, classification, and stratfication[J].Am J Kidney Dis,2002,39(2 Suppl 1):S1-S266.
4 Xu Y,Wang X,Jiang X,et al.Relationship between the renal apparent diffusion coefficient and glomerular filtration rate:preliminary experience[J].J Magn Reson Imaging,2007 26(3):678-681.
5 Katafuchi R,Kiyoshi Y,Oh Y,et al.Glomemlar score as a prognosticator in IgA nephropathy:its usefulness and limitation[J].Clin Nephrol,1998,49(1):1 -8.
6 Moteki T,Horikoshi H.Evaluation of hepatic lesions and hepatic parenchyma using diffusion-weighted echo-planar MR with three values of gradient b-factor[J].J Magn Reson Imaging,2006,24(3):637-645.
7 Kim S,Naik M,Sigmund E,et al.Diffusion-weighted MR imaging of the kidneys and the urinary tract[J].Magn Reson Imaging Clin N Am,2008,16(4):585-596.
8 徐学勤,林晓珠,陈克敏,等.MR扩散加权成像在慢性肾病肾功能损害方面的价值研究[J].临床放射学杂志,2011,30(9):1330-1333.
9 Heyman SN,Khamaisi M,Rosen S,et al.Renal parenchymal hypoxia,hypoxia response and the progression of chronic kidney disease[J].Am J Nephrol,2008,28(6):998 -1006.
10 Carbone SF,Gaggioli E,Ricci V,et al.Diffusion-weighted magnetic resonance imaging in the evaluation of renal function:a preliminary study[J].Radiol Med,2007,112(8):1201-1210.
11 Palm F,Nordquist L.Renal tubulointerstitial hypoxia:cause and consequence of kidney dysfunction[J].Clin Exp Pharmacol Physiol,2011,38(7):474 -480.
12 Meckensen-Haen S,Bader R,Grund KE,et al.Correlations between renal cortical interstitial fibrosis,atrophy of proximal tubules and impairment of glomerular filtration rate[J].Clin Nephrol,1981,15(4):167 -171.
13 Toya R,Naganawa S,Kawai H,et al.Correlation between estimated glomerular filtration rate(eGFR)and apparent diffusion coefficient(ADC)values of the kidneys[J].Magn Reson Med Sci,2010,9(2):59 -64.
14 Inoue T,Kozawa E,Okada H,et al.Noninvasive evaluation of kidney hypoxia and fibrosis using magnetic resonance imaging[J].J Am Soc Nephrol,2011,22(8):1429 -1434.
15 李琼,张泉,孙浩然,等.慢性肾脏病的皮髓质ADC值与肾脏功能及病理的相关性研究[J].临床放射学杂志,2012,31(4):515-519.

