富硒麦芽冲剂对小鼠免疫功能的影响
张荣泉,吕方,赵亚新,罗威 ,郭大生
(1.天津市医药科学研究所,天津 300020;2.天津市新天马企业发展有限公司,天津 300221)
硒是人和动物所必需的微量元素,有多种重要的生物学功能。硒几乎存在于所有免疫细胞中,补充硒可提高机体免疫力,从而起到防病的效果。自然界中,以0价态存在的硒是单质硒,难以被生物吸收利用,生物学作用极低;无机硒中硒的价态是4+,6+,常见的这类化合物有Na2SeO3,Na2SeO4;有机硒中硒的价态通常是以-2存在,或者是与其他物质以络合态存在。硒的毒性就依赖于其化学形式[1]。
有机硒,特别是通过植物、微生物转化富集的有机硒,具有毒性低、吸收率高、生物利用率高及对环境污染小等优点,成为当前研究和开发的热点。
麦苗具有的营养价值要大于麦籽粒,利用其种芽生长代谢迅速,营养转化较快的特点,可将无机硒富集转化成为有机硒,有研究报道,这种富硒大麦苗的原汁可以提高小鼠腹腔巨噬细胞吞噬能力和抗鸡红细胞抗体的效价等免疫功能指标[2]。富硒麦芽干粉还含一定量VE和VC前体,其毒性试验显示急性毒性为实际无毒,三项致突变试验均为阴性结果[3]。
为便于保存,方便食用,本实验将富硒麦芽苗的干粉为原料,制备成富硒麦芽冲剂,通过动物试验观察富硒麦芽冲剂对小鼠免疫功能的调节作用。
1 材料与方法
1.1 样品与试剂
富硒麦芽冲剂:批号 20110706,Se 0.667 mg/kg,天津市医药研究开发公司生产;MTT、RPMI1640细胞培养液:Gibco公司;小牛血清:中科院血液学研究所;绵羊红细胞(SRBC)、补体(豚鼠血清)、SA缓冲液、Hank's液、鸡红细胞、Giemsa染液、PBS缓冲液、LDH基质液、HCI、YAC-1细胞等。
1.2 实验动物
SPF级昆明种小鼠(雌性,160只,体重 18 g~22 g):中国人民解放军军事医学科学院卫生学环境医学研究所提供,合格证号:SCXK-(军)2009-003 0000371。
1.3 方法
动物免疫功能实验方法按照《保健食品检验与评价技术规范(2003版)》规定进行[4]。
1.3.1 剂量选择和分组
本试验设3个剂量组,分别为1.0 g/kg·BW(低剂量组)、2.0 g/kg·BW(中剂量组)、4.0 g/kg·BW(高剂量组),各组分别称取富硒麦芽冲剂10.0、20.0、40.0g,加蒸馏水至200 mL,混合均匀;每天灌胃一次,每次0.2 mL/10g·BW,对照组给予等量蒸馏水,连续30 d,末次给受试物后24 h测定各项指标。
将小鼠随机分为4个大组(Ⅰ、Ⅱ、Ⅲ和Ⅳ),每大组40只小鼠,每大组小鼠又分为4个小组,分别为对照组和低、中、高3个剂量组,每组10只;Ⅰ组进行HC50测定、抗体生成细胞检测和迟发型变态反应;Ⅱ组进行小鼠腹腔巨噬细胞吞噬鸡血红细胞实验和脏器/体重比值测定;Ⅲ组进行碳廓清实验;Ⅳ在进行小鼠脾淋巴细胞转化实验和NK细胞活性测定。
1.3.2 半数溶血值(HC50)的测定
给予受试物第25天后,每只动物腹腔注射2%SRBC0.2 mL,再继续给受试物至第30天时,眼内眦取血,离心收集血清,SA缓冲液稀释300倍。管内加入1 mL稀释的血清、0.5 mL 10%SRBC和1 mL补体。另设不加血清对照管,37℃水浴20 min后,冰浴终止反应。离心取1 mL上清,加3 mL都氏试剂为样品管,同时加25 mL 10%SRBC加都氏试剂至4 mL用以测定SRBC半数溶血时的光密度值,充分混匀,放置10 min后,540 nm处测定各管光密度值。
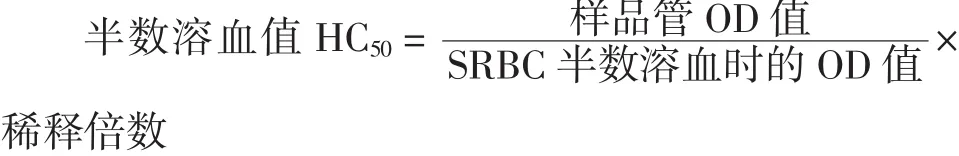
1.3.3 抗体生成细胞检测
给予受试物第25天后,每只动物腹腔注射2%SRBC的0.2 mL,继续给予受试物第30天后,脱臼处死小鼠取脾脏,制成细胞悬液,调整细胞浓度为5×106个/mL。将表层培养基加热溶解,45℃水浴保温,与等量2倍浓度Hank's液混合,分装小试管,每管0.5 mL,加入50 μL 10%SRBC,20 μL 脾细胞悬液,混匀倒片,CO2培养箱培养1 h~1.5 h,加入用SA缓冲液稀释的补体(1∶10),继续培养1 h,计数溶血空斑数。
抗体生成细胞数(103/全脾)=观察空斑数×稀释倍数(400)/1 000
1.3.4 迟发型变态反应(足跖增厚法)
给予受试物第25天后,每只鼠腹腔注射0.2 mL 2%SRBC,再继续给受试物至第30天时测量左后足距部厚度,同时在测量部位注射20 μL 20%SRBC,注射24 h后测量左后足距部厚度,同一部位测量三次,取平均值。
攻击前后足趾厚度差值(mm)=攻击后足趾厚度-攻击前足趾厚度
1.3.5 小鼠腹腔巨噬细胞吞噬鸡血红细胞实验(半体内法)
给予受试物第32天,各组小鼠腹腔注射1mL20%鸡红细胞悬液,30 min后颈椎脱臼处死小鼠,腹腔注射生理盐水2 mL,按揉腹壁1 min,吸出1 mL腹腔洗液,分滴于2片载玻片,置37℃孵育30 min,冲洗、固定,Giemsa染液染色计数。每张片计数100个,按照下式计算吞噬指数和吞噬百分率[9]:

1.3.6 脏器/体重比值测定
给予受试物第30天,取胸腺、脾脏,分别称出胸腺、脾脏重量,计算脏器/体重比值。
1.3.7 小鼠碳廓清实验
给予受试物31 d后,尾静脉注射3.5倍稀释的印度墨汁(0.1 mL/10 g·BW),分别于第 2、10分钟眼内毗取血20μL,加入到2.98mL0.1%碳酸钠溶液中,600nm处测定各管光密度值。另取肝、脾称重,按下式计算吞噬指数。

1.3.8 ConA诱导的小鼠脾淋巴细胞转化试验(MTT法)
给予受试物33 d,无菌取脾,制成单细胞悬液。用Hank's液洗3次,每次1 000 r/min离心10 min,调整细胞浓度为3×106个/mL,并将细胞悬液分两孔加入24孔培养板中,每孔 1 mL,一孔加75 μL ConA液(100 μg/mL),另一孔为对照,置 5%CO2,37℃孵箱中培养72 h。结束前,每孔吸去上清液0.7 mL,加入0.7 mL不含小牛血清的RPMI1640培养液,同时加入MTT(5 mg/mL)50 μL/孔,继续培养。结束后,分装 96孔培养板中,每个孔作3个平行孔,用酶标仪以570 nm波长测定光密度值。按下式计算光密度差值。
光密度(ABS)差值=加ConA孔光密度-未加ConA孔光密度
1.3.9 NK细胞活性测定(乳酸脱氢酶测定法)
试验前24小时将YAC-1细胞(靶细胞)进行传代培养,用RPMI1640完全培养液调整细胞浓度为4×105个/mL。无菌取脾,制成单细胞悬液。调整细胞浓度为2×107个/mL。取靶细胞和效应细胞各100 μL(效靶比50∶1),加入96孔培养板,靶细胞自然释放孔加靶细胞和培养液各100 μL,靶细胞最大释放孔加靶细胞和1%NP40各100 μL,设3个平行孔,37℃,5%CO2培养箱中培养4 h,每孔吸取上清液100 μL置96孔培养板中,同时加入100 μL LDH基质液,反应3 min,每孔加入30 μL 1mol/L的HCl,在酶标仪492 nm按下式计算NK细胞活性:

1.4 试验数据统计
数据用SPSS11.5 for windows进行统计分析,对照组与实验组采用方差分析,如方差不齐者采用数据转换,转换后仍不齐采用非参数统计。
2 结果与分析
2.1 富硒麦芽冲剂对小鼠体重的影响
富硒麦芽冲剂对小鼠体重的影响,见表1。
表1 受试物对免疫Ⅰ组小鼠体重增重的影响(g,±s)Table 1 The impact of test sample on weight gain of mice in ImmuneⅠgroup(g,x ±s)
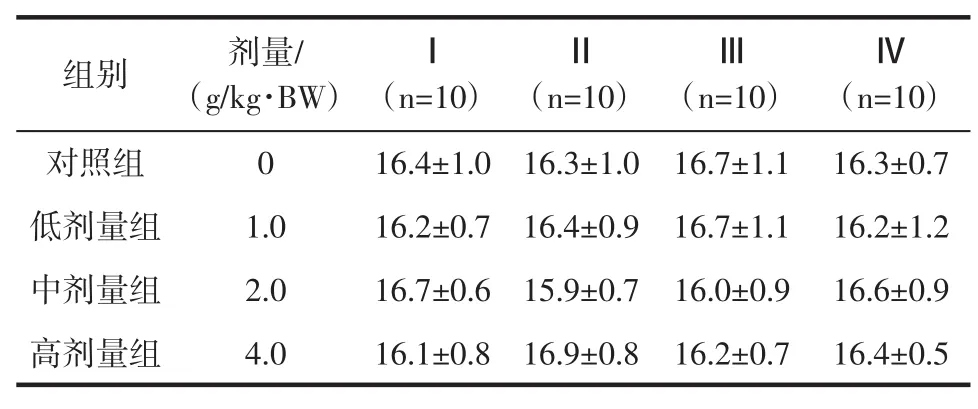
表1 受试物对免疫Ⅰ组小鼠体重增重的影响(g,±s)Table 1 The impact of test sample on weight gain of mice in ImmuneⅠgroup(g,x ±s)
组别 剂量/(g/kg·BW)ⅠⅡⅢⅣ(n=10)对照组 0 16.4±1.0 16.3±1.0 16.7±1.1 16.3±0.7低剂量组 1.0 16.2±0.7 16.4±0.9 16.7±1.1 16.2±1.2中剂量组 2.0 16.7±0.6 15.9±0.7 16.0±0.9 16.6±0.9高剂量组 4.0 16.1±0.8 16.9±0.8 16.2±0.7 16.4±0.5(n=10) (n=10) (n=10)
由表1可见,经口给予不同剂量的富硒麦芽冲剂30 d后,各组动物生长活动良好,各剂量组动物增重与对照组比较,差异均无统计学意义(P>0.05)。
2.2 富硒麦芽冲剂对小鼠脏器/体重比值的影响
富硒麦芽冲剂对小鼠脏器/体重比值的影响,见表2。
由表2可见,各剂量组动物脾脏、胸腺与对照组比较,差异均无统计学意义(P>0.05)。
表2 受试物对小鼠脏器/体重比值的影响(±s)Table 2 The impact of test sample on organ/body weight ratio of mice(±s)

表2 受试物对小鼠脏器/体重比值的影响(±s)Table 2 The impact of test sample on organ/body weight ratio of mice(±s)
脾脏/体重比值/%对照组 0 10 27.5±1.6 39.8±2.9低剂量组 1.0 10 28.2±2.0 39.1±3.2中剂量组 2.0 10 26.9±2.6 40.1±2.6高剂量组 4.0 10 27.8±1.4 38.5±3.1组别 剂量/(g/kg·BW) 动物数/只 胸腺/体重比值/%
2.3 富硒麦芽冲剂对体液免疫的影响
2.3.1 富硒麦芽冲剂对小鼠半数溶血值(HC50)的影响
富硒麦芽冲剂对小鼠半数溶血值(HC50)的影响,见表3。由表3可见,高剂量组的小鼠半数溶血值(HC50)高于对照组,且差异有统计学意义(P<0.05),中、低剂量组小鼠半数溶血值(HC50)与对照组比较,差异无统计学意义(P>0.05)。
表3 受试物对小鼠半数溶血值(HC50)的影响(g,平均值±s)Table 3 The impact of test sample on half hemolysis value(HC50)of mice(±s)
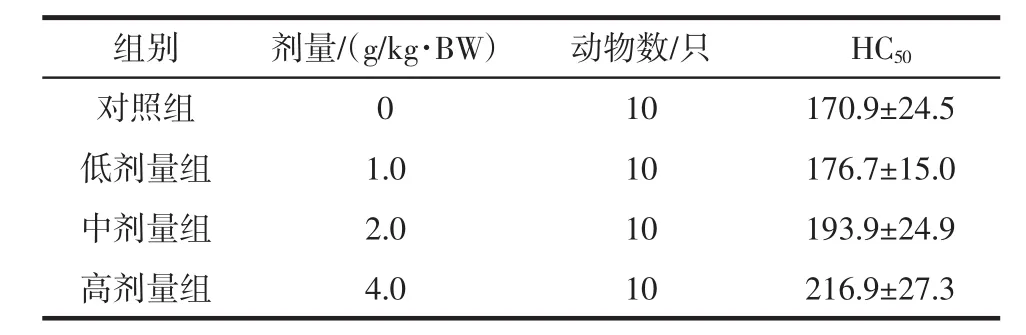
表3 受试物对小鼠半数溶血值(HC50)的影响(g,平均值±s)Table 3 The impact of test sample on half hemolysis value(HC50)of mice(±s)
注:*与对照组比较P<0.05。
组别剂量/(g/kg·BW)动物数/只HC50对照组 0 10 170.9±24.5低剂量组 1.0 10 176.7±15.0中剂量组 2.0 10 193.9±24.9高剂量组 4.0 10 216.9±27.3
2.3.2 富硒麦芽冲剂对小鼠抗体生成细胞试验的影响
富硒麦芽冲剂对小鼠抗体生成细胞试验的影响,见表4。
表4 受试物对小鼠抗体生成细胞的影响(±s)Table 4 The impact of test sample on the antibody-producing cells of mice(±s)
注:*与对照组比较P<0.05。
组别剂量/(g/kg·BW)动物数/只溶血空斑数(×103/全脾)对照组 0 10 34.4±10.7低剂量组 0.25 10 41.6±12.7中剂量组 0.50 10 46.8±10.5*高剂量组 1.00 10 49.7±8.7*
由表4可见,中、高剂量组的小鼠抗体生成细胞数高于对照组,且差异有统计学意义(P<0.05),低剂量组小鼠抗体生成细胞数与对照组比较,差异无统计学意义(P>0.05)。
2.4 富硒麦芽冲剂对小鼠细胞免疫功能的影响
2.4.1 富硒麦芽冲剂对小鼠迟发型变态反应(足距增厚法)的影响
富硒麦芽冲剂对小鼠迟发型变态反应(足距增厚法)的影响,见表5。
表5 受试物对小鼠迟发型变态反应(足距增厚法)的影响(±s)Table 5 The impact of test sample on the delayed allergy of mice(foot from thickening method)(±s)
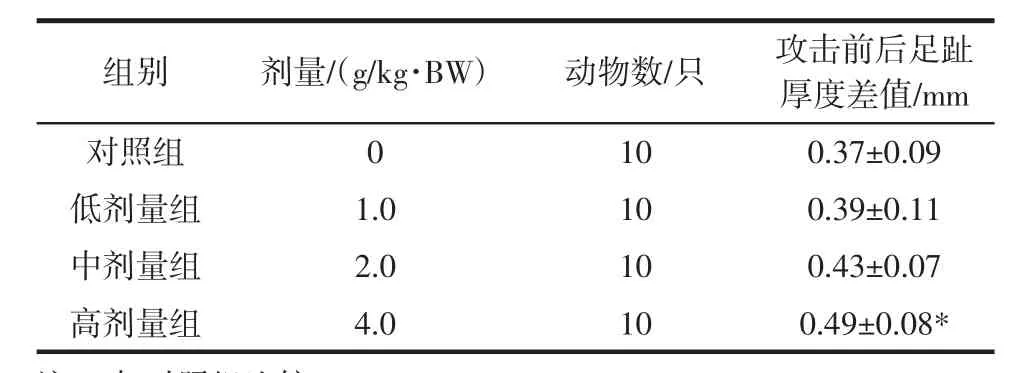
表5 受试物对小鼠迟发型变态反应(足距增厚法)的影响(±s)Table 5 The impact of test sample on the delayed allergy of mice(foot from thickening method)(±s)
注:*与对照组比较P<0.05。
组别剂量/(g/kg·BW)动物数/只攻击前后足趾厚度差值/mm对照组 0 10 0.37±0.09低剂量组 1.0 10 0.39±0.11中剂量组 2.0 10 0.43±0.07高剂量组 4.0 10 0.49±0.08*
由表5可见,高剂量组的小鼠攻击前后足趾厚度差值高于对照组,且差异有统计学意义(P<0.05),中、低剂量组小鼠攻击前后足趾厚度差值与对照组比较,差异无统计学意义(P>0.05)。
2.4.2 富硒麦芽冲剂对ConA诱导小鼠脾淋巴细胞转化试验(MTT法)的影响
富硒麦芽冲剂对ConA诱导小鼠脾淋巴细胞转化试验(MTT法)的影响,见表6。
表6 受试物对ConA诱导小鼠脾淋巴细胞转化试验的影响(±s)Table 6 The impact of test sample on the mice splenic lymphocyte transformation by ConA induction(±s)
表6 受试物对ConA诱导小鼠脾淋巴细胞转化试验的影响(±s)Table 6 The impact of test sample on the mice splenic lymphocyte transformation by ConA induction(±s)
组别剂量/(g/kg·BW)动物数/只光密度差值对照组 0 10 0.247±0.032低剂量组 1.0 10 0.260±0.038中剂量组 2.0 10 0.251±0.032高剂量组 4.0 10 0.274±0.022
由表6可见,低、中、高三个剂量组小鼠脾淋巴细胞转化与对照组比较,差异均无统计学意义(P>0.05)。
2.5 富硒麦芽冲剂对单核一巨噬细胞功能的影响
2.5.1 富硒麦芽冲剂对小鼠腹腔巨噬细胞吞噬鸡红细胞试验的影响
富硒麦芽冲剂对小鼠腹腔巨噬细胞吞噬鸡红细胞试验的影响,见表7。
表7 受试物对小鼠腹腔巨噬细胞吞噬鸡红细胞试验的影响(±s)Table 7 The impact of test sample on the mice peritoneal macrophage phagocytosing chicken red blood cell test(±s)

表7 受试物对小鼠腹腔巨噬细胞吞噬鸡红细胞试验的影响(±s)Table 7 The impact of test sample on the mice peritoneal macrophage phagocytosing chicken red blood cell test(±s)
组别 剂量/(g/kg·BW) 动物数/只 动物数吞噬百分率/% 吞噬指数对照组 0 10 23.7±4.6 0.274±0.041低剂量组 0.25 10 24.6±5.1 0.286±0.055中剂量组 0.50 10 25.1±4.9 0.291±0.045高剂量组 1.00 10 22.5±3.5 0.269±0.031
由表7可见,三个剂量组小鼠的吞噬百分率及吞噬指数与对照组比较,差异均无统计学意义(P>0.05)。
2.5.2 富硒麦芽冲剂对小鼠碳廓清试验的影响
富硒麦芽冲剂对小鼠碳廓清试验的影响,见表8。
表8 受试物对小鼠碳廓清试验的影响(±s)Table 8 The impact of test sample on mice carbon clearance test(±s)

表8 受试物对小鼠碳廓清试验的影响(±s)Table 8 The impact of test sample on mice carbon clearance test(±s)
组别剂量/(g/kg·BW)动物数/只吞噬指数a对照组 0 10 5.80±0.88低剂量组 0.25 10 5.98±1.02中剂量组 0.50 10 6.21±0.85高剂量组 1.00 10 5.94±0.65
由表8可见,低、中、高三个剂量组的小鼠吞噬指数与对照组比较,差异无统计学意义(P>0.05)。
2.6 富硒麦芽冲剂对NK细胞活性的影响
富硒麦芽冲剂对NK细胞活性的影响,见表9。
表9 受试物对小鼠NK细胞活性的影响(乳酸脱氢酶测定法)(±s)Table 9 The impact of test sample on the activity of natural killer cells in mice(lactate dehydrogenase assay)(±s)

表9 受试物对小鼠NK细胞活性的影响(乳酸脱氢酶测定法)(±s)Table 9 The impact of test sample on the activity of natural killer cells in mice(lactate dehydrogenase assay)(±s)
注:*与对照组比较P<0.05。
组别剂量/(g/kg·BW)动物数/只NK细胞活性/%对照组 0 10 20.9±6.1低剂量组 0.25 10 19.1±7.9中剂量组 0.50 10 31.7±7.1*高剂量组 1.00 10 32.7±10.2*
由表9可见,NK细胞活性检测显示中、高剂量组的NK细胞活性高于对照组,且差异有统计学意义(P<0.05),低剂量组的NK细胞活性与对照组比较,差异无统计学意义(P>0.05)。
经口给予不同剂量的富硒麦芽冲剂30 d后,各组动物生长活动正常。小鼠半数溶血值(HC50)试验显示,高剂量组的半数溶血值(HC50)高于对照组,且差异有统计学意义(P<0.05);小鼠抗体生成生成试验显示,中、高剂量组的小鼠抗体生成细胞数高于对照组,且差异有统计学意义(P<0.05);小鼠迟发型变态反应试验显示,高剂量组小鼠攻击前后足距厚度差值高于对照组,且差异有统计学意义(P<0.05);NK细胞活性检测显示,中、高剂量组NK细胞活性高于对照组(P<0.05)。其它各项试验未见免疫抑制现象。
3 结果与讨论
植物中存在的有机硒主要是硒蛋氨酸,与无机硒源亚硒酸钠相比,不具有氧化性,且在机体组织内沉留率较高,安全范围较大。秦秦的研究结果显示,富硒麦芽的有机硒,毒性低于亚硒酸钠[2]。
研究认为,硒在机体内有两个代谢库,硒蛋氨酸(Se-Mef)库和其它形式硒库。硒蛋氨酸可储存于“Se-Mef库”中,其他形式的硒不能转化为Se-Mef储存体内,因此欲维持机体有一定量的硒储备,用硒蛋氨酸形式为佳。目前已测定出小麦、玉米和酵母等所含的硒,以硒蛋氨酸形式为主。植物中的有机硒种类很多,可从中筛选出安全有效的原料或添加剂[5-6]。
富硒麦芽与其它硒产品比较,除含硒外,还含有膳食纤维、胡萝卜素、尼克酸和维生素、叶绿素等活性物质,特别还含有丰富的酶。富硒麦芽中的酶提高所含硒的吸收利用率,又增强所含硒的生理功能,硒和酶的相互协同作用。
已有富硒麦芽对肿瘤方面的作用研究报道[7-9],对小鼠免疫功能方面研究的报道使用的是新鲜富硒大麦苗原汁[2],与富硒麦芽原汁、富硒麦芽粉比较,将富硒麦芽粉制备成富硒麦芽冲剂,功效成分含量差异较小,使硒的食用剂量准确安全可控;服用方便,特别适合有吞咽障碍或困难的人群,使用者服用的依从性好;便于保存、携带和运输。
本试验以富硒麦芽粉为原料,制备成富硒麦芽冲剂,进行动物试验观察其对免疫功能的影响。结果显示:富硒麦芽冲剂对小鼠体液免疫作用明显,体液免疫指标,半数溶血值(HC50)测定中的高剂量组及抗体生成细胞检测中的中、高剂量组结果均高于对照组(P<0.05);在细胞免疫指标,迟发型变态反应试验显示,高剂量组小鼠攻击前后足距厚度差值高于对照组(P<0.05);在NK细胞活性检测的中、高剂量组结果均高于对照组(P<0.05);其它各项试验未见免疫抑制现象;富硒麦芽为原料制备的富硒麦芽冲剂,同样具有增强动物免疫力功能的作用。
:
[1]牟维鹏.不同化学形式硒的毒性作用机制[J].医学卫生学分册,2001,28(4):202-205
[2]肖颜颜,王晓洁,戴小曼,等.富硒大麦苗对小鼠免疫功能的调节[J].食品科学,2009,30(23):401-405
[3]秦秦,阎向东.有机硒富硒麦芽与无机硒亚硝酸钠的毒性比较[J].卫生毒理学杂志,1988,2(3):170-171
[4]中华人民共和国卫生部.保健食品检验与评价技术规范(2003年版).[S].北京:卫生部,2003:22-34
[5]牟维鹏,田园,朴建华,等.亚硒酸钠和硒蛋氨酸毒性的比较[J].卫生研究,2004,33(6):700-703
[6]果秀敏,牛君仿,方正,等.植物中硒的形态及其生理作用[J].河北农业大学学报,2006,26(增刊):142-143
[7]刘家国,赵圣.富硒麦芽对黄曲霉毒素B1致肝肿瘤大鼠抗氧化作用及γ-GT酶活性的影响[J].农村.农业.农民,2005(1):85-89
[8]刘艳娟,谭勋,刘家国,等.富硒麦芽对肝癌间质微血管密度及癌细胞增殖的影响[J].南京农业大学学报,2009,32(3):110-114
[9]诸亚君,陈望秋,曹禄森,等.富硒麦芽粉对黄曲霉毒素诱导外周血白细胞DNA非程序合成的影响[J].营养学报,1996,l2(3):248-251

