结肠癌组织中Bmi-1表达变化及意义
张念华,宋立兵,丁 娅,彭瑞清,曾木圣,张晓实
(1 华南肿瘤学国家重点实验室,广州 510060;2 中山大学肿瘤防治中心;3 广东省第二中医院)
多梳基因(PcG)家族由多种与细胞周期和增殖有关的转录抑制子组成,是一类重要的与发育相关的基因,在胚胎发育、肿瘤发生和转移及干细胞的维持中有重要作用。Bmi-1是PcG基因家族核心成员之一,是一种广泛表达的核蛋白,参与细胞增殖调控。目前已发现Bmi-1基因在多种恶性肿瘤如白血病、结肠癌、乳腺癌、肺癌、前列腺癌等组织中高表达,并与肿瘤侵袭、转移有关。目前,高表达Bmi-1的细胞被认为是肿瘤中存在的“癌症干细胞”,Bmi-1在一些肿瘤中也被认为是干细胞的标志物之一。2011年3月~2012年1月,我们观察了结肠癌组织、瘤旁结肠上皮及淋巴结转移灶中Bmi-1的表达情况,并探讨其与结肠癌临床病理特征的关系。
1 资料与方法
1.1 临床资料 中山大学肿瘤医院行结肠癌根治性手术术中所取的肿瘤组织64例。患者中男38例,女26例,年龄38~76岁。Ducks分期 A期2例、B期31例、C期28例、D期3例。所有患者均经病理检查确诊。术中留取瘤旁(距肿瘤2 cm以上)结肠上皮组织64例,在Ducks C、D期患者中留取转移的淋巴结标本31例,同时收集5例结肠息肉标本作对照。
1.2 检测试剂与方法 每个蜡块取4 μm厚连续切片做免疫组化染色。鼠抗人Bmi-1单克隆抗体购自美国Upstate公司,SP免疫组化试剂盒购自北京中杉公司,抗体稀释液购自北京中杉公司。采用免疫组化法检测结肠癌组织、瘤旁结肠上皮、淋巴结转移灶及结肠息肉组织中的Bmi-1。先将切片置于二甲苯中脱蜡,每次10 min,共2次,乙醇梯度水化处理,3%H2O2消除内源性过氧化物酶,EDTA(pH 8.0)修复液常规修复:微波炉中高火5 min、解冻2 min、中低火20 min加热以充分暴露抗原位点,待自然冷却后加A液(北京中杉SP KIT)室温封闭15 min,鼠抗人Bmi-1抗体(1∶100)4℃孵育过夜,1×PBST(1‰ Tween)漂洗3次,每次5 min;加 B液(北京中杉SP KIT)室温孵育15 min,1×PBST(1‰Tween)漂洗3次,每次5 min;加C液(北京中杉SP KIT)室温孵育15 min,1×PBST(1‰Tween)漂洗3次,每次5 min,DAB显色10 min,终止显色,苏木精复染,盐酸乙醇固定,封片,观察。用PBS代替一抗做阴性对照。
1.3 结果判断 光镜下观察组织标本的着色程度。Bmi-1蛋白阳性表达主要表现为细胞核内出现棕黄色或棕褐色颗粒,少量胞质内出现棕黄色颗粒。随机选择5个高倍视野(400×)计数肿瘤细胞总数和阳性细胞数,按阳性细胞百分比将0%、1%~25%、26%~50%、51%~75%、76%~100%分别计为0、1、2、3、4分;同时根据染色程度,阴性染色计1分,弱染色2分,中等强度染色3分,强染色4分。将上述两种计分方法得分相乘,≤4为-;5~8分为+;9~12分为++;13~16分为+++。以++ 和+++计为Bmi-1蛋白阳性表达。所有切片均由两位病理科医生在未知患者临床资料的情况下独立观察判定结果。
1.4 统计学方法 采用SPSS13.0统计软件。免疫组织化学得分与患者临床病理特征之间的两样本率比较采用四格表资料的χ2检验,多样本率的比较采用行列表资料的χ2检验。以P≤0.05为差异有统计学意义。
2 结果
2.1 Bmi-1表达情况 ①Bmi-1在瘤旁结肠上皮组织、肿瘤组织、淋巴结转移灶中的阳性表达率分别为12.5%(8/64)、62.5%(40/64)和 87.5%(28/32),5例结肠息肉标本中均未见Bmi-1的表达。四者相比,Dukes A、B期与C、D期肿瘤组织中Bmi-1的阳性表达率均高于瘤旁结肠上皮组织,见表1。
2.2 Bmi-1表达与结肠癌临床病理参数的关系Ducks分期C、D期患者肿瘤组织中Bmi-1阳性表达率高于A、B期,病理分级为Ⅲ级者肿瘤组织中Bmi-1阳性表达率高于Ⅰ、Ⅱ级者(P均<0.05)。见表2。
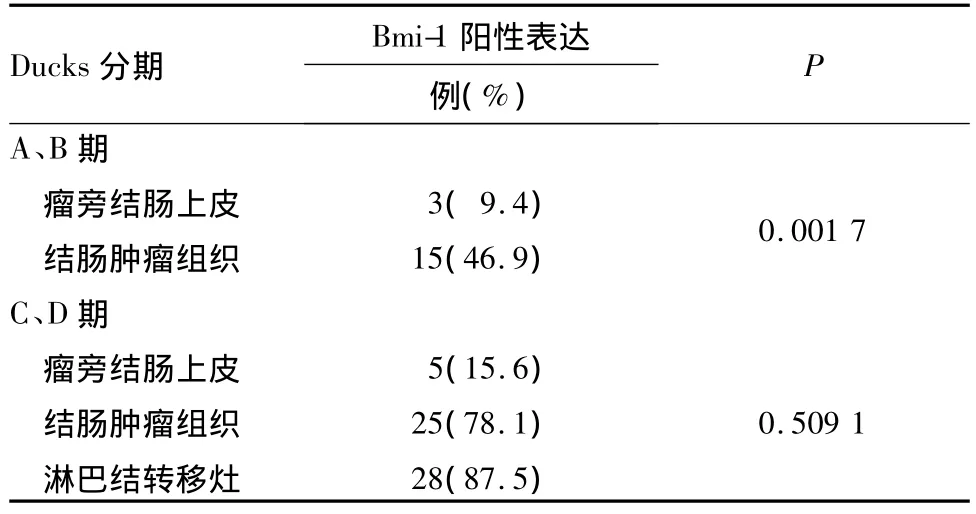
表1 不同Dukes分期患者瘤旁结肠上皮、肿瘤组织及淋巴结转移灶中Bmi-1的表达比较

表2 Bmi-1阳性表达与结肠癌临床病理参数的关系
3 讨论
结肠癌发生、发展及转移的机制尚未完全阐明,主要认为与腺瘤向腺癌转化及多种癌基因与抑癌基因平衡失调有关,是多因素、多步骤、长时间的复杂过程。Bmi-1基因是多梳基因家族的重要成员,直接参与细胞生长、增殖的调节。人Bmi-1基因位于10p13,基因编码一种含326个氨基酸的核酸蛋白。Bmi-1蛋白可结合于基因组中的polycomb反应元件,使特定的靶基因转录沉默而发挥作用。Bmi-1可间接激活端粒酶逆转录酶的转录并诱导端粒酶活性,阻止细胞衰老[1]。Bmi-1作为一种细胞癌基因,被激活后可高表达于肿瘤细胞中,在转录水平来调控细胞的衰老和增殖,引起一系列细胞生物学改变。Bmi-1核蛋白产物在INK4a-ARF位点,INK4a编码p16INK4a,能激活Rb的活性;ARF则编码p14ARF(小鼠中为p19ARF),激活P53的活性。Bmi-1高表达的细胞中p16INK4a、p14/p19ARF表达降低,从而延长细胞增殖期,阻止细胞凋亡[2,3]。同时,Bmi-1基因也可通过诱导肿瘤细胞中端粒酶的活性促进其扩增,参与肿瘤的浸润转移[4]。此外,Bmi-1基因可作为c-myc癌基因的协同基因,在细胞的中心体扩增调节中起重要作用。异常的中心体可导致染色体异常分裂,最终使遗传稳定性发生改变,干扰细胞正常活动而发生癌变。
目前已发现,Bmi-1基因在多种恶性肿瘤如白血病、结肠癌、乳腺癌、肺癌、前列腺癌等中高表达,并且与肿瘤侵袭、转移、预后等有关[5~7]。张晓伟等通过RNA干扰技术干扰胃癌细胞中Bmi-1基因的表达,发现Bmi-1基因表达下调后可导致胃癌细胞衰老、增殖能力下降,表现出明显的抑制肿瘤作用[8]。有学者也发现,胃癌细胞在敲除Bmi-1基因后,出现细胞生长减慢、细胞增殖抑制更为明显及菌落形成减慢,并且改变了细胞周期。细胞增殖能力和以生长停滞为特征的细胞衰老均与细胞周期的关系密切。细胞周期被细胞周期蛋白依赖性激酶复合物和CDK抑制剂的协调作用所调节,干扰Bmi-1导致其对Akt的磷酸化下降,进而导致细胞生长停滞,引起细胞衰老增加和增殖能力的下降。表明Bmi-1的表达可能与胃癌的发病有关[9]。
林妙霞等采用免疫组化法检测大肠癌、大肠腺瘤及正常大肠黏膜组织中的Bmi-1蛋白,结果显示,Bmi-1蛋白表达在正常大肠黏膜、大肠腺瘤及大肠癌组织中呈上升趋势,大肠癌组织中Bmi-1蛋白高表达,提示Bmi-1蛋白与大肠癌发生、发展有关[10]。黄开红等研究发现,Bmi-1的表达与胃癌肿瘤直径、临床分期、淋巴结转移和浸润深度密切相关,与患者的性别、年龄、肿瘤分化程度等无关[11]。秦自科发现,Bmi-1蛋白在正常膀胱黏膜中的表达水平明显低于肿瘤组织,Bmi-1蛋白表达水平随肿瘤分化程度降低而升高[12]。有学者研究认为Bmi-1蛋白可能是预测乳腺癌转移的分子标记物[13]。Song等对鼻咽癌中的Bmi-1表达变化进行研究,结果表明Bmi-1表达阳性者5年生存率明显低于Bmi-1阴性者,Bmi-1是影响鼻咽癌患者生存率的因素之一,其表达上调是预后不良的标志。并且Song等成功建立了Bmi-1单基因诱导的永生化鼻咽上皮细胞株,这为Bmi-1作为一种癌基因提供了证据[4]。本研究对64例不同分期的结肠肿瘤患者的瘤旁结肠上皮、肿瘤组织及淋巴结转移灶中的Bmi-1进行检测,发现无论是在早期(Dukes A期、B期)还是晚期(Dukes C期、D期)的结肠癌患者中,肿瘤组织中Bmi-1的表达均高于瘤旁结肠上皮。淋巴结转移灶中Bmi-1的表达与原发灶肿瘤组织无明显差异,可能是因为Bmi-1在发生淋巴结转移之前就已经过表达,属结肠癌早期事件,且高表达Bmi-1的肿瘤细胞可能具有更高的转移潜能。
本研究结果还显示,Ducks分期C、D期患者肿瘤组织中Bmi-1阳性表达率高于A、B期,病理分级为Ⅲ级者肿瘤组织中Bmi-1阳性表达率高于Ⅰ、Ⅱ级者。临床分期和病理分级均是与结肠癌诊治和预后关系密切的重要指标。上述结果提示Bmi-1在结肠癌的发生、发展、浸润、转移的过程中可能起重要作用,其高表达可能代表恶性程度升高,是结肠癌患者预后不良的因素之一。一项关于卵巢癌的研究也发现,肿瘤分化程度越低,Bmi-1表达越高,且Bmi-1高表达的患者生存时间更短[14]。根据本研究结果,我们推测Bmi-1表达情况也是评估结肠癌预后的有效指标之一,Bmi-1可能成为预测结肠癌高度转移的新分子标志物。
[1]Jiang L,Li J,Song L.Bmi-1,stem cells and cancer[J].Acta Biochim Biophys Sin(Shanghai),2009,41(7):527-534.
[2]Itahana K,Zou Y,Itahana Y,et al.Control of the replicative life span of human fibroblasts by p16 and the polycomb protein Bmi-1[J].Mol Cell Biol,2003,23(1):389-401.
[3]Kim JH,Yoon SY,Kim CN,et al.The Bmi-1 oncoprotein is overexpressed in human colorectal cancer and correlates with the reduced p16INK4a/p14ARF proteins[J].Cancer Lett,2004,203(2):217-224.
[4]Song LB,Zeng MS,Liao WT,et al.Bmi-1 is a novel molecular marker of nasopharyngeal carcinoma progression and immortalizes primary human asopharyngeal epithelial cells[J].Cancer Res,2006,66(12):6225-6232.
[5]Reinisch C,Kandutsch S,Uthman A,et al.BMI-1:a protein expressed in stem cells,specialized cells and tumors of the gastrointestinal tract[J].Histol Histopathol,2006,21(11):1143-1149.
[6]Effendi K,Mori T,Komuta M,et al.Bmi-1 gene is upregulated in early-stage hepatocellular carcinoma and correlates with ATP-binding cassette transporter B1 expression[J].Cancer Sci,2010,101(3):666-672.
[7]Cordisco S,Maurelli R,Bondanza S,et al.Bmi-1 reduction plays a key role in physiological and premature aging of primary human kera-tinocytes[J].J Invest Dermatol,2010,130(4):1048-1062.
[8]张晓伟,秦薇,郭伟剑,等.Bmi-1基因对胃癌细胞增殖的影响及机制[J].世界华人消化杂志,2009,17(14):1390-1393.
[9]Liu JH,Song LB,Zhang X,et al.Bmi-1 expression predicts prognosis for patients with gastric carcinoma[J].J Surg Oncol,2008,97(3):267-272.
[10]林妙霞,文卓夫,冯智英,等.Bmi-1、Ki67在大肠肿瘤组织中的表达及其意义[J].癌症,2008,27(12):1321-1326.
[11]黄开红,刘建化,李学先,等.Bmi-1在胃癌组织中的表达及相关性研究[J].中国肿瘤临床,2007,34(17):961-965.
[12]秦自科,杨建安,曾木圣,等.膀胱癌组织中Bmi-1蛋白的表达及其临床意义[J].癌症,2008,27(12):1327-1330.
[13]冯艳,宋立兵,郭宝红,等.Bmi-1在乳腺癌组织中的表达及意义[J].癌症,2007,26(2):154-157.
[14]Yang GF,He WP,Cai MY,et al.Intensive expression of Bmi-1 is a new independent predictor of poor outcome in patients with ovarian carcinoma[J].BMC Cancer,2010,10(1):133-141.

