胃癌变过程中Bcl-2 mRNA与幽门螺杆菌感染及细胞凋亡的关系
刘爱群,葛莲英,韦宗萍,耿芳芳,罗 元,林思彤
(1 广西医科大学附属肿瘤医院,南宁 530021;2 广西医科大学第一附属临床医学院)
胃癌(GC)是人类第四大恶性肿瘤,约60% ~80%的GC患者癌组织中可以检测到幽门螺杆菌(Hp)。流行病学调查显示,Hp感染人群发生GC的风险是非感染人群的6倍[1,2]。持续的Hp感染可导致慢性浅表性胃炎(CSG)→慢性萎缩性胃炎(CAG)→肠化生(IM)→不典型增生(AH)→GC的病理过程[3,4]。B 细胞淋巴瘤/白血病-2(Bcl-2)基因是细胞凋亡抑制基因,其与胃癌变过程中的Hp感染密切相关[5]。2008年8月~2010年2月,我们采用荧光定量技术分析胃癌变过程中Bcl-2 mRNA表达水平的改变,并结合细胞凋亡及Hp感染情况,探讨Bcl-2 mRNA对Hp感染所致胃癌变过程的影响及机制。
1 资料与方法
1.1 临床资料 收集2008年8月~2010年2月广西医科大学第一附属医院和附属肿瘤医院胃镜活检的胃窦部组织和外科手术切除的胃黏膜组织280例,其中男170例、女110例,年龄21~79(50.8 ±11.2)岁。组织学诊断根据2000年全国慢性胃炎研讨会制定的病理诊断标准[6]。其中CSG 62例(CSG组)、CAG 55例(CAG 组)、IM 52例(IM 组)、AH 46例(AH组)、GC 65例(GC组)。GC患者在手术前均未接受放化疗或免疫治疗。每例标本分为两份,一份经10%的甲醛溶液固定,常规石蜡包埋,制备4 μm厚连续切片,分别行HE、Hp特殊染色和原位末端标记法(TUNEL)染色;另一份用液氮保存,置于-80℃冰箱备RNA提取。
1.2 胃组织相关指标检测
1.2.1 Bcl-2 mRNA表达 采用实时荧光定量(Real-time)PCR。Trizol试剂提取组织中总RNA,计算RNA含量及纯度鉴定,琼脂糖凝胶电泳检测RNA的完整性,逆转录为cDNA,利用特异性引物扩增目的基因。Bcl-2上游引物:5'-CATGTGTGTGGAGAGCGTCAA-3',下游引物:5'-GCCGGTTCAGGTACTCAGTCA-3',扩增片段长度为 83 bp;内参GAPDH上游引物:5'-CCACTCCTCCACCTTTGAC-3',下游引物:5'-ACCCTGTTGCTGTAGCCA-3',扩增长度为102 bp。所有引物均由上海生工生物技术有限公司合成。采用胶回收试剂盒回收PCR产物,回收产物与载体pGEM®-T连接,经电泳和测序鉴定证实为重组pGEM®-T-survivin(GAPDH)质粒,用质粒初始拷贝数与实时荧光定量所检测的CT值建立双标准曲线,用于检测Bcl-2 mRNA的表达。
1.2.2 凋亡细胞 采用TUNEL染色,按常规方法进行脱蜡及水化,高温修复,封闭,进入标记反应,依次滴加TdT酶反应液、Streptavidin工作液,DAB显色,苏木精复染,漂洗,晾干,封片,观察。以细胞核呈棕褐色染色为阳性凋亡细胞,部分细胞质也可因核DNA碎片的逸出呈阳性染色。在OLYMPUS BX-40多功能显微镜下选取凋亡细胞最多的5个高倍视野,计数每个视野100个细胞中的凋亡细胞数,用百分数表示,取平均值计算凋亡指数(AI)。TUNEL染色阳性信号呈棕黄色,位于细胞核内,浓缩的核质紧贴于核膜,或核质呈现均匀的染色。
1.2.3 Hp检测 采用快速尿素酶法、甲苯胺蓝染色和Warthin-Starry银染法检测组织中Hp。尿素酶染色阳性为组织块边缘呈樱红色;甲苯胺蓝染色阳性为组织呈蓝色;Warthin-Starry法染色阳性为组织呈棕黑色。以三种方法中两种或两种以上染色者为Hp阳性,否则为Hp阴性。
1.3 统计学方法 采用SPSS16.0统计软件,计量资料用表示,采用成组t(t')检验、计数资料采用χ2检验,相关性分析采用Spearman等级相关分析。P≤0.05为差异有统计学意义。
2 结果
2.1 Bcl-2 mRNA表达 Bcl-2 mRNA在GC中呈强表达,见图1。CSG组、CAG组、IM组、AH组、GC组Bcl-2 mRNA阳性表达率分别为22.6%(14/62)、30.9%(17/55)、40.4%(21/52)、58.7%(27/46)、69.2%(45/65),Bcl-2 mRNA 表达水平分别为0.095±0.015、0.115 ± 0.012、0.173 ± 0.027、0.224 ±0.042、0.368 ± 0.036。IM 组、AH 组、GC 组 Bcl-2 mRNA表达水平高于 CSG组、CAG组(P均 <0.01),AH 组高于 IM 组(P <0.01),GC 组高于 IM、AH 组(P 均 <0.01)。

图1 GC组Bcl-2 mRNA扩增电泳图(Real-time PCR)
2.2 Bcl-2 mRNA表达及其与细胞凋亡的关系 从CSG→CAG→IM→AH→GC,Bcl-2 mRNA的表达量与 AI呈负相关(rs=-0.700,P <0.05)。
2.3 GC形成过程中Bcl-2 mRNA表达与Hp感染的关系 全部280例标本 Hp感染率为53.6%(150/280),Hp主要存在于胃黏膜表面的黏液、细胞表面、胃小凹、腺腔及癌旁黏膜中,呈弯曲状、海鸥状及杆状,多聚集成群。GC组织中少见 Hp。在IM、AH、GC组Hp阳性者的组织中Bcl-2 mRNA表达均明显高于Hp阴性者(P<0.05或0.01)。见表1。
表1 各组Bcl-2 mRNA表达及与Hp感染关系()
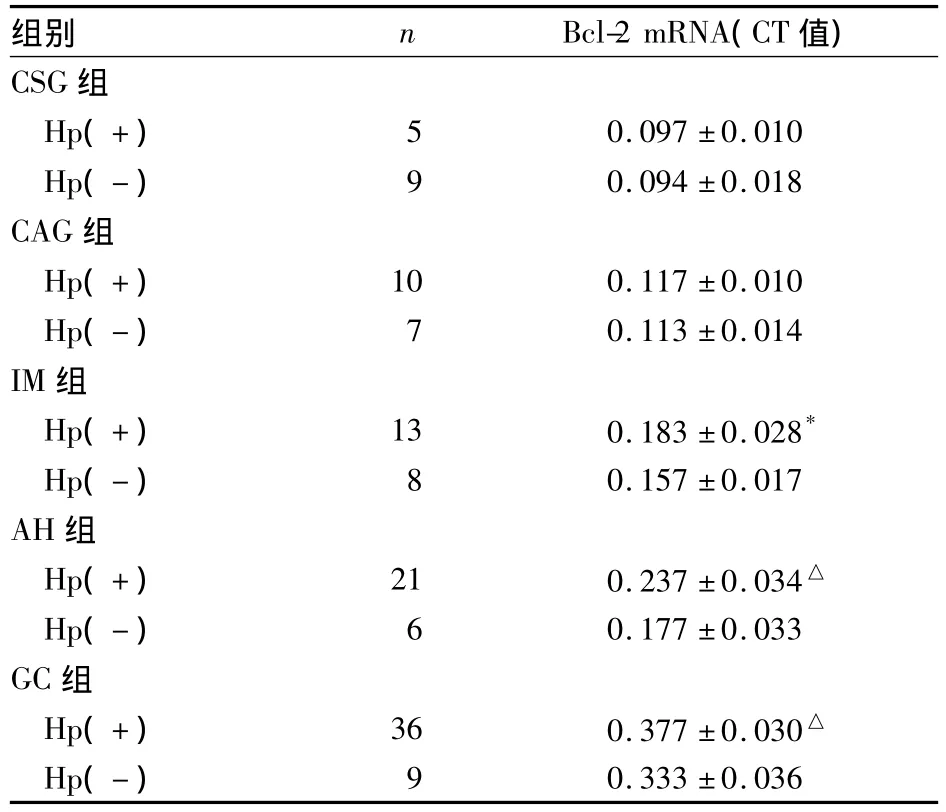
表1 各组Bcl-2 mRNA表达及与Hp感染关系()
注:与同组 Hp(-)比较,*P <0.05,△P <0.01
组别 n Bcl-2 mRNA(CT值)CSG 组Hp(+) 5 0.097 ±0.010 Hp(-) 9 0.094 ±0.018 CAG组Hp(+) 10 0.117 ±0.010 Hp(-) 7 0.113 ±0.014 IM组Hp(+) 13 0.183 ±0.028*Hp(-) 8 0.157 ±0.017 AH组Hp(+) 21 0.237 ±0.034△Hp(-) 6 0.177 ±0.033 GC组Hp(+) 36 0.377 ±0.030△Hp(-)0.333 ±0.0369
3 讨论
近年研究提出了许多Hp致GC的可能机制:一是细菌的代谢产物直接转化黏膜;二是Hp DNA的片段转移入宿主细胞,引起转化;三是Hp引起炎症反应,造成长期慢性炎症刺激,其本身具有基因毒性作用[7,8]。其中第三种机制得到了最广泛的认可。GC是一个涉及多阶段、多基因改变的多步骤过程。对胃黏膜癌变过程中基因表达变化的进一步研究,将有助于了解宿主细胞的抵抗策略和适应性变化的根本机制,从而为干预相关环节、减轻宿主细胞对Hp的易感性提供新的思路[9]。
研究表明,细胞凋亡调节机制的失控与肿瘤发生密切相关[10~12],Bcl-2可能是其中的一个关键性因子。Bcl-2主要功能是发现、登记和评价细胞内的损伤,整合相互矛盾和竞争信号,发出细胞命运的指令,作为抗凋亡基因,它不是通过加速细胞的有丝分裂,而是延长其生存期[13]。刘锁贵等[14]发现 Hp感染可明显促进胃黏膜细胞表达Bcl-2蛋白,进而阻止细胞凋亡的级联反应,使细胞凋亡减少,随着时间的延长,这种促进作用也逐渐加强。因此,Hp感染所引起的长期慢性炎症过程中,Bcl-2的过表达可能使异形细胞凋亡减少、促进胃癌变的发生。
本研究采用较为敏感的实时荧光相对定量来检测胃癌变过程中Bcl-2基因表达水平的改变,发现随着恶变程度的进展,Bcl-2 mRNA表达阳性率和表达量逐渐上升,AI也随之逐渐减少,在胃癌变早期(IM→AH→GC)由Bcl-2介导和调控的抑制异形细胞凋亡作用逐渐增强,提示GC的发生是一个由量变到质变的多阶段渐进过程。而Bcl-2 mRNA的表达在IM、AH、GC组Hp阳性者均高于Hp阴性,提示从癌前病变阶段起,Hp感染后Bcl-2表达上调,异形细胞的凋亡明显减少,促进了胃癌变的演进过程,而Hp在该过程中发挥了启动子的作用。最近我们相关的研究也表明:Hp感染后同样能引起凋亡相关基因表达水平的改变[15]。
综上所述,在Hp感染所致的胃癌变过程中,Bcl-2可能作为一个癌基因,通过抑制恶性转化的异形细胞的凋亡,参与GC的发生和发展进程。同时,在Hp感染胃癌变过程中,Bcl-2与各种凋亡调控基因之间可能存在某种交互作用,但具体通路尚待更为深入的研究。
[1]Parkin DM,Bray F,Ferlay J,et al.Global cancer statistics,2002[J].CA Cancer J Clin,2005,55(2):74-108.
[2]Yang L.Incidence and mortality of gastric cancer in China[J].World J Gastroenterol,2006,12(1):17-20.
[3]Parsonnet J,Friedman GD,Vandersteen DP,et al.Helicobacter pylori infection and the risk of gastric carcinoma[J].N Engl J Med,1991,325(9021):1127-1131.
[4]Suerbaum S,Michetti P.Helicobacter pylori infection[J].N Engl J Med,2002,347(15):1175-1186.
[5]刘爱群,葛莲英,罗元,等.胃癌变过程中幽门螺杆菌感染与凋亡基因Survivin和Bcl-2表达[J].实用医学杂志,2011,27(6):942-944.
[6]林三仁,于中麟,胡品津,等.全国慢性胃炎研讨会共识意见[J].胃肠病学,2000,5(1):77-79.
[7]McColl KE.Helicobacter pylori infection[J].N Engl J Med,2010,362(17):1597-1604.
[8]周丽雅,崔荣丽.幽门螺杆菌与胃癌十年[J].中华内科杂志,2010,49(8):646-647.
[9]刘文中.幽门螺旋杆菌研究进展[M].上海:上海科学技术文献出版社,2001:41-42.
[10]李学军,郭礼和.细胞凋亡失调与疾病关系的研究[J].中华医学杂志,1998,78(8):565-566.
[11]Thompson CB.Apoptosis in the pathogenesis and treatment of disease[J].Science,1995,267(5203):1456-1462.
[12]应荣彪,冯俊,李建军,等.胃癌中survivin和Caspase-3的表达及其临床意义[J].中国癌症杂志,2010,20(1):17-21.
[13]Cory S,Huang DC,Adam JM.The Bcl-2 family:roles in cell survival and oncogenesis[J].Oncogene,2003,22(53):8590-8607.
[14]刘锁贵,王毅超,安员.幽门螺杆菌培养液对SGC7901胃癌细胞表达hTERT和 Bcl-2的影响[J].华西药学杂志,2008,23(5):550-552.
[15]刘爱群,葛莲英,罗元,等.胃癌变过程中Hp感染与凋亡基因Survivin 表达相关性研究[J].山东医药,2011,51(1):10-12.

