黄连多糖提取、分离纯化鉴定及清除羟基自由基能力测定
王 伟,刘世军,安法娥,张良栓
(1 武警山东总队医院,济南 250014;2 哈尔滨医科大学药学院)
黄连多糖是从黄连根茎中提取的一种有机物质,具有与黄连相似的药理作用,能有效抑制α-淀粉酶对可溶性淀粉的降解,其活性优于降糖药物阿卡波糖(拜糖平)[1]。黄连作为常用的降血糖药物,其活性成分为小檗碱类生物碱。研究证明,多糖是黄连的重要组分[2,3]。多糖的降糖作用多归因于其具有良好的抗氧化能力。2012年1~6月,我们从鸡爪黄连的根茎中提取黄连多糖,并观察其结构及清除羟基自由基的能力,进一步探讨其降糖作用机制。
1 材料与方法
1.1 材料及仪器 葡萄糖醛酸标准品、纤维素酶购自美国 Sigma公司,邻二氮菲、DEAE-52纤维素、Sephadex G-100购自 Sinopbarm Chemical Reagent Co.Ltd,其他试剂均为国产分析纯。恒温培养箱、UV-2550紫外可见分光光度计、红外分光光度计、6511-型电动搅拌机、SHZ-D(Ⅲ)循环水式真空泵、RE-2000旋转蒸发仪、AL104电子天平、溴化钾压片机、离心机。
1.2 黄连多糖制备及鉴定
1.2.1 黄连多糖制备[4]称取粉碎至20目的黄连粗粉120 g,置于1000 mL圆底烧瓶中,5倍无水乙醇回流脱脂4 h。滤渣干燥后,加入10倍0.1 mmol/L NaOH溶液,80℃水浴回流提取1 h。提取液调至中性,抽滤,旋转蒸发浓缩至300 mL。向浓缩液中加纤维素蛋白酶0.06 g,40℃水浴2 h。按Sevag法,配制比例为提取液∶氯仿∶正丁醇 =25∶5∶1,电动搅拌 20 min 后,于 4000 r/min 离心 5 min,静置分层,弃去有机层。依此法除4次蛋白。旋转蒸发去除剩余正丁醇和氯仿,加无水乙醇沉淀得粗多糖。分别用DEAE纤维素色谱柱和Sephadex G-100色谱柱将再次溶解的粗多糖进行分离纯化,最终得到纯化黄连多糖,分别命名为CFPⅠ、CFPⅡ。
1.2.2 黄连多糖鉴定
1.2.2.1 洗脱曲线 样品 CFPⅠ、CFPⅡ过 Sephadex G-100凝胶柱,为单一色谱峰,峰形对称,证明CFPⅠ、CFPⅡ均为均一组分。见图1。
1.2.2.2 紫外图谱扫描 配置1 mg/mL CFPⅠ、CFPⅡ溶液,在200~400 nm波长范围内,扫描各多糖紫外吸收。两种多糖在260 nm及280 nm处无吸收峰,成分中无核酸及蛋白质。见图2。

图1 黄连多糖的DEAE-52及Sephadex G-100洗脱曲线
1.2.2.3 红外图谱扫描 采用溴化钾压片法测定多糖结构[5]。两种多糖样品在3000~3500 cm-1处有强吸收,提示有多糖分子间或分子内氢键;分别在2936和2932 cm-1处有强吸收峰,为糖链中次甲基(-CH2-)CH-伸缩振动引起,在这个区域的两组吸收峰是糖类的特征峰。两种多糖样品分别在1624和1616 cm-1处有强吸收峰,可能为-COOH、-CO-或C=O非对称伸缩振动峰。1447和1406 cm-1处强吸收峰为-COOH的C-O引起的吸收峰,提示可能存在糖醛酸,经硫酸咔唑法验证确有糖醛酸存在。1337和1358 cm-1处吸收峰分别为两多糖的-OH变形振动说明该组分为多聚糖。在CFPⅡ样品中,1233 cm-1处特征吸收表明,CFPⅡ中可能含有硫酸基。1142和1102 cm-1处为吡喃环的C-OC环内伸缩振动特征吸收。CFPⅠ样品中,876 cm-1处吸收可能为β-D-葡萄吡喃糖吸收峰,840 cm-1处吸收可能为α-D-半乳吡喃糖、β-D-阿拉伯吡喃糖或α-D-甘露吡喃糖吸收峰;在CFPⅡ样品中,895 cm-1处可能为β-D-甘露吡喃糖吸收峰。见图3。
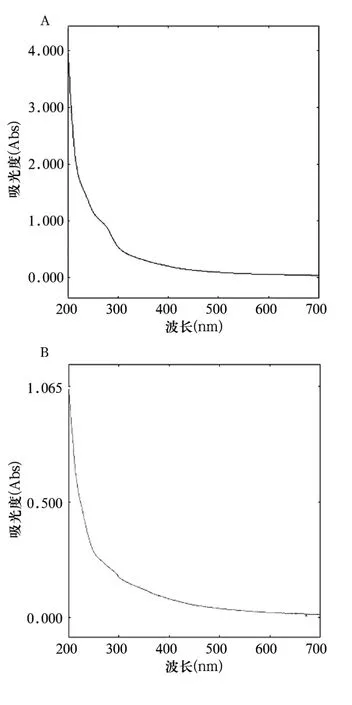
图2 黄连多糖紫外图谱扫描结果
1.2.3 黄连多糖能力测试
1.2.3.1 还原能力 采用普鲁士兰法[6]。分别配置浓度为0.1、0.5、1.0、2.0、5.0 mg/mL 的样品及对照品10 mL。取试样2.5 mL,加入 pH 为6.6的0.2 mol/L磷酸缓冲液和1%铁氰化钾溶液各2.5 mL,混合均匀,混合液50℃保温20 min后加入10%三氯乙酸 2.5 mL,混匀后取该溶液 2.5 mL,再加入去离子水2.5 mL 和 0.1%FeCl30.5 mL,混合均匀10 min后于700 nm处测定吸光度(A),以维生素C(Vc)及葡萄糖醛酸作为阳性对照(临用前以去离子水配制)。吸光度A=Ai-Aj,Ai为试样吸光值,Aj为去离子水代替试样的吸光度值,以多糖浓度为横坐标,以吸光度值为纵坐标绘制曲线。
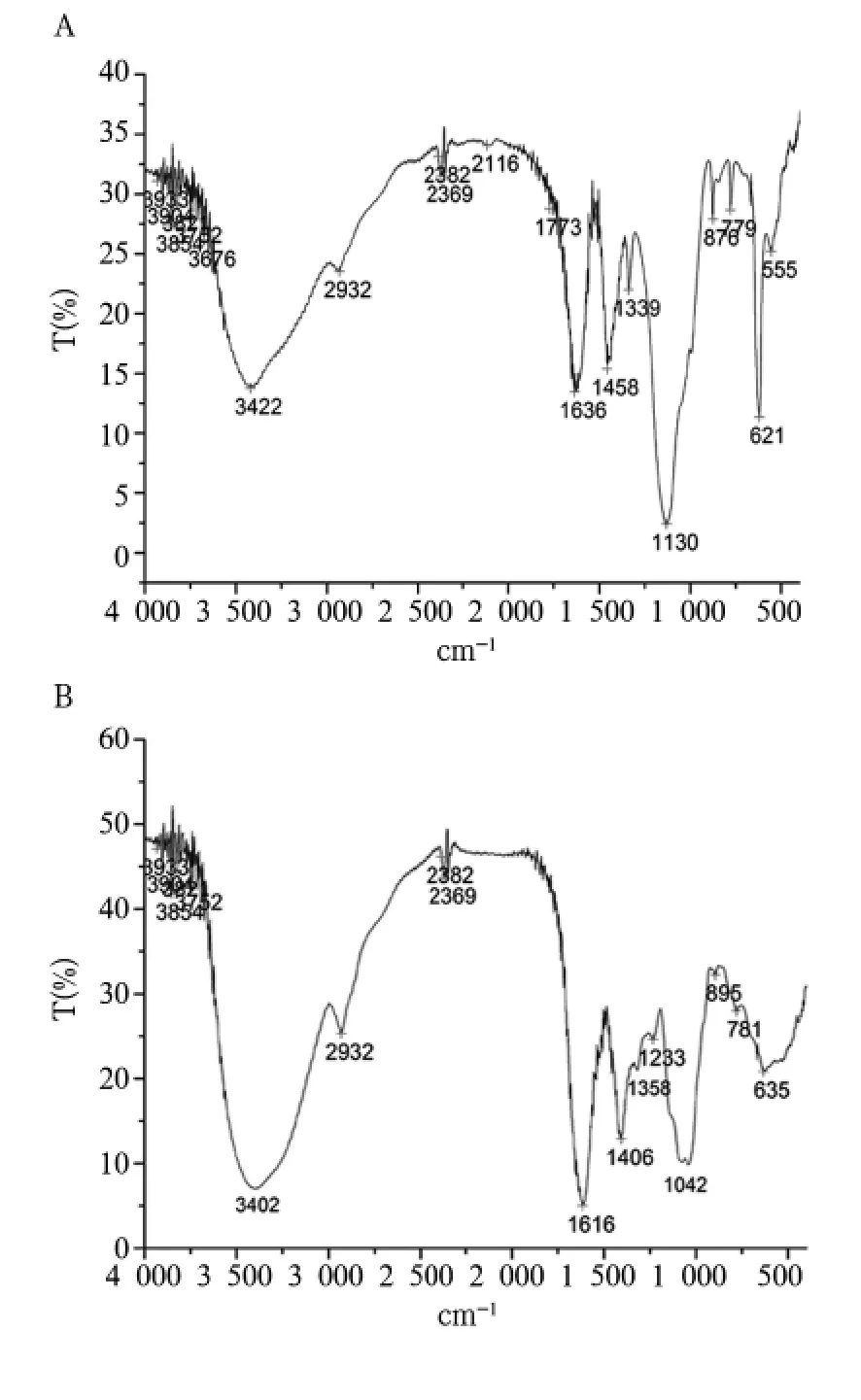
图3 黄连多糖红外光谱扫描结果
1.2.3.2 对羟基自由基的清除能力 将邻二氮菲(0.75 mmol/L,1.0 mL),FeSO4(0.75 mmol/L,0.5 mL),PBS 缓冲液(pH 7.4,50 mmol/L,1 mL)混合,加黄连多糖后加 H2O2(0.1%,0.5 mL)溶液,用去离子水补至10 mL,37℃保温1 h,于510 nm处测定吸光度(A)值,葡萄糖醛酸及Vc为阳性对照,测定表观羟基自由基清除率d。公式为:d=[A(加药)-A(损伤)]/[A(未损伤)-A(损伤)]×100%。其中,A(加药)为体系中加入黄连多糖或阳性对照组的吸光度值;A(损伤)为体系中不加黄连多糖或阳性对照组的吸光度值;A(未损伤)为体系中不加黄连多糖或阳性对照组和H2O2的吸光度值。
1.3 统计学方法 采用Origin7.5软件,所有实验数据均以表示,采用配对t检验,以P≤0.05为差异有统计学意义。
2 结果
2.1 黄连多糖的还原能力 在对照品和黄连多糖中,随着黄连多糖CFPⅡ、CFPⅠ浓度的增大吸光度逐渐增大。在测定浓度范围内,黄连多糖CFPⅡ、CFPⅠ的还原能力均弱于Vc的还原能力,但强于对照品葡萄糖醛酸。黄连多糖样品还原能力CFPⅡ强于 CFPⅠ(P <0.05)。见图4。

图4 黄连多糖还原能力测定结果
2.2 黄连多糖清除羟基自由基的能力 Vc和葡萄糖醛酸的 IC50值分别为4.17 mg/mL和3.88 mg/mL。而黄连多糖两个样品在最大测量浓度下的清除率均小于50%,黄连多糖样品对羟基自由基的清除能力CFPⅡ强于CFPⅠ(P<0.05)。浓度在0.1~2.0 mg/mL范围内时,黄连多糖CFPⅡ对羟基自由基的清除能力与对照品葡萄糖醛酸接近(P>0.05)。浓度为5 mg/mL时,葡萄糖醛酸对羟基自由基的清除能力明显强于Vc对照品(P<0.05)。见图5。

图5 黄连多糖羟基自由基清除能力测定结果
3 讨论
氧化应激状态是产生糖尿病及其并发症的主要原因之一。羟基自由基在氧化应激中起主要作用,是毒性及氧化性最强的氧自由基。多糖类药物可以通过清除羟基自由基而抑制氧化应激,从而治疗糖尿病及其并发症[7]。然而不是所有的碳水化合物都具有抗氧化活性。多糖的抗氧化活性与多糖的结构、分子量及单糖的种类和连接方式有关[8]。黄连自古以来就被用于糖尿病的治疗,以往认为是黄连中的小檗碱类成分在起作用,而忽视了多糖的作用。本研究中,我们从鸡爪黄连根茎的干燥粉末中提取分离出两种均一的黄连杂多糖,经检测两种多糖具有较好的清除羟基自由基能力。本研究发现,黄连多糖中含有糖醛酸、硫酸基等成分,推测黄连多糖的清除羟基能力可能与糖醛酸有关。
本研究发现,两种多糖样品在3000~3500 cm-1处有强吸收,提示有多糖分子间或分子内氢键;分别在2936和2932 cm-1处有强吸收峰,为糖链中次甲基(-CH2-)CH-伸缩振动引起,在这个区域的两组吸收峰是糖类的特征峰。1447和1406 cm-1处强吸收峰为-COOH的C-O引起的吸收峰,提示可能存在糖醛酸,经硫酸咔唑法验证确有糖醛酸存在。1337和1358 cm-1处吸收峰分别为两多糖的-OH变形振动,说明该组分为多聚糖。在CFPⅡ样品中,1233 cm-1处特征吸收表明,CFPⅡ中可能含有硫酸基。1142和1102 cm-1处为吡喃环的CO-C环内伸缩振动特征吸收。CFPⅠ样品中,876 cm-1处吸收可能为 β-D-葡萄吡喃糖吸收峰,840 cm-1处吸收可能为α-D-半乳吡喃糖、β-D-阿拉伯吡喃糖或α-D-甘露吡喃糖吸收峰;在CFPⅡ样品中,895 cm-1处吸收可能为β-D-甘露吡喃糖吸收峰。通过还原力测定实验发现,Vc还原能力最强,黄连多糖样品均具有较强的还原能力,而葡萄糖醛酸的还原能力很弱。但在羟基自由基清除能力测定中,0~2 mg/mL浓度范围内Vc清除自由基的能力最强,葡萄糖醛酸及黄连多糖CFPⅡ同样具有较好的清除能力,浓度为5 mg/mL时葡萄糖醛酸的清除羟基自由基的能力最强,提示葡萄糖醛酸清除羟基自由基的原理与Vc清除羟基自由基的原理可能不同。Vc不仅有抗氧化作用,也具有促氧化作用,此作用与其烯醇式结构有关。Vc烯醇式的羟基具有酸性,在过渡离子(尤其是铁和铜)存在下,会产生羟基自由基,但Vc在清除羟基自由基的同时又会产生半脱氢抗坏血酸负离子自由基,当其不能被及时清除时,则可诱发一系列自由基连锁反应。我们推测葡萄糖醛酸的清除自由基能力可能来自于羧基,羟基自由基具有很强的氧化性,可以使羧基断裂,从而清除羟基自由基。据报道多糖中硫酸基也有一定的清除自由基的能力,因此我们认为在黄连多糖CFPⅡ清除羟基自由基的过程中,硫酸基可能起到了一定的作用。
[1]赵启鹏,崔秋兵,张艺.黄连用于治疗糖尿病的研究进展[J].中药与临床,2010,1(1):55-58.
[2]Shan Z,Xian Z,Wenbing Y,et al.Structure characterization and hypoglycemic activity of a polysaccharide isolated from the fruit of Lycium barbarum L[J].Carbohydrate Polymers,2010,80(4):1161-1167.
[3]Wang LY,Wang Y,Xu DS,et al.MDG-1,a polysaccharide from Ophiopogon japonicus exerts hypoglycemic effects through the PI3K/Akt pathway in a diabetic KKAy mouse model[J].J Ethnopharmacol,2012,143(1):347-354.
[4]姜延伟,王懿萍,吴玉娟,等.黄连多糖抑菌活性初探[J].时珍国医国药,2009,20(1):48-49.
[5]铁梅,李闯,费金岩,等.富硒金针菇子实体中硒多糖的分离纯化技术及红外光谱研究[J].分析测试学报,2008,27(2):158-161.
[6]刘建立.宁夏乌拉尔甘草多糖的提取及其体外抗氧化活性的测定[J].食品与发酵工业,2011,37(7):210-213.
[7]Liang SZ,Xuan W,Lu D.Antioxidation and antiglycation of polysaccharides from Misgurnus anguillicaudatus[J].Food Chem,2011,124(1):183-187.
[8]Li Y,Li MZ.Chemical structural and chain conformational characterization of some bioactive polysaccharides isolated from natural sources[J].Carb Poly,2009,76(4):349-361.
——α-葡萄糖醛酸酶的研究进展*

