尿酸对肾小管上皮细胞sICAM-1表达的影响及其机制探讨
郭吉雷,李 晶,陈 明
(1 新泰市人民医院,山东新泰 271200;2 成都中医药大学附属医院)
近年来,随着人们生活水平的提高和饮食结构的改变,特别是富含蛋白质和嘌呤食物摄入的增加,高尿酸血症(HUA)和痛风的发病人数逐年上升[1]。HUA是肾脏疾病进展的独立危险因素,高浓度的尿酸对肾脏有直接的致病作用[2,3],其危险性甚至高于蛋白尿[4]。但高尿酸损伤肾脏的机制尚待证实。研究发现,在多种肾小球和肾小管疾病中,肾小管上皮细胞都明显表达可溶性细胞间黏附分子-1(sICAM-1)[5,6]。2009 年 10 月 ~2010 年 5 月,我们观察了不同浓度尿酸对体外培养的肾小管上皮细胞sICAM-1及NF-κB表达的影响,探讨尿酸损害肾小管上皮细胞的可能机制。
1 材料与方法
1.1 材料 HK-2细胞株由重庆医科大学肾内科实验室惠赠,RPMI1640培养粉剂、胎牛血清、胰蛋白酶、尿酸购自Solarbio公司,ELISA试剂盒购自美国Abzoom公司,兔抗人NF-κB多抗购自武汉博士德生物工程有限公司,SABC试剂盒与DAB显色试剂盒均购自北京中杉生物技术有限公司。
1.2 实验方法
1.2.1 细胞培养及干预 取液氮冻存的HK-2细胞株,常规解冻后用含10%胎牛血清的RPMI1640培养液,置于37℃、5%CO2孵箱中培养,每3~4 d换液1次,至细胞生长达90%融合后进行传代培养。取对数生长期细胞,用0.25%胰酶消化后制备细胞悬液,并以5×105/孔接种于6孔培养板中,12 h后用无血清RPMI1640培养液同步化处理24 h。将对数生长期HK-2细胞分为对照组及尿酸2 mg/dL组、尿酸7 mg/dL组、尿酸12 mg/dL组、尿酸17 mg/dL组、尿酸22 mg/dL组,每组设3个复孔。对照组仅加入10%胎牛血清普通RPMI1640培养液,其余各组加入相应剂量的尿酸。
1.2.2 细胞NF-κB蛋白表达检测 分别于干预后12、24、48 h采用免疫组化法检测各组HK-2细胞液中NF-κB的表达。用PBS洗涤细胞爬片5 min×3次后,用95%乙醇固定,用0.3%H2O2甲醇溶液室温孵育 10 min,加 0.3%TritonX-100室温 10 min,5%BSA封闭非特异抗原,用滤纸将多余血清吸去,分别滴加一抗(羊抗人NF-κB多抗)50 μL于待测区域细胞上,4℃孵育过夜;滴加二抗(生物素标记)工作液30 μL;滴加SABC复合物,DAB显色,苏木素轻度复染,梯度酒精脱水。倒置显微镜下观察细胞爬片NF-κB染色情况,并摄取图像,采用Image-Pro Plus(IPP)6.0专业图像分析软件半定量分析NF-κB蛋白表达量。
1.2.3 细胞 sICAM-1蛋白表达检测 采用ELISA法。收集上清液,将细胞上清液置入EP管,低温离心,取上清液置入EP管,放入-20℃冷冻室。取出酶标板,依照次序对应分别加入标准品50 μL于空白微孔中,分别标记样品编号,加入样品50 μL于空白微孔中。在样品孔中加入生物素标记液10 μL,标准品孔和样品孔中加入酶标记溶液100 μL。(36±2)℃孵育反应60 min。洗板机清洗5次,每孔加入底物A、B液各50 μL。(36±2)℃下避光孵育反应15 min。每孔加入终止液50 μL,终止反应。于波长450 nm的酶标仪上读取各孔浓度值。
1.3 统计学方法 采用SPSS15.0统计软件,数据用表示,采用单因素方差分析,组间两两比较采用SNK法;相关分析采用Spearman等级相关分析法。以P≤0.05为差异有统计学意义。
2 结果
2.1 各组sICAM-1表达 见表1。
表1 各组尿酸干预不同时点sICAM-1蛋白表达变化(IOD 值,)
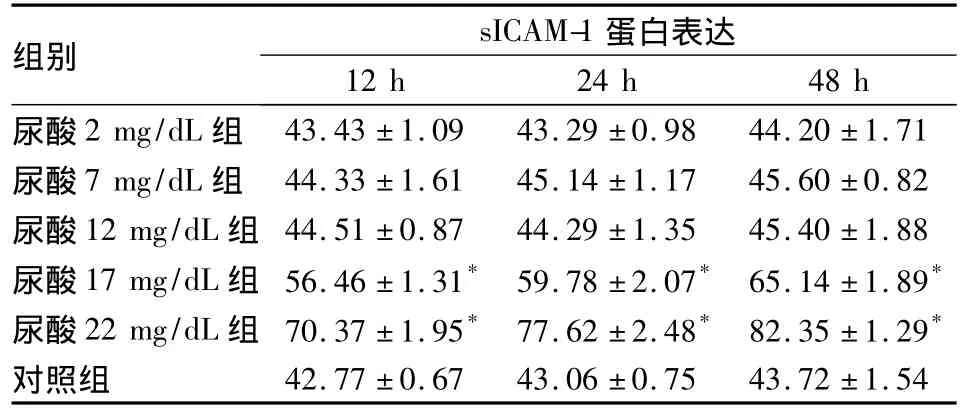
表1 各组尿酸干预不同时点sICAM-1蛋白表达变化(IOD 值,)
注:与同时间点对照组比较,*P<0.05
组别 sICAM-1蛋白表达12 h 24 h 48 h尿酸2 mg/dL组43.43 ±1.09 43.29 ±0.98 44.20 ±1.71尿酸7 mg/dL 组 44.33 ±1.61 45.14 ±1.17 45.60 ±0.82尿酸12 mg/dL 组 44.51 ±0.87 44.29 ±1.35 45.40 ±1.88尿酸17 mg/dL 组 56.46 ±1.31* 59.78 ±2.07* 65.14 ±1.89*尿酸22 mg/dL 组 70.37 ±1.95* 77.62 ±2.48* 82.35 ±1.29*对照组42.77 ±0.67 43.06 ±0.75 43.72 ±1.54
2.2 各组NF-κB表达 免疫组化结果显示,NF-κB蛋白阳性染色信号为棕黄色颗粒,定位于细胞质或细胞核。对照组NF-κB蛋白主要表达于细胞质内,细胞核表达较少,见图1~3。与对照组比较,尿酸17 mg/dL组、尿酸22 mg/dL组NF-κB表达明显增多(P<0.05),且随时间表达明显增多,呈时间依赖性。见表2。相关性分析表明,NF-κB与 sICAM-1表达呈正相关(r=0.998,P <0.05)。
表2 各组尿酸干预不同时点NF-κB蛋白表达(IOD 值,)
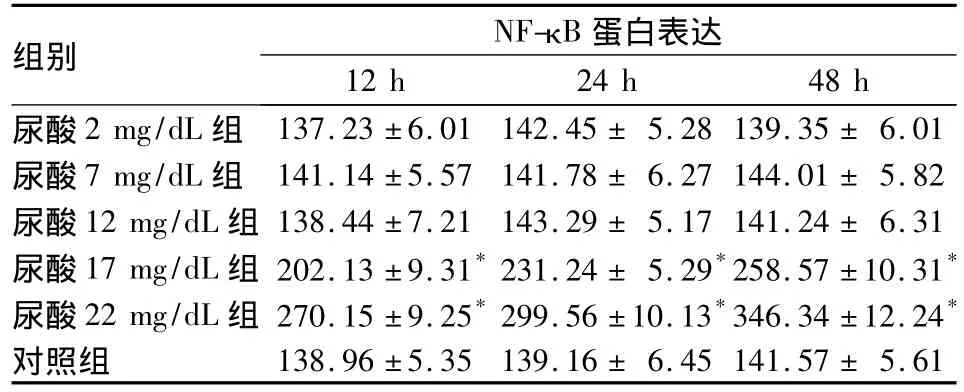
表2 各组尿酸干预不同时点NF-κB蛋白表达(IOD 值,)
注:与同时间点对照组比较,*P<0.05
组别 NF-κB蛋白表达12 h 24 h 48 h尿酸2 mg/dL组137.23 ±6.01 142.45 ± 5.28139.35 ± 6.01尿酸7 mg/dL 组 141.14 ±5.57 141.78 ± 6.27144.01 ± 5.82尿酸12 mg/dL 组 138.44 ±7.21 143.29 ± 5.17141.24 ± 6.31尿酸17 mg/dL 组 202.13 ±9.31*231.24 ± 5.29*258.57 ±10.31*尿酸22 mg/dL 组 270.15 ±9.25*299.56 ±10.13*346.34 ±12.24*对照组138.96 ±5.35 139.16 ± 6.45141.57 ± 5.61
3 讨论
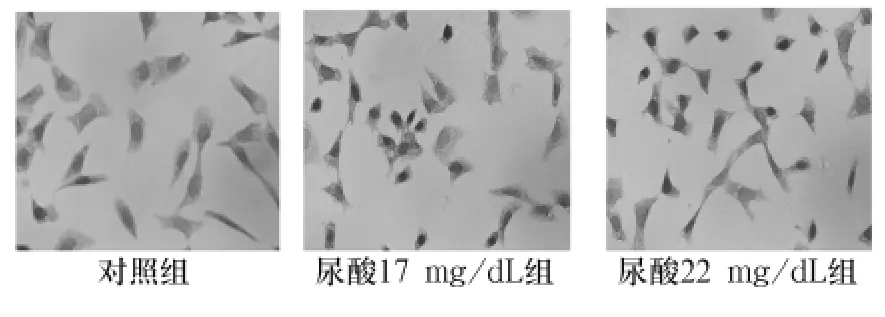
图1 尿酸干预12 h后HK-2细胞NF-κB蛋白表达(×400)

图2 尿酸干预24 h后HK-2细胞NF-κB蛋白表达(×400)
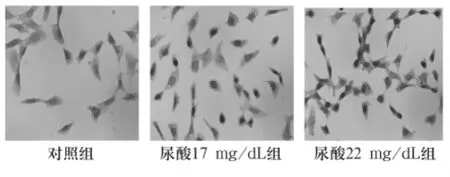
图3 尿酸干预48 h后HK-2细胞NF-κB蛋白表达(×400)
尿酸是嘌呤代谢的终产物。人体产生的尿酸约30%被肠道细菌分解清除,其余70%通过肾脏排泄。近年研究证实,血尿酸水平与肾脏疾病有密切关系[4,6~8]。HUA可引起蛋白尿、肾小球组织增生肥大、肾小球硬化和肾间质纤维化,最终引起慢性肾功能衰竭,其机制可能包括:激活肾素—血管紧张素—醛固酮(RAS)系统,使血管紧张素Ⅱ合成增加[9~11];增加氧化应激[11,12];激活血管平滑肌丝裂原活化蛋白激酶(MAPKs)通路以及一系列炎性反应相关因子如胞外信号调节激酶、NF-κB、环氧合酶-2、血栓素花生四烯酸、血小板衍生长因子和单核细胞趋化蛋白-1(MCP-1)等[13]。
ICAM-1属于免疫球蛋白超基因家族成员,在内皮细胞、上皮细胞、单核细胞和淋巴细胞上均有表达,是介导细胞黏附所必需的分子,主要参与细胞黏附、炎症、T细胞的分化发育调节、抗原呈递与T细胞活化、细胞介导的细胞毒作用,在机体的炎症、免疫反应中起重要作用。研究证实,在多种肾小球和肾小管疾病中,尤其是急进性肾炎、新月体肾炎、狼疮性肾炎、急性肾小管坏死和移植肾排斥反应等炎症性疾病中,肾小管上皮细胞都明显表达ICAM-1[14,15]。sICAM-1 是 ICAM-1 脱落后于血液中的可溶形式,sICAM-1的量与细胞表面ICAM-1的分子数量呈正比。sICAM-1水平可间接反映内皮细胞和抗原递呈细胞表面ICAM-1的表达量。本研究发现,与对照组相比,尿酸干预后尿酸2 mg/dL组、尿酸7 mg/dL组及尿酸12 mg/dL组sICAM-1表达无显著变化,而尿酸17 mg/dL组、尿酸22 mg/dL组不仅表达明显增多,且随时间表达明显增多,呈时间依赖性,提示高浓度尿酸可使细胞液中sICAM-1的量明显增多,反映细胞表面ICAM-1的表达量增多。增多的ICAM-1可能引起一些炎症介质表达,进而引起肾脏病变,提示尿酸可以引起肾小管上皮细胞ICAM-1的表达增多。
NF-κB是一种广泛存在于细胞中、具有多向性转录调节作用的蛋白质,在机体的免疫反应、炎症反应的调控等方面发挥重要作用。活化的NF-κB能调节多种分子的表达,如 TNF-α、IL-6、IL-8、诱导型氮氧化物合酶(iNOS)等。NF-κB在肾脏的肾小球细胞和肾小管上皮细胞中广泛存在。本研究发现,与对照组相比,尿酸干预后尿酸17 mg/dL组、尿酸22 mg/dL组NF-κB表达明显增多,且随时间表达增多,呈时间依赖性,提示高尿酸可刺激HK-2细胞NF-κB活化表达增多,进而引起炎症介质的表达。
研究发现,NF-κB是ICAM-1的激活途径之一。NF-κB是一个普遍存在的转录因子,可调节ICAM-1、TNF-α、IL-l、IL-6 等与炎症相关的因子表达[16]。Zou 等[17]证实 NF-κB的活化可以诱导ICAM-1的表达上调,造成血管内皮和肠上皮细胞的损伤。Glushakova等[18]发现果糖可以引起人血管内皮细胞产生尿酸增多,通过激活NF-κB途径引起ICAM-1的表达增多。本研究发现,与对照组相比,尿酸干预后NF-κB和sICAM-1表达均明显增多,且两者呈正相关,提示尿酸可能通过激活NF-κB途径引起肾小管上皮细胞sICAM-1的表达。
[1]Choi HK.A preseription for lifestyle change in patients with hyperuricemia and gout[J].Curr Opin Rheumatol,2010,22(2):165-172.
[2]Johnson RJ,Kang DH,Feig D,et al.Is there a pathogenetic role for uric acid in hypertension and cardiovascular and renal disease[J].Hypertension,2003,41(6):1183-1190.
[3]Kanbay M,Solak Y,Dogan E,et al.Uric acid in hypertension and renal disease:the chicken or the egg[J].Blood Purif,2010,30(4):288-295.
[4]Weiner DE,Tighionart H,Elsayed EF,et al.Uric acid and incident kidney disease in the community[J].J Am Soc Nephrol,2008,19(6):1204-1211.
[5]Elizabeth T,Rosolowsky,Linda H,et al.High-normal serum uric acid is associated with impaired glomerular filtration rate in nonproteinuric patients with type 1 diabetes[J].Clin J Am Soc Nephrol,2008,3(3):706-713.
[6]Tomita M,Mizuno S,Yamanaka H,et al.Does hyperuricemia affect mortality?A prospective cohort study of Japanese male workers[J].J Epiderniol,2000,10(6):403-409.
[7]Iseki K,Ikemiya Y,Inoue T,et al.Significance of hyperuricemia as a risk factor for developing ESRD in a screened cohort[J].Am J Kidney Dis,2004,44(4):642-650.
[8]Obermayr RP,Temml C,Gutjahr G,et al.Elevated uric acid increase the risk for kidney disease[J].J Am Soc Nephrol,2008,19(12):2407-2413.
[9]Zhou X,Matavelli L,Frohlich ED.Uric acid:its relationship to renal hemodynamics and the renal-angiotension system[J].Curr Hypertens Rep,2006,8(2):120-124.
[10]Corry DB,Eslami P,Yamamoto K,et al.Uric acid stimulates vascular smooth muscle cell proliferation and oxidative stress via the vascular renal-angiotension system[J].J Hypertens,2008,26(2):269-275.
[11]Sánch-Lozada LG,Soto V,Tapia E,et al.Role of oxidative stress in the renal abnormalities induced by experimental hyperuricemia[J].Am J Physiol Renal Physiol,2008,295(4):1134-1141.
[12]Sánch-Lozada LG,López-Molina R.Effects of acute and chronic L-anginine treatment in experimental hyperuricemia[J].Am J Physiol Renal Physiol,2007,292(4):1238-1244.
[13]Kanellis J,Watanabe S,Li JH,et al.Uric acid stimulates monocyte chemoattractant protein-1 production in vascular smooth muscle cells via mitogen-activated protein kinase and cyclooxygenase[J].Hypertension,2003,41(6):1287-1293.
[14]Lydyard PM.Instant notes in immunology[M].London:Taylor&Francis Group,2000:85-92.
[15]Kuroiwa T.Cellular interactions in the pathogenesis of lupus nephritis:the role of T cells and macropbages in the ampli-fication of the inflammatory process in the kidney[J].Lupus,1998,7(9):597-603.
[16]Rosell R,Felip E,Paz-Ares L.How could pharmacogenomics help improve patient survival[J].Lung Cancer,2007,57(S2):35-41.
[17]Zou L,Attuwaybi B,Kone BC.Effects of NF-kappaB inhibition on mesenteric ischemia-reperfusion injury[J].Am Physiol,2003,284(4):713-721.
[18]Glushakova O,Kosugi T,Roncal C,et al.Fructose induces the inflammatory molecule ICAM-1 in endothelial cells[J].J Am Soc Nephrol,2008,19(9):1712-1720.

