PKC对雷帕霉素抑制内皮生长晕细胞作用的影响及机制
邵小琳
(山东医学高等专科学校,山东临沂 276000)
雷帕霉素药物洗脱支架是临床治疗冠状动脉狭窄应用最为广泛的支架之一,缓慢洗脱的药物可以抑制平滑肌细胞增殖和迁移,降低支架植入术后的再狭窄率。内皮生长晕细胞(EOCs)是血管内皮细胞的前体细胞,具有高度增殖潜能及强大的成血管能力,对预防PCI术后再狭窄具有重要意义[1]。研究表明,雷帕霉素在抑制血管平滑肌细胞增生的同时也降低了EOCs的活性[2],从而抑制了支架术后损伤内皮的修复,导致术后血栓形成和内膜增生,成为雷帕霉素药物洗脱支架的弊端之一。内皮型一氧化氮合酶(eNOS)催化产生的NO能够促进EOCs发挥功能[3,4],而蛋白激酶 C(PKC)与 eNOS 及 NO 均有密切关系[5,6]。2011 年10月 ~2012年6月,我们应用PKC抑制剂Go6976抑制PKC的活性,观察PKC对雷帕霉素干预后的EOCs的作用,以进一步明确雷帕霉素抑制EOCs的机制,为改善雷帕霉素药物洗脱支架植入术后的效果提供实验依据。
1 材料与方法
1.1 材料 EGM-2培养基购自Lonza公司,胎牛血清购自Gibco公司,人纤维连接蛋白购自Chemicon公司,异硫氰基荧光素标记荆豆凝集素Ⅰ(FITCUEA-Ⅰ)购自 Sigma公司,Dil标记的乙酰化 LDL(DiI-ac-LDL)购自 Invitrogen公司,Ⅷ因子抗体、CD34抗体、Flk-1抗体购自Boster公司,CCK-8试剂购自日本同仁化学研究所中国(上海)代表处,Transwell小室购自美国Corning公司。
1.2 实验方法
1.2.1 细胞培养 参照Ingram等[7]报道的方法进行。收集2011年10月~2012年5月弃用的健康产妇的新鲜胎盘脐带血30例,每次采血量约30 mL。采用密度梯度离心法收集脐血中的单个核细胞,重悬于2 mL含10%胎牛血清的EGM-2培养液中,接种于在人纤维连接蛋白预包被的六孔板的一个孔内。置培养箱中培养24 h,吸弃孔内培养液,用PBS轻柔洗去未贴壁细胞并更换新鲜培养液。此后7 d内每天更换一半培养液,7 d后每3 d更换全部培养液。待原代细胞生长汇合约80%后传代,进行下一步实验。
1.2.2 细胞鉴定 ①免疫细胞染色法:取第2代细胞接种至24孔板中,培养至贴壁。采用40 g/L多聚甲醛固定20 min,0.3%H2O2-甲醇液封闭内源性过氧化物酶10 min,PBS浸洗后分别加1∶100稀释的CD34、Flk-1、Ⅷ因子一抗,4℃孵育过夜。二抗结合参照ABC免疫组化检测试剂盒说明书进行,之后用AEC染色试剂染色,苏木素复染,于倒置相差显微镜下(×200)观察染色结果。以CD34、Flk-1、Ⅷ因子染色均为阳性为正在分化的EOCs细胞。②荧光染色法:在上述细胞中加入DiI-ac-LDL(10 mg/L)37℃孵育4 h,用4%多聚甲醛固定10 min,PBS浸洗后将FITC-UEA-Ⅰ(10 mg/L)加于上述标本中,37℃孵育1 h。采用荧光显微镜观察染色结果。DiI-ac-LDL和FITC-UEA-Ⅰ双染色阳性细胞为正在分化的EOCs细胞。采用密度梯度离心法分离获得的单个核细胞在培养第4~6 d开始出现梭形细胞,第7~9 d形成若干个细胞集落,继续培养细胞呈椭圆形铺路石样排列,见图1。免疫细胞染色显示:培养16~21 d的 EOCs表面 CD34、Flk-1、Ⅷ因子相关抗原表达均为阳性,见图2。DiI-ac-LDL和 FITCUEA-Ⅰ荧光染色后,荧光显微镜观察到双染色阳性细胞,见封三彩图3。

图1 分离培养的EOCs(×100)

图2 EOCs免疫细胞染色(×200)

1.2.3 细胞干预 取第2代细胞分成4组:①对照组:仅加入配制雷帕霉素的0.3%DMSO溶剂;②Go6976 组:加入 1 μmol/L Go6976;③Go6976+雷帕霉素组:加入 1 μmol/L Go6976,30 min后再加入10 μmol/L雷帕霉素;④雷帕霉素组:加入10 μmol/L雷帕霉素。各组细胞继续培养24 h后观察结果。
1.2.4 细胞增殖能力检测 第2代细胞生长至融合,0.05%胰蛋白酶消化收集贴壁细胞,重悬后计数,以1×104个/孔接种到96孔培养板,24 h后更换无血清的培养基同步24 h,然后随机分组处理,每组3个复孔,24 h后更换新鲜培养液,每孔加入10 mL CCK-8细胞计数试剂,于37℃孵育2.5 h,酶标仪450 nm下读取吸光度OD值。
1.2.5 细胞迁移能力检测 第2代细胞生长至融合,0.05%胰蛋白酶消化收集贴壁细胞,重悬后计数。以相同细胞数接种到24孔培养板,24 h后更换无血清的培养基同步24 h,然后随机分组处理,每组3个复孔,24 h后消化收集各组贴壁细胞,加入含0.1%BSA的无血清培养基制备成细胞悬液,调整细胞密度,于24孔板中放入Transwell小室(孔径8 μm)。下室加入600 μL含10%FBS的培养基,上室加入100 μL细胞悬液,在培养箱中孵育24 h。取出Transwell小室,PBS冲洗,用棉签擦去微孔膜上层的细胞,4%多聚甲醛固定10 min,0.25%结晶紫染色。随机计数5个视野(×400)内的 EOCs数,评价EPCs的迁移能力。
1.2.6 黏附能力检测 第2代细胞生长至融合,0.05%胰蛋白酶消化收集贴壁细胞,重悬后计数,以相同细胞数接种到24孔培养板,24 h后更换无血清的培养基同步24 h,然后随机分组处理,每组3个复孔,24 h后收集各组贴壁细胞,制备成细胞悬液,调整细胞密度,将相同细胞数的EOCs接种到96孔板,每组设6个复孔,置培养箱中培养30 min后,用Hanks液轻柔洗去各孔未贴壁细胞,倒置相差显微镜下随机取10个视野(×400)计数贴壁EOCs数。
1.3 统计学方法 采用SPSS16.0软件包,计量资料以表示,组间资料比较采用ANOVA单因素方差分析,组间两两比较方差齐者采用LSD检验,方差不齐者采用Dunnett'sT3检验。P≤0.05为差异有统计学意义。
2 结果
2.1 细胞增殖能力 雷帕霉素组EOCs增殖能力低于对照组(P<0.01)。Go6976+雷帕霉素组高于雷帕霉素组(P<0.01)。Go6976组高于雷帕霉素干预组(P <0.01)。见表1。
2.2 细胞迁移能力 雷帕霉素组EOCs迁移能力低于对照组(P<0.01)。Go6976+雷帕霉素组高于雷帕霉素组(P<0.01)。Go6976组EOCs高于雷帕霉素组(P<0.01),但与对照组比较差异无统计学意义(P >0.05)。见表1、图4。
2.3 细胞黏附能力 雷帕霉素组EOCs黏附能力低于对照组(P<0.01);Go6976+雷帕霉素组高于雷帕霉素组(P<0.01)。Go6976组高于雷帕霉素干预组(P<0.01),但与对照组比较差异无统计学意义(P >0.05)。见表1。
表1 各组EOCs增殖、迁移、黏附能力检测结果()
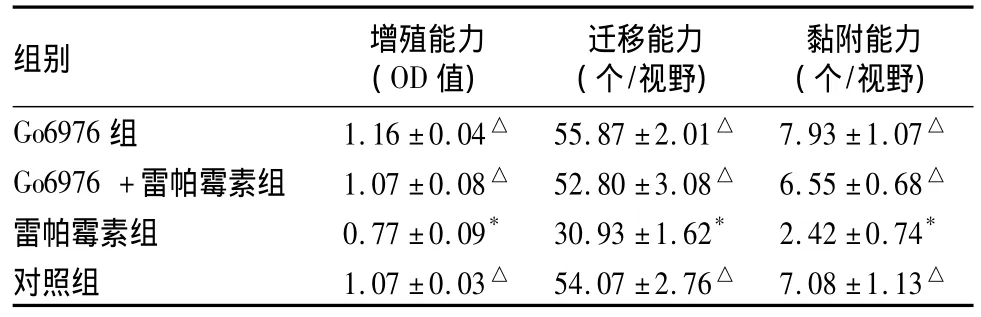
表1 各组EOCs增殖、迁移、黏附能力检测结果()
注:与对照组比较,*P <0.01;与雷帕霉素组比较,△P <0.01
组别 增殖能力(OD值)迁移能力(个/视野)黏附能力(个/视野)Go6976 组 1.16 ±0.04△ 55.87 ±2.01△ 7.93 ±1.07△Go6976+雷帕霉素组 1.07±0.08△ 52.80±3.08△ 6.55±0.68△雷帕霉素组 0.77 ±0.09* 30.93 ±1.62* 2.42 ±0.74*对照组 1.07 ±0.03△ 54.07 ±2.76△ 7.08 ±1.13△

图4 EOCs迁移能力(×400)
3 讨论
内皮祖细胞(EPCs)是骨髓干细胞的亚群,是血管内皮细胞的前体细胞,不仅在血管新生中作用显著,而且具有强烈的内皮保护作用。EPCs主要分为两种不同类型,即早期内皮祖细胞和晚期内皮祖细胞(也称内皮生长晕细胞,即EOCs)[8]。研究表明,EPCs参与冠心病介入治疗后损伤内皮的修复,能够促进再内皮化过程[9~12],维持血管内皮完整性,抑制血栓形成和内膜增生,对降低PCI术后血管再狭窄发生率具有重要作用。与早期EPCs相比,EOCs具有更高的增殖潜能和成血管能力[1]。EOCs参与损伤血管内皮的修复,并可以促进支架术后内皮化,在损伤血管再内皮化的过程中的地位更为重要[13]。
雷帕霉素药物洗脱支架是临床应用最为广泛的药物洗脱支架之一。缓慢洗脱的雷帕霉素可以抑制血管中膜平滑肌细胞的增生,使其细胞周期停滞在G1/S期,从而减少了内膜的增厚。同时大量研究表明,雷帕霉素在抑制血管平滑肌细胞增生的同时也抑制了 EPCs活性[14~16],使损伤血管的再内皮化过程受到抑制,血管完整性遭到破坏,局部的炎症反应使得血栓形成增加,并且促进血管中层平滑肌细胞的反应性增生,使得内膜增厚,血管再狭窄率增加[13]。由此可见,雷帕霉素药物洗脱支架在冠心病介入治疗中的作用是一把双刃剑。研究雷帕霉素对EPCs功能的作用机制,找出阻断或减弱其抑制EPCs的方法或途径,将对雷帕霉素药物洗脱支架的应用带来更广阔的前景。
PKC是由一系列丝氨酸/苏氨酸蛋白激酶组成的家族,PKC的活化可以抑制eNOS活性从而降低NO 的产生[3,4],而 eNOS、NO 在 EPCs的动员、归巢、分化、增殖、迁移、黏附等方面发挥着重要作用[5,6],是EPCs重要的生物活性分子。本研究发现,应用PKC抑制剂Go6976干预EOCs后,可显著改善雷帕霉素对EOCs功能的抑制,EOCs功能基本恢复到与对照组同一水平,考虑PKC可能被激活参与了雷帕霉素对EOCs功能的抑制过程,提示抑制PKC活性可改善雷帕霉素对EOCs功能的抑制作用。
本研究结果为雷帕霉素抑制EPCs的机制提出了新的认识,为如何提高雷帕霉素支架术后EOCs的活性提供了新的方法和思路。关于PKC参与雷帕霉素导致EOCs功能抑制的作用机制尚待进一步研究。
[1]Jin Hur,Chang-Hwan Yoon,Hyo-Soo Kim,et al.Characterization of two types of endothelial progenitor cells and their different contri-butions to neovasculogenesis[J].Arterioscler Thromb Vasc Biol,2004,24(2):288-293.
[2]Miriuka SG,Rao V,Peterson M,et al.mTOR inhibition induces endothelial progenitor cell death[J].Am J Transplant,2006,6(9):2069-2079.
[3]Hu XS,Du CQ,Yang L,et al.Proteasome inhibitor MG132 suppresses number and function of endothelial progenitor cells:involvement of nitric oxide synthase inhibition[J].Int J Mol Med,2010,25(3):385-392.
[4]Wan J,Lu LJ,Miao R,et al.Alterations of bone marrow-derived endothelial progenitor cells following acute pulmonary embolism in mice[J].Exp Biol Med,2010,235(8):989-998.
[5]Wang L,Wu B,Sun Y,et al.Translocation of protein kinase C isoforms is involved in propofol-induced endothelial nitric oxide synthase activation[J].Br J Anaesth,2010,104(5):606-612.
[6]Payne GA,Bohlen HG,Dincer UD,et al.Periadventitial adipose tissue impairs coronary endothelial function via PKC-beta-dependent phosphorylation of nitric oxide synthase[J].Am J Physiol Heart Circ Physiol,2009,297(1):460-465.
[7]Ingram DA,Mead LE,Tanaka H,et al.Identification of a novel hierarchy of endothelial progenitor cells using human peripheral and umbilical cord blood[J].Blood,2004,104(9):2752-2760.
[8]Lin Y,Weisdorf DJ,Solovey A,et al.Origins of circulating endothelial cells and endothelial outgrowth from blood[J].Clin Invest,2000,105(1):71-77.
[9]Wang SH,Lin SJ,Chen YH,et al.Late outgrowth endothelial cells derived from wharton jelly in human umbilical cord reduce neointimal formation after vascular injury:involvement of pigment epithelium-derived factor[J].Arterioscler Thromb Vasc Biol,2009,29(6):816-822.
[10]Kong D,Melo LG,Gnecchi M,et al.Cytokine-induced mobilization of circulating endothelial progenitor cells enhances repair of injured arteries[J].Circulation,2004,110(14):2039-2046.
[11]Hristov M,Weber C.Endothelial progenitor cells in vascular repair and remodeling[J].Pharmacol Res,2008,58(2):148-151.
[12]Urao N,Okigaki M,Yamada H,et al.Erythropoietin-mobilized endothelial progenitors enhance reendothelialization via Akt-endothelial nitric oxide synthase activation and prevent neointimal hyperplasia[J].Circ Res,2006,98(11):1405-1413.
[13]Patel SD,Waltham M,Wadoodi A,et al.The role of endothelial cells and their progenitors in intimal hyperplasia[J].Ther Adv Cardiovasc Dis,2010,4(2):129-141.
[14]Butzal M,Loges S,Schweizer M,et al.Rapamycin inhibits proliferation and differentiation of human endothelial progenitor cells in vitro[J].Exp Cell Res,2004,300(1):65-71.
[15]Chen TG,Chen JZ,Wang XX.Effects of rapamycin on number activity and eNOS of endothelial progenitor cells from peripheral blood[J].Cell Prolif,2006,39(2):117-125.
[16]Fukuda D,Sata M,Tanaka K,et al.Potent inhibitory effect of sirolimus on circulating vascular progenitor cells[J].Circulation,2005,111(7):926-931.
——雷帕霉素

