植物乳杆菌肌球交叉反应抗原MCRA的克隆表达及功能鉴定
杨 波,陈海琴,张白曦,宋元达,陈永泉,陈 卫,张 灏
(江南大学食品学院,食品科学与技术国家重点实验室,江苏无锡214122)
共轭亚油酸(CLA,18∶2)是一类具有共轭双键的亚油酸(LA,18∶2)的几何和位置异构体的总称。它具有很多营养和保健功能,如抗癌、抗动脉粥样硬化和延缓机体免疫力衰退、减肥等[1-3]。瘤胃菌和丙酸菌中催化LA转化为活性CLA的酶为亚油酸异构酶[4-6],与瘤胃菌中较为清晰的催化机制相比,乳酸菌产CLA的机理至今尚无广泛报道。最新的研究表明,植物乳杆菌AKU1009a中LA被MCRA催化为10-HOE后被另外两个酶进一步催化而转变为CLA[7]。该催化涉及多个酶,其中第一步反应是亚油酸被转化为10-羟基-顺12-十八碳烯酸,后经双键异构和脱水两步反应而转变为CLA。第一步酶,即水合酶,与先前被预测具有多不饱和脂肪酸水合酶功能的肌球蛋白交叉反应抗原(Myosin cross reactive antigen,MCRA)具有良好的同源性,因此对该类抗原的酶学功能的研究显得非常重要。肌球蛋白交叉反应抗原最早发现于化脓链球菌,并被预测具有转化产生CLA的能力[8],这类抗原在乳酸菌中普遍存在。Rosson等[9]尝试过验证罗伊氏乳杆菌 PYR8中的MCRA亚油酸异构酶的活性,但结果显示该蛋白并不能实现LA至CLA的转化,产物中检测到了痕量的羟基化衍生物,本实验室从泡菜中筛选到一株产CLA能力的乳酸菌-植物乳杆菌ZS2058,经研究得知该菌株在MRS培养基中经0.5mg/mL的亚油酸诱导培养后,所获得的菌体细胞具有较强的CLA生成能力[10]。本研究依据已报道的瘤胃菌中亚油酸异构酶及乳酸菌中亚油酸水合酶-肌球蛋白交叉反应抗原MCRA的基因序列特征,通过生物信息学分析设计引物从植物乳杆菌ZS2058的基因组中克隆获得该基因序列,构建大肠杆菌表达载体 pET28a-MCRA,将其转化入大肠杆菌BL21(DE3)获得重组菌,经诱导表达及表达条件优化后对MCRA基因的活性进行研究。这是首次在大肠杆菌中实现植物乳杆菌ZS2058中肌球蛋白交叉反应抗原的活性表达,这将为实现完整阐述植物乳杆菌产CLA的机理提供理论依据。

表1 引物序列Table 1 Primers used in this study
1 材料与方法
1.1 材料与仪器
植物乳杆菌ZS2058(Lactobacillus plantarum ZS2058)、大肠杆菌 Escherichia coli TOP10、E.coli BL21 由本实验室保存;质粒pET28a Novagen公司;LB(Luria-Bertani)培养基 1%胰蛋白胨,0.5%酵母提取物,1%氯化钠,使用时添加卡那霉素至终浓度50μg/mL;MRS培养基 2%葡萄糖,1%蛋白胨,1%牛肉膏,0.5%酵母膏,0.2%柠檬酸氢二铵,0.5%乙酸钠,0.2%磷酸氢二钾,0.058%硫酸镁,0.025%硫酸锰,0.1%吐温 80,pH6.2~6.6,用于培养目的基因来源菌-植物乳杆菌ZS2058;限制性内切酶、T4 DNA连接酶 Takara公司;高保真DNA聚合酶KOD plusToyobo公司;基因组提取试剂盒 (北京)天根生物科技公司;底物 LA、内标十九烷酸Sigma-Aldrich公司;琼脂糖凝胶DNA回收试剂盒Fermentas;其他试剂 进口或国产分析纯;实验中的引物的合成和测序工作由上海博尚生物有限公司完成。
PCR仪 Bio-RadT100、电泳仪 Bio-Rad PowerPac Basic型 美国 Bio-Rad公司;镍柱Chelating sepharoseTMFast Flow 美国GE公司;气质联用色谱工作站Finnigan Trance GC/Finnigan Trance MS 美国Thermo公司。
本实验所用的引物见表1。
1.2 实验方法
1.2.1 MCRA基因的扩增 依据NCBI已报道的乳酸菌中亚油酸水合酶-肌球蛋白交叉反应抗原MCRA的基因序列特征,通过生物信息学分析设计表 1 引物(GenBank:JF747255.1,ZS2058MCRA-F、ZS2058MCRA-R),分别引入 Xhol I、Not I酶切位点(下划线),以植物乳杆菌ZS2058的基因组为模板用高保真KOD plus进行PCR扩增,PCR反应条件:95℃ 5min;95℃ 30s,55℃ 45s,72℃ 2min,30 个循环;72℃ 10min。
1.2.2 重组质粒及重组菌的构建 将MCRA片段的PCR产物通过Xhol I和Not I双酶切克隆至大肠杆菌质粒pET28a,得到表达载体pET28a-MCRA,将其化学转化至E.coli BL21(DE3),获得重组菌pET28a-MCRA/E.coli BL21(DE3),同时构建 pET28a/E.coli BL21(DE3)作为阴性对照,并将重组菌中的表达质粒进行PCR验证和测序验证。
1.2.3 重组蛋白表达的SDS-PAGE和Western Blot检验 挑取单菌落接种于LB培养基中(含50μg/mL卡那霉素),37℃震荡培养至 OD600为0.6,加入 IPTG至终浓度0.8mmol/L,20℃、200r/min诱导培养20h。离心收集菌体并重悬于PBS缓冲液中(0.1mol/L,pH8.0),在冰浴中进行超声破碎,离心得上清和沉淀,进而将全细胞、上清和沉淀进行SDS-PAGE和Western Blot分析,具体方法见参考文献[11],分离胶浓度为12%。
1.2.4 重组酶表达诱导条件的优化 对诱导剂IPTG的浓度调整为0.01mmol/L和0.1mmol/L,诱导温度分别为16℃和20℃,诱导20h。将诱导剂改换为0.2%乳糖,诱导条件仍为20℃,20h。
1.2.5 镍柱初步纯化重组酶 离心收集诱导结束的菌体,重悬于20mL磷酸盐缓冲液中,加入20mg溶菌酶,4℃孵育10min,超声波破碎。后细胞破碎液离心,上清用镍柱纯化,按照GE公司的产品说明进行操作。用咪唑浓度为50mmol/L和100mmol/L的缓冲液冲洗样品柱,洗去杂蛋白。然后用咪唑浓度为200和300mmol/L的缓冲液洗脱目的蛋白,收集样品进行SDS-PAGE分析和Western Blot分析。
1.2.6 重组蛋白活性的GC-MS检测 在Volkov等[12]和 Rosberg-Cody 等[13]检验该类蛋白活性的基础上进行改进,具体反应如下:将50μg LA或油酸(OA)和10μg纯化的酶,于1mL Buffer A(0.1mol/L Tris/HCl,pH6.5,0.1mol/L NaCl)中 25℃反应 1h。根据Bligh和Dyer的方法[14]提取脂肪酸,以十九烷酸做内标,提取的脂肪酸溶于甲醇后以重氮甲烷进行甲酯化,甲酯化脂肪酸最终用1mL正己烷回溶,用于GC-MS检测分析。GC-MS条件:Finnigan Trance GC/Finnigan Trance MS(美国 Thermo),色谱柱:Agilent DB-WAX(30m ×0.250mm id×0.25μm,美国安捷伦)。GC升温程序:180℃保持 0.5min,后以5℃/min的升温速率升至230℃,保持13min。载体流量He:8mL/min,载气流量He:8mL/min,气化室温度:250℃,进样量:10μL,分流比:62∶1。质谱检测条件:离子化方式:EI,电离电压:70eV;发射电流200μA;柱上温度250℃;离子室温度230℃;检测器电压350V。
2 结果与分析
2.1 MCRA基因的扩增
以L.plantarum ZS2058基因组为模板,PCR扩增MCRA基因,经1%琼脂糖凝胶电泳鉴定,得到1700bp大小的片段(图1),与预期的理论值大小相同。
2.2 表达载体pET28a-MCRA的构建
用Not I和Xhol I酶切质粒PCR产物MCRA和pET28a,胶回收目的片段,16℃过夜连接,连接产物转化E.coli TOP10感受态细胞。过夜培养,挑取转化子,扩大培养后抽提质粒,PCR验证和酶切鉴定结果如图2所示,得到预期大小的条带。后经测序显示成功构建了重组表达载体pET28a-MCRA。

图1 PCR扩增MCRA基因Fig.1 PCR amplification of MCRA gene

图2 鉴定重组质粒pET28a-MCRAFig.2 Identification of recombined plasmid pET28a-MCRA
2.3 重组表达宿主菌的构建与表达
将上述的重组质粒pET28a-MCRA转化表达宿主E.coli BL21(DE3),构建重组菌 pET28a-MCRA/E.coli BL21(DE3)。挑取能在含有Kana的LB平板上生长的菌落,扩大培养至OD600达到0.6时,添加IPTG至终浓度0.8mmol/L,20℃、200r/min诱导培养20h。将全细胞、上清和沉淀样品进行SDS-PAGE检测,同时以质粒pET28a转化的pET28a/E.coli BL21(DE3)诱导表达产物作为空白对照。结果显示目标蛋白基本都在沉淀部分,即包涵体。对IPTG浓度、诱导温度等进行调整后,目标蛋白仍不可溶。后将诱导剂改为0.2%乳糖,20℃诱导20h后,按同样方法处理,对所得全细胞、上清和沉淀样品再次进行SDS-PAGE检测,结果表明,在上清部分约67ku处有一条明显的目标蛋白条带(图3)。SDS-PAGE分析细胞破碎的上清和沉淀,表明MCRA重组蛋白主要以胞内可溶形式存在。
2.4 重组蛋白MCRA的纯化和鉴定
对镍柱纯化前及纯化后的样品,以及空白对照分别进行了SDS-PAGE分析,结果显示目的条带大小为约67ku(见图4中A部分),且纯化后的蛋白条带单一,Quantity one软件分析表明纯化后的蛋白纯度大于95%。以BSA为标准样品,Bradford法测定蛋白质浓度,结果表明经过一步纯化后,最终可获得34.4mg/L纯化的MCRA重组蛋白。引物设计时保留了pET28a载体N端His-Tag标签,即使得重组蛋白的N端带有His-tag标签,利用这个特点对空白对照,纯化前及纯化后的样品进行了Western Blot分析,结果(见图4中B部分)再次证实验证了目标蛋白成功表达。

图3 0.2%乳糖诱导的重组菌株蛋白的SDS-PAGE检验Fig.3 SDS-PAGE analysis of the proteins from recombinants with 0.2%lactose induction
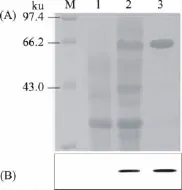
图4 重组菌株蛋白的SDS-PAGE和Western Blot分析Fig.4 SDS-PAGE analysis and Western Blotof the proteins from recombinants
2.5 重组蛋白MCRA酶活性的GC-MS检测
在先前报道[12-13]的基础上,利用亚油酸和油酸两种底物对纯化后的蛋白的活性进行了检验,结果显示MCRA蛋白可对亚油酸和油酸分别进行羟基化。
以亚油酸为底物时,GC-MS的结果显示在22.39min处有一产物峰(图5A),结合 MS结果及10-羟基-顺-12-十八碳烯酸(10-HOE)的理论碎片(图5B)等信息,可知产物就是10-羟基-顺12-十八碳烯酸。以油酸为底物时在21.76min处有一个产物峰(图6A),MS结果及10-羟基-十八碳酸(10-HO)的理论碎片(图6B)等信息,可知产物就是10-羟基-十八碳酸。

图5 以亚油酸为底物GC-MS检测结果Fig.5 GC-MS result:linoleic acid as a substrate

图6 以油酸为底物GC-MS检测结果Fig.6 GC-MS result:oleic acid as a substrate
GC-MS检测结果显示该蛋白不能催化亚油酸直接转变为CLA,表明该蛋白并非亚油酸异构酶,这与 Rosson 等[9],Volkov 等[12]和 Rosberg-Cody 等[13]报道是一致的,即以亚油酸、油酸为产物得到相应的羟基化衍生物,即肌球蛋白交叉反应抗原这类蛋白为催化CLA合成过程中的脂肪酸水合酶。本课题组先前的研究结果显示,植物乳杆菌ZS2058在转化LA产CLA的同时,积累大量的10-HOE,而MCRA蛋白催化了亚油酸至10-HOE的转变,这也与Kishino等[7]人的研究结果相符合,因此植物乳杆菌ZS2058中MCRA即为催化产CLA第一步反应中的水合酶。
3 结论
本实验成功的将L.plantarum ZS2058中的肌球蛋白交叉反应抗原基因MCRA在大肠杆菌中实现了可溶表达,活性检验结果显示该蛋白可对亚油酸、油酸进行水合,将其转变为相应的羟基化衍生物。本研究证实了植物乳杆菌ZS2058的MCRA蛋白仅起到水合酶的作用。根据先前文献报道及本课题组的相关研究结果可知,该羟基化衍生物在乳酸菌中可进一步被催化转变为CLA。本研究同时也为进一步扩大研究乳酸菌产CLA的机理研究奠定了理论基础。
[1]Belury M A.Dietary conjugated linoleic acid in health:physiological effects and mechanisms of action[J].Annual Review of Nutrition,2002,22:505-531.
[2]Jones E L,Shingfield K J,Kohen C,et al.Chemical,physical,and sensory properties of dairy products enriched with conjugated linoleic acid[J].Journal of Dairy Science,2005,88(8):2923-2937.
[3]Pariza M.Perspective on the safety and effectiveness of conjugated linoleic acid[J].American Journal of Clinical Nutrition,2004,79:1132S-1136S.
[4]Kepler C R,Hirons K P,McNeil J J,et al.Intermediates and products of the biohydrogenation of linoleic acid by Butyrivibrio fibrisolvens[J].Journal of Biological Chemistry,1966,241:1350-1354.
[5]Or- Rashid M M,Alzahal O,McBride B W.Comparative studies on the metabolism of linoleic acid by rumen bacteria,protozoa,and their mixture in vitro[J].Applied Microbiology and Biotechnology,2011,89(2):387-395.
[6]Liavonchanka A,Hornung E,Feussner I,et al.Structure and mechanism of the Propionibacterium acnes polyunsaturated fatty acid isomerase[J].Proceedings of the National Academy of Sciences of the United States of America,2006,103(8):2576-2581.
[7]Kishino S,Park S B,Takeuchi M,et al.Novel multicomponent enzyme machinery in lactic acid bacteria catalyzing C=C double bond migration useful for conjugated fatty acid synthesis[J].Biochemical and Biophysical Research Communications,2011,416:188-193.
[8]Kil K S,Cunningham M W,Barnett L A.Cloning and sequence analysis of a gene encoding a 67-kilodalton myosincross-reactive antigen of Streptococcus pyogenes reveals its similarity with Class II major histocompatibility antigens[J].Infection and Immunity,1994,62:2440-2449.
[9]Rosson R A,Grund A D.Linoleate isomerase.World Patent:100846[P].2001.
[10]钮晓燕,陈卫,田丰伟,等.植物乳杆菌ZS2058在磷酸盐缓冲液体系中生物转化共轭亚油酸[J].微生物学报,2007,47(2):244-248.
[11]Sambrook J,Fritsch E F,Maniatis T.Molecular Cloning:A Laboratory Manual.2nd Ed.New York:Cold Spring Harbor Laboratory Press,1989.
[12]Volkov A,Liavonchanka A,Kamneva O,et al.Myosin crossreactive antigen of Streptococcus pyogenes M49 encodes a fatty acid double bond hydratase that plays a role in oleic acid detoxification and bacterial virulence[J].Journal of Biological Chemistry,2010,285(14):10353-10361.
[13]Rosberg-Cody E,Liavonchanka A,Göbel C,et al.Myosincross-reactive antigen(MCRA)protein from Bifidobacterium breve is a FAD-dependent fatty acid hydratase which has a function in stress protection[J].BMC Biochemistry,2011,12:9.
[14]Bligh E G,Dyer W J.A rapid method of total lipid extraction and purification[J].Canadian Journal of Biochemistry and Physiology,1959,37:911-917.

