婴儿配方羊奶粉对幼龄动物生长发育的影响及其蛋白质体内消化研究
顾浩峰,张富新 ,张 怡,晏慧莉,贾润芳
(1.陕西师范大学食品工程与营养科学学院,陕西西安710062;2.安康学院农学与生命科学院,陕西安康725000)
婴儿时期是人生中最重要的生理阶段,在此期间婴儿自身代谢系统尚未发育完善,而生长发育非常旺盛,因此需要摄入营养全面、易于消化吸收的食物[1-2]。长期以来,母乳被视为婴儿的最佳食品,但由于女性工作、健康等原因,婴儿的母乳喂养率较低,所以研究开发母乳替代品已经成为营养学家和乳品工作者研究的热点问题[3-5]。考虑到婴儿生理代谢能力差和生长发育迅速这一特殊生理状态,母乳替代品对幼龄动物的营养效果和生长发育的影响成为评价该类食品营养价值时必须参考的重要指标[6]。同时由于蛋白质是母乳替代品中一类重要的营养素,它是婴儿生长发育必要的物质基础,所以质优量足、易于消化吸收的蛋白质对婴儿时期生长发育及各项生理功能具有重要意义[7-8]。目前,我国主流的母乳替代品是婴儿配方牛奶粉,其他种类的婴儿配方食品较少。但近年来,随着婴儿配方牛奶粉过敏案例的不断增加和人们营养意识的提升,具有较低致敏率和丰富营养价值的羊奶和以羊奶为主要原料的婴儿配方奶粉受到人们普遍重视[9-10],但有关婴儿配方羊奶粉,特别是其消化吸收和对幼龄动物生长发育影响方面的研究目前报道较少。因此本文通过昆明小鼠体内消化实验和SD大鼠28d生长实验,研究婴儿配方羊奶粉中蛋白质的体内消化率和该奶粉对幼龄动物生长发育的促进作用,评价婴儿配方羊奶粉的营养价值,为进一步研究和开发婴儿配方羊奶粉提供科学依据。
1 材料与方法
1.1 材料与试剂
全脂羊奶粉 由陕西圣唐乳业有限公司生产,其中蛋白质 24.84%,脂肪 31.85%,碳水化合物34.34%,氨基酸评分为67,饱和脂肪酸/不饱和脂肪酸比为2.14,矿物质6.5%,Ca/P比为1.1;婴儿配方牛奶粉 购于超市某品牌婴儿配方牛奶粉,其中蛋白质12.5%,脂肪26%,碳水化合物56,氨基酸评分为80,饱和脂肪酸/不饱和脂肪酸比为1.6,矿物质3.6%,Ca/P比为3;婴儿配方羊奶粉 由本实验室研究的婴儿配方羊奶粉,其成分均符合国家标准。其中蛋白质13.51%,脂肪27%,碳水化合物56.27%,氨基酸评分为88,饱和脂肪酸/不饱和脂肪酸为1.22,矿物质3.5%,Ca/P比为2.1;昆明小鼠60只,平均体重为(20±0.05)g,雌雄各半,购于西安交通大学医学院动物中心;清洁级断乳雄性SD大白鼠30只,4周龄,体重40~50g,购于西安交通大学医学院动物中心;硫酸铜、硫酸钾、三氯乙酸、98%浓硫酸、盐酸 、硼酸、甲基红、溴甲酚绿、95%乙醇、氢氧化钠 均为分析纯。
KDY-9810凯氏定氮仪 北京市通润源机电技术有限责任公司;消化炉 瑞典FOSS公司;低温高速离心机 德国Sigma公司;LGJ-18C真空冷冻干燥机 北京四环科学仪器厂。
1.2 实验方法
1.2.1 蛋白质的体内消化实验 体内消化参照吴庆贺的方法[2],并加以改进。将60只平均体重为(20±0.05)g昆明小鼠分成3组,每组20只,雌雄各半。其中第1组为羊奶全脂奶粉组,第2组为市售牛奶婴儿配方粉组,第3组为羊奶婴儿配方粉组。正式实验前小鼠在实验环境下适应3天,适应期间饲喂常备饲料,自由进水。第4天早晨开始禁食不禁水12h,随后向每只小鼠定量灌入0.5mL浓度为40%的奶粉溶液,在灌食后第0.5、1、2、3、4h分别屠宰每组中的4只,迅速剖开腹腔,取出胃、十二指肠,置于冰盒中保存。
1.2.2 动物生长效果实验
1.2.2.1 实验动物分组 实验动物分组参照陆翔的方法并对其加以改进[11]。将30只清洁级4周龄断乳雄性SD大白鼠在实验环境(室温(21±2)℃,室内相对湿度RH=(32% ±2%),自然光照)下适应3d。适应期间饲喂常备饲料,自由进水。第4d早晨停食,3h称体重。按体重分成3组,每组10只,单笼饲养,各组间的大鼠平均体重无显著差异(p>0.05),第一组为全脂羊奶粉组,第二组为婴儿配方牛奶粉组,第三组为婴儿配方羊奶粉组。
1.2.2.2 实验动物饲料配制 实验动物饲料的配制参照仇秀珍的方法[6]。以实验组婴儿配方羊奶粉的热量为标准,其余两组以白糖调配成与实验组等热量的奶粉后分别作为各组大鼠饲料。各组饲料奶粉的营养成分见表1。
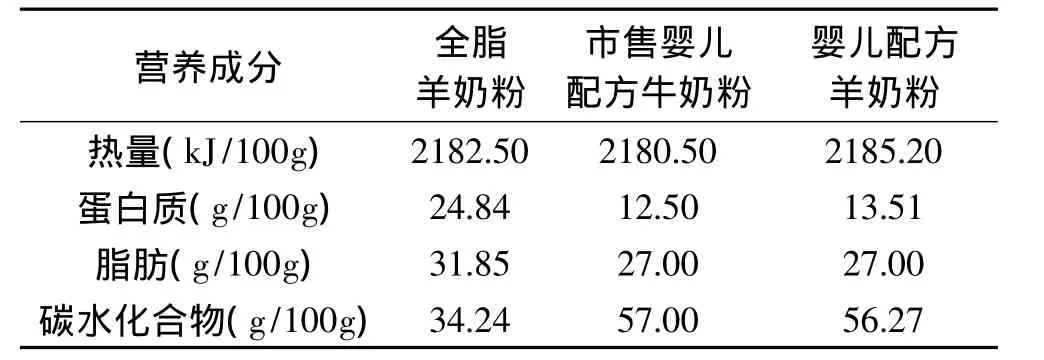
表1 各组饲料奶粉的营养成分Table 1 Nutritional components of different milk powders
1.2.2.3 实验动物喂养 实验动物喂养参照陆翔的方法[11]。每日投放给大鼠的饲料量为大鼠体重的15%,其间大鼠自由摄取规定的饲料,自由饮水,实验周期为28d。记录实验开始第 0、7、14、21、28d 的身长和体重,并记录每只幼鼠食物摄入量,计算食物利用率及热能效价。实验结束后,断颈椎处死老鼠,取出大鼠的心脏、肝脏、肾脏、脾脏和性腺,并称重测定实验动物体内脏器发育情况。
1.3 测定方法
1.3.1 蛋白质的体内消化率测定 奶样中蛋白质体内消化率的测定参照吴庆贺和洪滨的方法[2,12],并对其加以改进。用生理盐水冲洗1.2.1步骤取出的胃和肠消化道,将胃液和肠液收集于25mL烧杯中,在-50℃下进行真空冷冻干燥48h。用10mL蒸馏水溶解冻干样品,12000r/min低温高速离心10min。收集上清液,按体积比1∶1加入0.6mol/L三氯乙酸沉淀蛋白,5000r/min低温离心15min,收集蛋白质沉淀,用凯氏定氮法测定其中蛋白质的含量[13],然后用下面公式计算消化率。
蛋白质消化率(%)=灌入奶样中蛋白质的含量-胃肠中剩余蛋白的含量/灌入奶样中蛋白质的含量×100
1.3.2 奶粉的利用率、蛋白质功效比和热能价效的计算 奶粉的食物利用率、蛋白质功效比及热能效率依照下列进行公式计算[6,11]。
食物利用率(%)=(体重增量/同期内的进食量)×100
蛋白质功效比 =体重增量/同期内摄入的蛋白量
热能效价=(体重增量/同期内摄入的热量)×418.4
1.4 数据处理
实验数据采用SPSS19.0 One way ANOVA软件分析处理,并进行显著性差异分析。
2 结果与分析
2.1 婴儿配方羊奶粉中蛋白质的体内消化率
消化率是机体消化吸收的食物量占食物总摄入量的百分比,是评价食物营养价值的重要指标之一。本实验以全脂羊奶粉和婴儿配方牛奶粉为对照,对婴儿配方羊奶粉进行体内消化,评价婴儿配方羊奶粉中蛋白质的体内消化率。不同奶粉样品中蛋白质的体内消化率如图1所示。
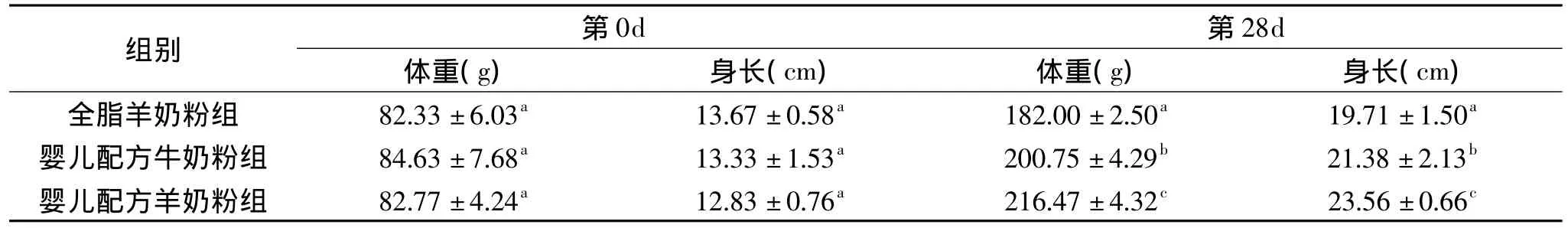
表2 各组实验大鼠的身长和体重Table 2 Value of length and weight of rats in different group
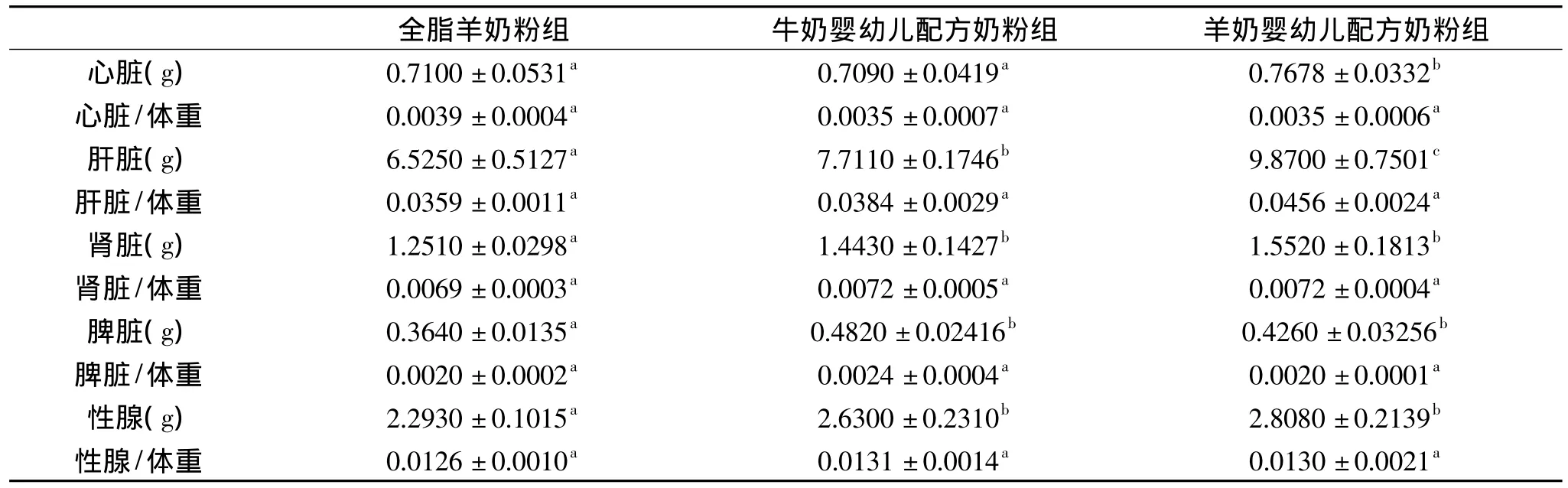
表3 各组实验大鼠的重要脏器重量及脏器与体重比值Table 3 Value of viscera weight and ratio of viscera weight to body weight for rats in different group
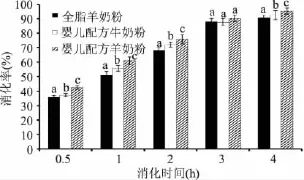
图1 不同样品奶粉中蛋白质的体内消化率Fig.1 In vivo digestibility of proteins in different milk powders
由图1可知,随着消化时间的延长,3组奶粉中蛋白质的消化率均呈逐渐上升趋势,并且在灌食后一定时间段内,不同组别奶粉中蛋白质的消化率存在一定差别。在灌食后2h内,3组奶粉中蛋白质的消化率差别较大(p<0.05),均为全脂羊奶粉组消化率最低,婴儿配方奶粉中蛋白质的消化率较高,其中婴儿配方羊奶粉中蛋白质的消化率最高,在灌食后2h时达到75.79%,显著高于婴儿配方牛奶粉组(p<0.05)。表明婴儿配方羊奶粉中蛋白质能够较快地被机体消化吸收,营养价值较高。这与Jasinska[14]的研究结果以及前期的体外消化实验结果基本一致。在灌食3h后,各组奶粉中蛋白质的消化率上升趋势逐渐平缓,且各组奶粉中蛋白质消化率无显著差别(p>0.05)。但在灌食4h时,婴儿配方羊奶粉组蛋白质的消化率明显高于其他两个对照组(p<0.05),消化率达到95.26%。由此表明,婴儿配方羊奶粉中大部分的蛋白质可以被机体吸收利用,其蛋白质的消化效果更好。
2.2 婴儿配方羊奶粉对幼龄动物生长发育的影响
2.2.1 婴儿配方羊奶粉幼龄动物身长和体重的影响
以四周龄的SD大鼠为实验对象,进行上述奶粉的喂养实验。喂养实验结束后,测定不同奶粉样品对幼龄动物身长和体重的影响,结果见表2。
由表2可以看出,在实验开始阶段,各组大鼠的体重和身长均无显著差异(p>0.05)。经过实验期饲养后,3组大鼠的体重和身长均有不同程度的增长,其中全脂羊奶粉组大鼠体重已明显落后于婴儿配方奶粉组(p<0.05),并且在两组婴儿配方奶粉中婴儿配方羊奶粉组大鼠体重最高(p<0.05),为216.47g。同样在大鼠身长方面,全脂羊奶粉组大鼠身长增长最缓慢,实验结束时该组大鼠身长最短(p<0.05),而婴儿配方羊奶粉组大鼠身长达到23.56cm,显著高于其他两个对照组(p<0.05)。由此表明,婴儿配方羊奶粉在促进幼年机体的生长发育方面明显优于等热量的全脂羊奶粉和婴儿配方牛奶粉。
2.2.2 婴儿配方羊奶粉对幼龄动物体内脏器发育的影响 各组SD大鼠体内脏器发育情况见表3。
由表3可以看出,各组大鼠内脏发育状况有一定差别。在脏器重量方面,除脾脏外,婴儿配方奶组大鼠脏器重量均高于全脂羊奶粉组,并且在两组婴儿配方奶粉组中,羊婴儿配方奶粉组大鼠的脏器重量最高。在脏器/体重比值方面,各组大鼠的心、肝、肾、脾和性腺的脏器/体重比值接近,无显著差别(p>0.05)。实验动物的脏器重量及脏器/体重比值是动物正常生理状态和生物医学研究的重要基础指标,对特殊食品的开发具有重要指导意义[16-17]。本实验中婴儿配方奶粉组大鼠脏器重量和脏器/体重比值与李武祎[18]的研究结果基本一致。由此说明,婴儿配方牛奶粉和婴儿配方羊奶粉均能有效促进幼龄动物生长发育,其中婴儿配方羊奶粉在促进幼龄动物生长发育方面的作用较为明显。
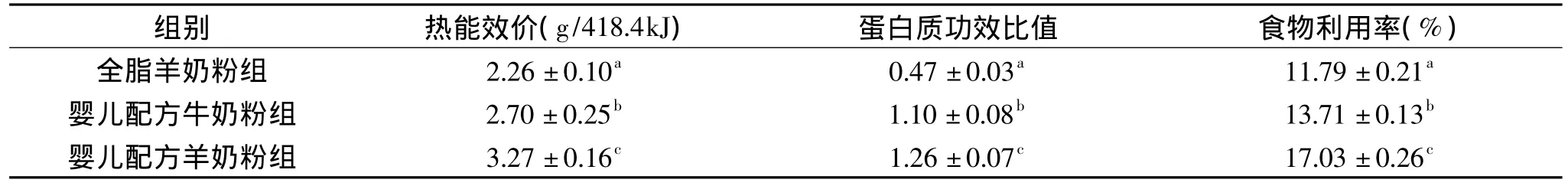
表4 各组奶粉的热能效价、蛋白质功效比值和食物利用率Table 4 Energy efficiency,protein efficiency ratio,food utilization rate for different milk powders
2.3 婴儿配方羊奶粉的热能价效、蛋白质功效比和食物利用率
热能价效、蛋白质功效比和食物利用率通常作为评价食品营养价值的重要指标,各组奶粉样品的热能价效、蛋白质功效比和食物利用率见表4。
由表4可以看出,各组奶粉的热能价效、蛋白质功效比和食物利用率均有一定差别,并且差异显著(p<0.05)。全脂羊奶粉的热能价效、蛋白质功效比和食物利用率都较低,显著低于婴儿配方奶粉组(p<0.05),并且婴儿配方羊奶粉组的3个指标均最高,分别达到3.27g/418.4kJ、1.26以及17.03%。由此表明,在等热量的条件下,婴儿配方羊奶粉的营养价值高于婴儿配方牛奶粉和全脂羊奶粉。
3 讨论
本实验对婴儿配方羊奶粉中蛋白质进行体内消化分析,研究结果表明,婴儿配方羊奶粉中蛋白质最终体内消化率明显高于其他两个对照组(p<0.05),婴儿配方牛奶粉其次,全脂羊奶粉最低,这可能是由于各组样品奶粉中蛋白质组分不同所致。婴儿配方羊奶粉和婴儿配方牛奶粉经科学调配,其中乳清蛋白:酪蛋白不低于60∶40,而全脂羊奶粉中蛋白质以酪蛋白为主。酪蛋白在酸性条件下容易凝聚,其消化吸收性低于乳清蛋白,所以全脂羊奶粉组蛋白质的消化率较低[11,19]。另一方面,虽然婴儿配方羊奶粉和婴儿配方牛奶粉中乳清蛋白与酪蛋白含量相当,但两类婴儿配方奶粉中乳清蛋白和酪蛋白的组成以及各蛋白组分的消化吸收性能不同,这可能是婴儿配方羊奶粉中蛋白质消化率高于婴儿配方牛奶粉的重要原因。从酪蛋白方面看,婴儿配方羊奶粉中酪蛋白主要是β-酪蛋白,αs1-酪蛋白含量较低,而婴儿配方牛奶粉中主要的酪蛋白是β-乳球蛋白[20]。有研究表明,羊奶酪蛋白的消化率高于牛奶酪蛋白,且其主要原因正是羊奶中含有较多β-酪蛋白[14]。同时,羊奶酪蛋白凝乳更细、更软,酪蛋白的胶束更大等特性也促使了羊奶酪蛋白能够更好的被机体消化吸收[21-22]。从乳清蛋白方面看,两类婴儿配方奶粉的组成差别不大,都主要由α-乳白蛋白和β-乳球蛋白构成[20]。但 El-Zahar和 Almaas发现羊奶 β-乳球蛋白的消化率比牛奶β-乳球蛋白高,而乳清蛋白的其他组分(α-乳白蛋白、免疫球蛋白、乳铁蛋白等)消化率差别不大[23-24]。因为 β-乳球蛋白一级结构中几个氨基酸组成不同,使得羊奶β-乳球蛋白表面比牛奶β-乳球蛋白具有更强的疏水性,从而更多的疏水C端暴露到分子表面,胃蛋白酶优先水解包含疏水氨基酸残基的肽键,所以羊奶中β-乳球蛋白消化性更好[24]。同时,也有报道显示αs1-酪蛋白的存在会增加机体内β-乳球蛋白的抗体,不利于β-乳球蛋白的消化吸收,所以β-乳球蛋白的消化率与奶中αs1-酪蛋白的含量成负相关[25]。此外,虽然本研究中各组奶粉中其他营养成分(脂肪、矿物质、碳水化合物等)含量相差不大,但这些物质可能略微影响蛋白酶的活力,从而影响蛋白质的消化率。另外实验动物由于实验过程中惊吓、拉稀等生理现象也会对蛋白质的消化率产生影响。但就总体而言,本实验所得结果与前人研究基本一致。
本研究中动物生长实验结果表明,婴儿配方羊奶粉组幼龄动物身长、体重、内脏等生长发育状况都优于其他两个对照组,这可能是婴儿配方羊奶粉中营养组成较为合理的原因。在蛋白质方面,婴儿配方奶粉中氨基酸配比与母乳具有高度相关性,而且体外和体内消化分析也显示了较高的消化率,所以从理论上来说其蛋白质功效比应当较高。在脂肪方面,婴儿配方羊奶粉的脂肪组成接近母乳,不饱和脂肪酸与饱和脂肪酸比例约为1.2,符合营养推荐要求,并且其中亚油酸和亚麻酸这种必需脂肪酸含量适宜,因此其脂肪的营养价值消化吸收性能优于其他两个对照组。在矿物质方面,全脂营养奶粉中矿物质含量偏高,过高的矿物质含量不利于幼龄动物的生长,两组婴儿配方羊奶粉中矿物质含量适宜,但婴儿配方羊奶粉中Ca和P比值接近2,符合营养推荐需求,因此从矿物质来看婴儿配方羊奶粉也具有明显的营养优势。当然,在研究幼龄动物内脏的发育状况时,具有实施器官剪切摘取过程中也会造成一定的误差,但就总体来看,本实验结果基本与预期的理论结果一致。
4 结论
本文通过婴儿配方羊奶粉对幼龄动物生长发育的影响及其蛋白质消化率研究,最终得出如下结论:婴儿配方羊奶粉中蛋白质的消化率较高,能够较快地被机体消化吸收;婴儿配方羊奶粉组幼龄动物的身长、体重,奶粉的热能效率、蛋白质功效比及食物利用率都明显高于其他两个对照组。由此说明,婴儿配方羊奶粉具有较高的营养价值,能够有效的促进幼龄动物的生长发育,是优良的母乳替代品。
[1]王光慈 .食品营养学[M].北京:中国农业出版社,2001,107.
[2]吴庆贺.新型婴儿配方乳粉的研究[D].哈尔滨:东北农业大学,2008.
[3]陈辉.应用酶法水解牛乳蛋白研制婴儿配方乳[D].哈尔滨:东北农业大学,2003.
[4]Sidnell A,Greenstreet E.Infant nutrition-protein and its influence on growth rate[J].Nutrition Bulletin,2009,34(4):395-400.
[5]Trabulsi J,Capeding R,Lebumfacil J,et al.Effect of an α-lactalbumin-enriched infant formula with lower protein on growth[J].European Journal of Clinical Nutrition,2011,65(2):167-174.
[6]仇秀珍,叶玉屏,孙斌,等.婴儿配方牛奶营养效果实验研究评价[J].广西医学院学报,1993,10(3):303-305.
[7]Martine S A,Petra A M J S.Current trends in the composition of infant milk formulas[J].Current Paediatrics,2004,14(1):51-63.
[8]Wells J C K.Nutritional considerations in infant formula design[J].Seminars in Neonatology,1996,1(1):19-26.
[9]Haenlein Gfw.Goat milk in human nutrition[J].Small Ruminant Research,2004,51:155-163.
[10]Park Y W.Hypo-allergenic and therapeutic significance of goat milk[J].Small Ruminant Research,1994,14(2):151-159.
[11]陆翔,李静,王强,等.模拟中国母乳配制的婴儿配方奶粉对幼龄动物生长影响的实验研究[J].食品工业科技,2010,31(10):352-355.
[12]洪滨.仿早产儿母乳配方奶粉的研究及其消化率的评价[D].哈尔滨:东北农业大学,2011.
[13]GB5009.5-2010.食品中蛋白质的测定[S].北京:中华人民共和国卫生部.
[14]Jasinska B.The comparison of pepsin and trypsin action on goat,cow,mare and human caseins[J].Rocz Akad Med Bialymst,1995,40(3):486-493.
[15]田永路,于洪江,张希牧,等.5~7周龄SD和Wistar大鼠主要脏器系数及体尺的测定[J].实验动物科学,2009,26(6):21-25.
[16]陈华,乔伯英,李春海,等.SPF清洁及普通级大鼠部分生物学特性的比较[J].中国实验动物学杂志,1999,9(1):28-33.
[17]董延生,尹纪业,陈长,等.SD大鼠脏器重量及脏器系数正常参考值的确立与应用[J].军事医学,2012,36(5):351-353.
[18]李武祎.干酪素酪蛋白组分分离技术及β—酪白配方粉的营养评价研究[D].北京:中国农业大学,2005.
[19]Tome D.PhysiologicalEffects of MilkProteinComponents[J].International Dairy Journal,1998,8(5):383-392.
[20]顾浩峰,张富新,梁蕾,等.山羊奶与牛奶和人奶营养成分的比较[J].食品工业科技,2012,33(8):369-373.
[21]Park Y W.Rheological characteristics of goat and sheep milk[J].Small Ruminant Research,2007,68(1):73-87.
[22]InglingstadR A.Comparison of the digestion of caseins and whey proteins in equine,bovine,caprine and human milks by human gastrointestinal enzymes[J].Dairy Science & Technology,2010,90(5):1958-5586.
[23]Almaasa H,Casesa A.In vitro digestion of bovine and caprine milk by human gastric and duodenal enzymes[J].International Dairy Journal,2006,16(9):961-968.
[24]El- zahar.Peptic hydrolysis of ovine β - lactoglobulin and α-lactalbumin Exceptional susceptibility of native ovine β-lactoglobulin to pepsinolysis[J].International Dairy Journal,2005,15(1):17-27.
[25]Silanikov N,Leitner G,Merin U,et al.Recent advances in exploiting goat's milk:Quality,safety and production aspects[J].Small Ruminant Research,2010,89(2):110-124.

