多壁碳纳米管基质固相分散萃取-HPLC法测定蔬菜中的啶虫脒残留
杨 敏,方树桔,谭 伟,李 彬,王红斌
(云南民族大学,民族药资源化学国家民委-教育部重点实验室,化学与生物技术学院,云南昆明650500)
啶虫脒又名吡虫清、莫比朗、NI-25,英文通用名为acetamiprid,1996年由日本曹达株式会社继吡虫啉、烯啶虫胺后开发并且商品化的第3个氯化烟碱类杀虫剂[1],具有毒性小、活性高、持效期长等特性。目前,分析啶虫脒农药残留的方法有固相萃取-高效液相色谱法[2],固相萃取-超高效液相色谱串联质谱法[3],柱层析-气相色谱法[4]。固相萃取法是啶虫脒农药残留分析的主要前处理技术,气相色谱法和液相色谱法是目前检测啶虫脒残留的主要方法[5]。基质固相分散(MSPD)是Barker首次提出并给予理论解释的一种样品处理技术[6]。MSPD包含前处理所需的样品均化、提取、净化等过程,避免了传统的前处理方法在均化、沉淀、离心、转溶、乳化、浓缩等转移中造成目标分析物的损失[7]。多壁碳纳米管(Multi-walled carbon nanotubes,MWCNTs)作为一种新型的纳米材料,具有广泛的用途,有报道研究以碳纳米管作为储氢材料[8];张茜等人研究首次以碳纳米管作为电极测定石榴皮提取物中的鞣花酸,该方法在优化条件下可以实现快速检测鞣花酸[9];赵海香等人以MWCNTs作为吸附剂,固相萃取净化气相色谱法分析蔬菜中有机磷[10]、有机氯和拟除虫菊酯[11],结果表明MWCNTs具有较强的吸附和去除色素的能力;李权龙,袁东星以MWCNTs作为吸附剂测定水样中有机磷[12],方法回收率均高于70%,MWCNTs吸附性强;王学翠等人以MWCNTs为吸附材料测定牛奶中四环素,方法简便,结果准确[13]。本文以新型纳米材料多壁碳纳米管作为固相萃取材料,建立基质固相分散萃取-高效液相色谱法测定蔬菜中啶虫脒农药残留。
1 材料与方法
1.1 材料与仪器
工业级多壁碳纳米管(型号:GYM003)、羟基化多壁碳纳米管(型号:FMQ003)、羧基化多壁碳纳米管(型号:FMS003)中科院成都有机所,使用前于105℃下活化1h;三硅酸镁、无水硫酸镁 化学纯;乙酸乙酯,乙腈,环己烷,甲醇 为色谱纯;水 娃哈哈纯净水;啶虫脒标准品 农业部环境保护科研检测所,纯度>98.0%。
蔬菜、水果样品 均采自海南省海口市、琼海市、三亚市。
Agilent1290色谱仪 自动进样系统,紫外检测器;RE-52AA型真空旋转蒸发仪 上海亚荣生化仪器厂;SHB-Ⅲ型冷却循环泵 郑州长城科工贸有限公司;JJ500型电子天平 常熟双屯测试仪器厂。
1.2 实验方法
1.2.1 啶虫脒标准溶液的配制 准确移取1000mg/L啶虫脒标准品0.9mL至10mL容量瓶中,用甲醇稀释成90mg/L的标准储备液,于4℃冰箱内储存。
1.2.2 MSPD样品前处理过程 准确称取0.5g(精确到0.01g)样品于研钵中,加入100mg MWCNTs,加入0.5g无水硫酸镁,研磨4min。取10 mL注射器,底部放上筛板,称取0.5g三硅酸镁净化材料置于筛板上,然后将已研磨好的混合物转移到注射器内,再放上少许脱脂棉,压实,保证柱子填实均匀,避免有裂缝存在。用20mL乙酸乙酯进行洗脱,收集洗脱液,旋蒸浓缩近干,用甲醇定容至2mL,过0.22μm滤膜,待分析。
1.2.3 HPLC色谱条件 色谱柱:C8柱(3.0mm×100mm,1.8μm),流动相:甲醇-水(3∶2,v/v);流速:0.10mL/min;紫外检测波长:250nm;进样量:2.5μL;柱温:30℃。
2 结果与讨论
2.1 HPLC色谱条件的确定
2.1.1 流动相的确定 啶虫脒极性大,易溶于水,故采用甲醇-水体系作为流动相,甲醇-水体积比为9∶1、4∶1、7∶3、3∶2、1∶1、2∶3。结果表明,当流动相体积比为9∶1、4∶1、7∶3 时,啶虫脒在 5min 前出峰,出峰过早且峰拖尾;当流动相体积比为3∶2时,基线平稳,啶虫脒与最近的杂质峰达到基线分离,分离效果很好;当流动相体积比为1∶1、2∶3时,啶虫脒分离效果好,但峰不够锐。故选择甲醇-水(3∶2)作为流动相。
2.1.2 检测波长的确定 对啶虫脒标准品进行了全波长扫描,啶虫脒在250nm处有最大吸收,故选择250nm作为检测波长。
2.1.3 流速的确定 考察了流速为 0.05、0.10、0.20mL/min时啶虫脒的出峰情况。结果表明,当流速为0.05mL/min,啶虫脒出峰有拖尾现象,且出峰延迟;0.20mL/min时,基线分离,分离效果较好,但啶虫脒出峰时间为 2.958min,出峰过早;当流速为0.10mL/min时,啶虫脒在5.801min出峰,基线平稳,分离效果很好,故本文选择流速为0.10mL/min。
2.1.4 柱温的确定 考察了柱温为20、30、40℃下,啶虫脒的出峰情况,结果表明柱温对啶虫脒出峰影响不大,故选择30℃作为检测柱温。
本文最终确定了1.2.3的色谱条件,啶虫脒标准品(0.5mg/L)色谱分析图如图1所示。

图1 啶虫脒的标准品色谱图Fig.1 Chromatogram of standard acetamiprid
2.2 MSPD样品前处理条件的优化
2.2.1 固相萃取材料的选择 工业级MWCNTs、羟基化MWCNTs、羧基化MWCNTs对啶虫脒添加回收率分别为103.8%,81.4%,87.3%,都能满足农药残留分析要求,最终选择效果最好、价格便宜的工业级多壁碳纳米管作为固相萃取材料。
2.2.2 萃取材料用量的选择 样品用量为0.5g、MWCNTs用量分别为 50、80、100、120mg,同时加入0.5g无水硫酸镁除水,其回收率分别为63.6%、97.7%、99.8%、83.3%。固相萃取材料用量为50和120mg时,样品加标回收率偏低,用量为80和100mg时回收率满足农药残留分析要求,最终选择回收效果更好的100mg作为萃取用量。
2.2.3 洗脱剂及其用量的选择 用30mL乙腈、乙酸乙酯、乙酸乙酯-环己烷(4∶1)、乙酸乙酯-环己烷(9∶1)对啶虫脒分别进行洗脱,其回收率分别为113.6%、103.8%、103.5%、98.7%。四种洗脱剂均能满足分析要求,但乙腈回收率偏高,乙酸乙酯、乙酸乙酯-环己烷(4∶1)、乙酸乙酯-环己烷(9∶1)的洗脱效果相当。为便于分析,最后选择乙酸乙酯作为洗脱剂。同时考察了洗脱剂用量对分析的影响,比较了乙酸乙酯用量为 10、15、20、25、30、35mL 的洗脱效果,结果如图2所示,最终选择20mL为洗脱剂用量。
2.2.4 研磨时间的优化 研磨时间为3、4、5min的回收率分别为88.8%、101.3%、102.1%。研磨时间≥4min时,回收率较好,因此,选择研磨时间为4min。
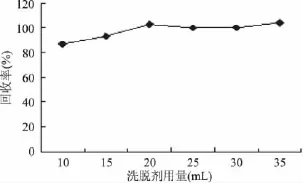
图2 洗脱剂用量对啶虫脒回收率的影响Fig.2 Effect of ethylacetate consumption on recovery rate of acetamiprid
2.2.5 净化条件的确定 以三硅酸镁作为净化剂,按1.2.2操作步骤,称取一份样品,将0.5g三硅酸镁放入研钵中,与样品和碳纳米管一起研磨分散净化;称取另一份样品与碳纳米管一起研磨,取0.5g三硅酸镁置于注射器底部筛板上,然后将已研磨好的混合物转移至注射器内,通过填柱净化以达到除杂的目的,净化效果如图3所示。由图3可知,三硅酸镁直接置于筛板上净化样品的效果较好,故选择其作为净化方式。
2.3 方法的线性及检出限
准确配制含量分别为 0.025、0.05、0.10、0.50、1.00、2.50 mg/L的啶虫脒标准溶液,按1.2.3色谱条件分析。以峰面积(Y)对浓度(X)作线性回归分析,得到线性方程为:Y=144.34X+3.0611,R=0.9996,方法最低检出限(3S/N)为0.0085mg/L。
2.4 方法的精密度及回收实验
称取 0.5g空心菜样品,分别添加 0.05、0.10、0.50mg/L的啶虫脒标样,方法的回收率及精密度如表1所示,其加标回收率在95.6%~99.5%之间,RSD≤2.9%,符合农药残留分析的要求。
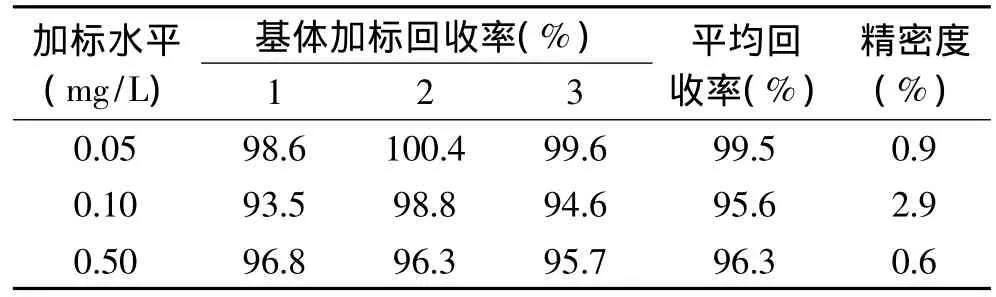
表1 方法的回收率及精密度(n=3)Table 1 Recovery rate and RSD(n=3)
2.5 实际样品分析
按本文建立的分析方法测定了不同批次不同品种蔬菜样品中的啶虫脒残留,分析结果如表2所示,蔬菜样品的平均回收率为84.0%~106.0%,精密度为0.1%~12.5%,方法精密度较好,符合啶虫脒残留分析的要求。蔬菜样品中有两个样品检出啶虫脒,分别为蕹菜 0.118mg/L,菜心 0.148mg/L,均未超标[14]。
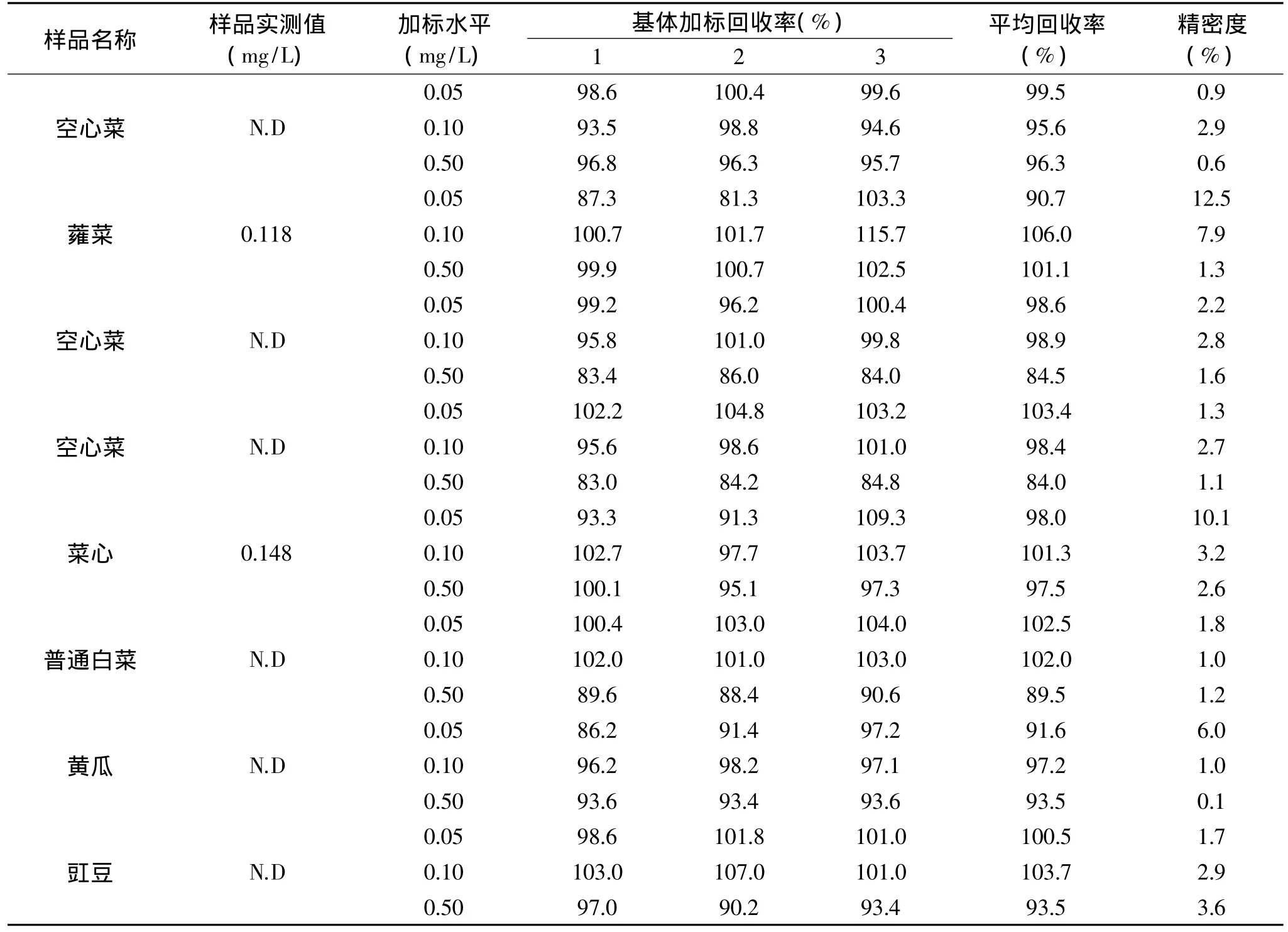
表2 蔬菜样品分析结果(n=3)Table 2 Analytical results of vegetable samples(n=3)
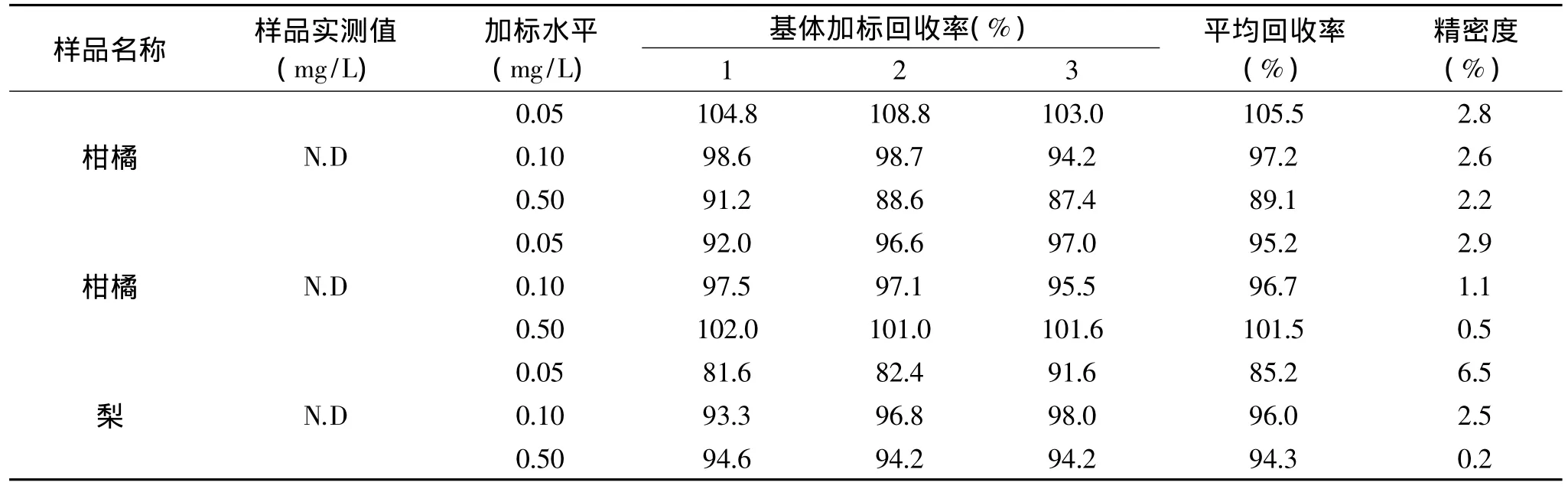
表3 水果样品分析结果(n=3)Table 3 Analytical results of fruit samples(n=3)
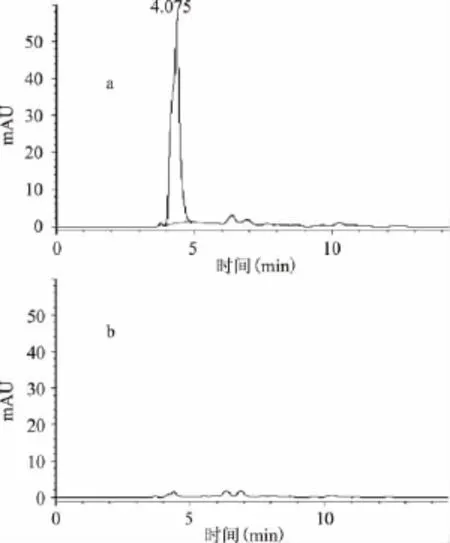
图3 研磨分散净化与填柱净化的对比Fig.3 Comparison of dispering purification and Filling column purification
2.6 方法推广
将该方法应用到水果中啶虫脒残留的测定,分析结果如表3所示,水果样品中啶虫脒的平均回收率为85.2%~105.5%,精密度为0.2%~6.5%,实验结果表明该方法精密度好,满足农药残留分析要求。实验测定了三个水果样品,均未检出啶虫脒,结果见表3。
3 结论
本文采用吸附性较强的多壁碳纳米管为基质分散剂,以三硅酸镁作为净化剂,乙酸乙酯为洗脱剂,建立了蔬菜中啶虫脒农药残留的基质固相分散萃取、高效液相色谱紫外检测的分析方法。采用C8柱(3.0mm ×100mm,1.8μm)分离,甲醇-水(3∶2,v/v)为流动相,流速0.10mL/min,紫外检测波长250nm,进样量2.5μL,柱温为30℃。结果表明,本方法对蔬菜样品中啶虫脒的平均回收率为84.0%~106.0%,精密度为0.1%~12.5%,方法最低检出限为0.0085mg/L,方法的各项指标均符合农药残留分析的要求,说明多壁碳纳米管能够用作啶虫脒农药残留分析。该方法对蔬菜中啶虫脒测定效果较好,同时可以对部分水果中农残样品进行分析。
[1]唐振华.新烟碱类杀虫剂的结构与活性及其药效基团[J].现代农药,2002(1):16.
[2]苏婷,侯如燕,赵秀霞,等.茶叶、茶鲜叶及茶汤中啶虫脒残留的检测[J].食品与发酵工业,2011,37(10):174-177.
[3]李娟,孙程鹏,侯颖,等.超高效液相色谱-电喷雾串联质谱测定蔬菜水果中27种常见农药残留[J].现代农药,2011,10(3):31-35,38.
[4]李广领,姜金庆,王自良,等.气相色谱法检测卷心菜中啶虫脒和吡虫啉残留[J].西北农业学报,2010,19(9):71-74.
[5]康燕玉.UPLC法快速测定白菜中啶虫脒残留量[J].福建分析测试,2010,19(4):55-58.
[6]Qi Zhang,Defu Cai,Jianhua Liu.Matrix solid - phase dispersion extraction coupled with HPLC-diode arraydetection method for the analysis of sesquiterpene lactones in root of Saussurea lappa C.B.Clarke[J].Journal of Chromatography B,2011,879:2809-2814.
[7]张立金,王晓.基质固相分散—气相色谱—质谱法检测蔬菜中的农药多残留[J].山东科学,2010,23(1):11-14.
[8]Chambers A,park C,Baker R K,et al.Hydrogen Storage in GraPnite Nanofibers[J].Journal of Physical Chemistry B,1998,102:4253-256.
[9]张茜,张公信,李晓芬,等.碳纳米管丝网印刷电极测定鞣花酸[J].云南民族大学学报:自然科学版,2012,21(3):167-169.
[10]赵海香,史文礼,孙大江,等.多壁碳纳米管-固相萃取分析有机磷农药残留[J].分析化学(FENXIHUAXUE)研究报告,2009,37(10):1479-1483.
[11]赵海香,贾艳霞,丁明玉,等.多壁碳纳米管固相萃取净化气相色谱法分析蔬菜中有机氯和拟除虫菊酯农药残留[J].色谱,2011,29(5):443-449.
[12]李权龙,袁东星.多壁碳纳米管用于富集水样中有机磷农药残留的研究[J].厦门大学学报:自然科学版,2004,43(4):531-535.
[13]王学翠,刘冰,张璐鑫,等.多壁碳纳米管基质固相分散-高效液相色谱测定牛奶中6种四环素[J].食品科学,2011,32(14):206-209.
[14]GB 2763-2012食品安全国家标准食品中农药最大残留限量[S].

