快速溶剂萃取法提取枇杷核中总黄酮的研究
饶桂维,梅 瑜,陈贝贝,李成平,活 泼
(浙江树人大学生物与环境工程学院,浙江杭州310015)
枇杷(Eriobotrya japonica)为蔷薇科植物枇杷的果实,因形似琵琶而得名。杭州塘栖枇杷为全国三大枇杷产地之一,出产的枇杷产量多,品质上乘。枇杷果实除鲜食外,果肉可生产枇杷酒、罐头、饮料等。但枇杷核未得到有效利用,常作为废料丢弃。而枇杷核中含有苦杏仁苷、芦丁、游离氢氰酸、绿原酸和枇杷果浆多酚氧化酶等多种药用成分,开发潜力巨大[1-4]。黄酮类化合物广泛存在于植物中,具有多种药理作用,如具有抗氧化性、清除自由基、治疗心脑血管疾病、抗炎作用和抗菌作用等。此外,黄酮类化合物还是重要的功能食品添加剂、天然抗氧化剂、天然色素和天然甜味剂[5]。因此研究枇杷核中黄酮类物质的提取技术,为综合利用枇杷资源,增加枇杷种植农户的经济效益有很大帮助[6]。快速溶剂萃取法(Accelerated Solvent Extraction,ASE)是最近发展起来的低耗、高效的萃取技术。其原理是在密闭容器内,在高温(40~200℃)和高压(10~20MPa)的条件下,用溶剂萃取固体或半固体样品的新颖样品前处理方法[7]。较常规提取方法具有耗时少、消耗溶剂少、提取效率高、操作多模式以及操作过程自动化等优点,广泛运用于环境监测、药物分析、食品检测等诸多领域当中[8-10]。本实验以枇杷核中总黄酮的提取率为指标,以分光光度法为检测方法,用单因素和正交实验对快速溶剂萃取法从枇杷核中提取总黄酮的工艺条件进行优化。寻找最佳提取工艺条件,为枇杷核的综合利用提供理论基础。
1 材料与方法
1.1 材料与仪器
枇杷核 产自浙江杭州塘栖,去肉洗净后,于50℃恒温鼓风干燥箱中烘干,粉碎机粉碎,过1#标准筛,备用;芦丁 中国药品生物制品检定所;无水乙醇、硝酸铝、亚硝酸钠、氢氧化钠 均为分析纯;水为超纯水。
ASE-350快速溶剂萃取仪 美国戴安公司;UV-2450紫外可见光分光光度计 日本岛津公司;RE-3000A旋转蒸发器 上海亚荣公司;FD-1D-50冷冻干燥机 北京博医康实验仪器有限公司;FW80高速万能粉碎机 天津泰斯特仪器有限公司;AB204-N电子分析天平 梅特勒托利多仪器有限公司;TD4Z低速离心机 湖南凯达实验发展有限公司。
1.2 提取工艺方法
称取适量枇杷核粉,加等量硅藻土混匀,置于萃取池内,设定提取温度、提取时间、提取次数,以一定浓度乙醇为提取剂,进行提取。提取结束后,减压浓缩提取液,再经冷冻干燥得到提取物。
1.3 测定方法
1.3.1 芦丁标准溶液的配制 精确称取干燥的无水芦丁(作黄酮标准对照品)20mg于小烧杯中,加入60%乙醇适量,微热使之溶解,冷却后置于100mL容量瓶中,用60%乙醇稀释至刻度并摇匀,即得芦丁溶液浓度为0.2mg/mL的标准溶液。精确量取上述标准溶液0.0 、0.5、1.0、1.5、2.0、2.5mL 分别置于10mL 容量瓶中,各加入60%乙醇约至5mL,后各精确加入5%亚硝酸钠溶液0.3mL,摇匀,放置6min;再各精确加入5%硝酸铝溶液0.3mL摇匀,放置6min;然后各加1mol/mL氢氧化钠溶液4mL,分别用水稀释至10mL,摇匀,放置15min。于510nm波长测定吸光度。以试剂空白为参比,绘制曲线,获得标准曲线的回归方程为:y=0.0114A+0.0030,相关系数R2=0.9993。方程中y为芦丁的浓度,A为所测得的吸光度[10]。
1.3.2 枇杷核总黄酮含量的测定 将各实验所得提取液用旋转蒸发仪减压浓缩至干,再进行冷冻干燥12h,最终得到固体提取物。然后准确称取固体提取物,加适量的60%乙醇溶解,溶液移入50mL的容量瓶中,用60%乙醇定容。准确移取上述溶液1.0mL于10mL的容量瓶中,加入60%乙醇约至5mL,精确加入5%亚硝酸钠溶液0.3mL,摇匀,放置6min;再各精确加入5%硝酸铝溶液0.3mL,摇匀,放置6min,加1mol/L氢氧化钠溶液4mL,分别用水稀释至10mL,摇匀,静置15min后4000r/min离心5min,取上清液作为供试品溶液,于紫外分光光度计波长510nm处检测[11]。
1.3.3 总黄酮提取得率的计算 将样品所测得的吸光度代入标准曲线求出供试品浓度,再根据稀释倍数和所取体积推算出提取样品的量,除以称样量即为总黄酮提取得率。

1.4 单因素及正交实验
通过对提取剂乙醇浓度,快速溶剂萃取仪的三个参数:温度、提取次数、提取时间进行单因素实验,进而确定正交实验参数范围。
在单因数实验所得结果的条件下,对4个因数进行三水平正交实验设计[12],各水平因素见表1。
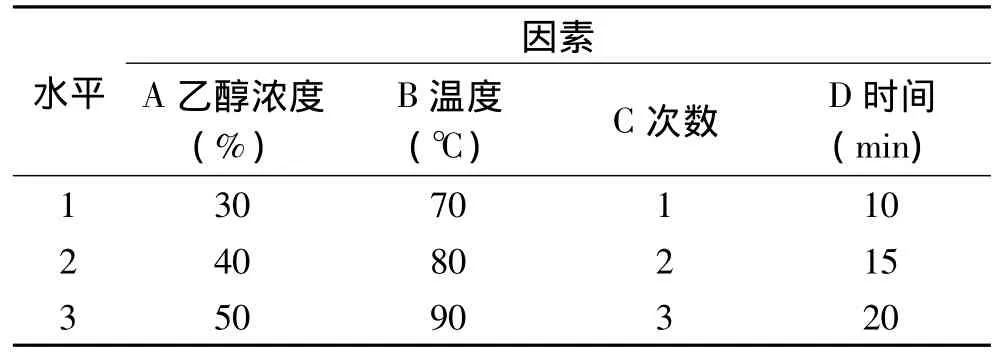
表1 各因素水平设定Table 1 Factors and levels of orthogonal test
2 结果与分析
2.1 温度对得率的影响
设定乙醇浓度为80%,提取时间为5min,提取次数1次。取干燥的枇杷核粉1.00g与等量硅藻土混匀,置于萃取池内,分别在 40、60、80、100、120℃温度下进行提取,测定提取液中的总黄酮含量,计算黄酮得率,结果见表2。

表2 温度对总黄酮得率的影响Tables 2 Effect of temperature on extraction
由表可见,在80℃时,得率最高,为1.71%。但随着温度的继续增加,得率则有所下降,这可能是由于一些黄酮类在高温下被分解的缘故。故在80℃左右最为合适。
2.2 提取时间对得率的影响
以提取次数1次,提取温度80℃,乙醇浓度80%为固定条件,分别取干燥的枇杷核粉1.00g与等量硅藻土混匀,置于萃取池内,分别提取 5、10、15、20、25min,测定提取液中的总黄酮含量,计算黄酮得率,实验结果见表3。
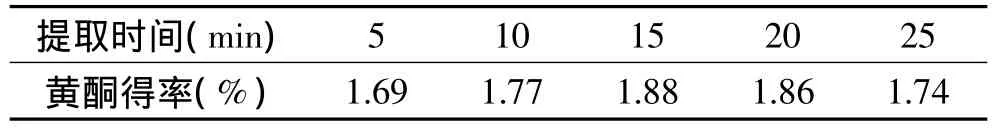
表3 提取时间对总黄酮得率的影响Table 3 Effect of time on extraction
由表3的数据可得,黄酮得率随着时间增加而赠加,在15min的时候达到最大值1.88%,但随着时间继续加长,得率开始有所下降。提取时间的加长,能让枇杷核中的黄酮提取更完全,但在较高温度下保持的时间的加长,可能使黄酮分解及氧化,造成得率下降。
2.3 乙醇浓度对得率的影响
分别取干燥的枇杷核粉1.00g与等量硅藻土混匀,置于萃取池内,在温度80℃,提取次数1次,提取时间15min的固定条件下,分别采用浓度为20%、40%、60%、80%、100%的乙醇溶液进行提取,测定提取液中的总黄酮含量,计算黄酮得率,实验结果见表4。

表4 乙醇浓度对总黄酮得率的影响Table 4 Effect of alcohol concentration on extraction
如表4所示,在乙醇浓度为40%时,表现为得率最高,为1.94%,之后随着乙醇浓度的增加,得率有所降低。这表明枇杷核中的黄酮类化合物在乙醇浓度为40%时溶解性最好,故后面的操作采用40%的乙醇浓度进行提取。
2.4 提取次数对得率的影响
固定乙醇浓度为40%,提取时间为15 min,提取温度为80℃不变。分别取干燥的枇杷核粉1.00g与等量硅藻土混匀,置于萃取池内,分别提取1、2、3、4、5次,测定提取液中的总黄酮含量,实验结果见表5。

表5 提取次数对总黄酮得率的影响Table 5 Effect of frequency on extraction
由表5的数据得到,黄酮的提取得率随着提取次数的增加,不断地提高,当3次以后,走势趋于平缓。从效益方面来考虑,3次应为最佳提取次数。
2.5 正交实验
在以上单因数实验所得结果的条件下,确定以乙醇浓度,提取温度,提取时间,提取次数4个因数进行三水平正交实验设计[12],正交实验结果见表6。
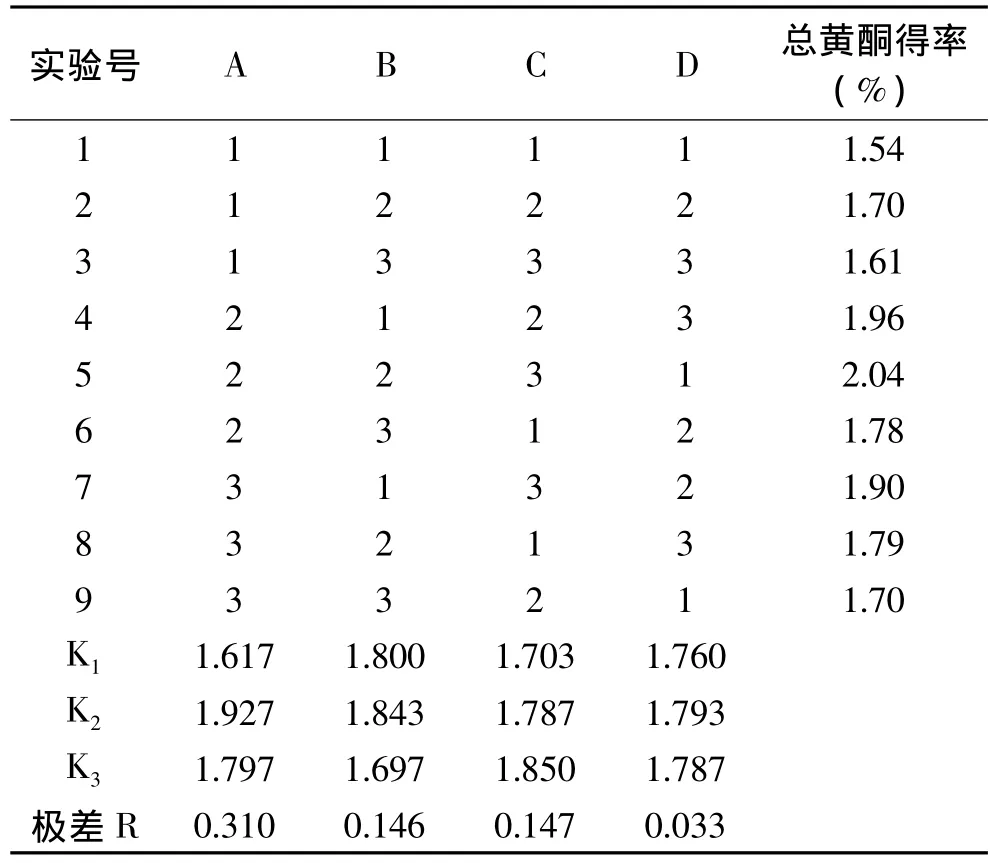
表6 正交实验结果Table 6 Results of orthogonal test
K1,K2,K3为分别为各个因数的 1,2,3 水平得率的平均均值,R为极值,即3水平中的最大值与最小值之差,R越大,则表示该因数对枇杷核中总黄酮得率影响越大。从实验结果的数据分析,影响总黄酮得率的主次顺序为乙醇浓度>提取次数>温度>提取时间,其中提取时间影响效果不明显,这可能跟快速溶剂萃取法原本萃取时间就很短有关系,通过分析正交实验中不同因素的平均值,得出枇杷核总黄酮的理论最优提取条件应当是A2B2C3D2。故提取的最佳工艺为:乙醇浓度40%,温度80℃,提取次数3次,提取时间15min。
2.6 优化条件的验证结果
取1.00g枇杷核加等量硅藻土于萃取池,采用实验得出的最佳工艺条件进行萃取,平行做3份,得出其得率分别为;2.08%,2.07%,2.08%,平均值为2.07%。测定结果比正交实验中任何一组皆高,证明了结果的合理性。
3 结论
经过单因素和正交实验得出,采用快速溶剂萃取法提取枇杷核粉中的总黄酮的最佳工艺条件为:乙醇浓度40%,温度80℃,提取次数3次,提取时间15min。在此提取条件下枇杷核粉的总黄酮得率可达2.07%。本提取工艺相比传统的提取方法,具有耗时少、消耗溶剂少和提取效率高等优势,在枇杷核中黄酮类化合物的提取开发应用中,具有一定的优势[15-16]。
[1]汤凤霞,陈发河,郭进文.枇杷果浆多酚氧化酶活性抑制的研究[J].食品工业科技,2004,25(4):54-57.
[2]翟小芬,蔡健.枇杷的营养保健与开发利用[J].广州食品工业科技,2004,20(3):104-106.
[3]张玉,王建清.枇杷的营养及功能成分研究进展[J].食品科学,2005,26(9):602-604.
[4]李鹰,赵启超,李英兰.枇杷核提取物对机体免疫功能影响的探讨[J].中医药信息,1999(1):51-52.
[5]李楠,刘元,侯滨滨.黄酮类化合物的功能特性[J].食品研究与开发,2005,26(6):139-141.
[6]钱建林.白沙枇杷叶黄酮类物质提取工艺的研究[J].食品科学,2007,28(7):252-254.
[7]叶明立,朱岩.ASE加速溶剂萃取技术在食品、农残方面的分析应用[J].现代科学仪器,2003(1):35-36.
[8]唐巧玉,周毅峰.快速溶剂萃取法提取水芹中总黄酮工艺研究[J].食品科学,2010,31(22):190-193.
[9]宋国胜,胡青松,李琳.超声波技术在食品科学中的应用[J].现代食品科技,2008,24(6):165-169.
[10]胡建平,罗舒月.葛根中黄酮提取工艺的研究[J].食品工业科技,2008,29(8):227-234.
[11]吴娜,张瑞巧,孙智达.艾蒿中黄酮类化合物的提取工艺研究[J].食品工业科技,2008,29(1):230-232.
[12]李会军,李萍.紫外分光光度法测定酸枣仁中总黄酮的含量[J].中国药科大学学报,200l,32(1):73-74.
[13]万建波,徐辰,李绍平,等.葛根异黄酮成分的加压溶剂提取法研究[J].分析化学,2005,33(10):1435-1438.
[14]王钦德.食品实验设计与统计分析[M].北京:中国农业大学出版社,2003:152-362.
[15]焦士蓉,王玲.枇杷核黄酮类物质微波法提取及对羟自由基清除作用研究[J].食品科学,2006,27(9):84-87.
[16]贤景春.枇杷核总黄酮的超声提取及其抗氧化性研究[J].广东农业科学,2011,38(3):82-89.

